|
تضامنًا مع حق الشعب الفلسطيني |
أكسجين
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| غاز عديم اللون في الشروط القياسية الخطوط الطيفية للأكسجين | |||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||
| الاسم، العدد، الرمز | أكسجين، 8، O | ||||||||||||||||||||||||
| تصنيف العنصر | لا فلز؛ كالكوجين | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 16، 2، p | ||||||||||||||||||||||||
| الكتلة الذرية | 15.9994 غ·مول−1 | ||||||||||||||||||||||||
| توزيع إلكتروني | 1s2 2s2 2p4 | ||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 6 (صورة) | ||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||
| الطور | غاز | ||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كيلوباسكال) 1.429 غ/ل | ||||||||||||||||||||||||
| كثافة السائل عند نقطة الغليان | 1.141 غ·سم−3 | ||||||||||||||||||||||||
| نقطة الانصهار | 54.36 ك، -218.79 °س | ||||||||||||||||||||||||
| نقطة الغليان | 90.20 ك، -182.95 °س | ||||||||||||||||||||||||
| النقطة الحرجة | 154.59 ك، 5.043 ميغاباسكال | ||||||||||||||||||||||||
| حرارة الانصهار | O2) 0.444) كيلوجول·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | O2) 6.82) كيلوجول·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (O2) 29.378 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||
| أرقام الأكسدة | 2، 1، −1، −2 | ||||||||||||||||||||||||
| الكهرسلبية | 3.44 (مقياس باولنغ) | ||||||||||||||||||||||||
| طاقات التأين | الأول: 1313.9 كيلوجول·مول−1 | ||||||||||||||||||||||||
| الثاني: 3388.3 كيلوجول·مول−1 | |||||||||||||||||||||||||
| الثالث: 5300.5 كيلوجول·مول−1 | |||||||||||||||||||||||||
| نصف قطر تساهمي | 2±66 بيكومتر | ||||||||||||||||||||||||
| نصف قطر فان دير فالس | 152 بيكومتر | ||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||
| البنية البلورية | نظام بلوري مكعب | ||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | ||||||||||||||||||||||||
| الناقلية الحرارية | 26.58x10-3 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||
| سرعة الصوت | (غاز، 27 °س) 330 متر/ثانية | ||||||||||||||||||||||||
| رقم CAS | 7782-44-7 | ||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الأكسجين | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
الأُكسجِين[1] هو عنصر كيميائي رمزه O وعدده الذرّي 8، ويقع ضمن عناصر الدورة الثانية وعلى رأس المجموعة السادسة عشر (المجموعة السادسة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري، والتي تدعى باسم مجموعة الكالكوجين، وهو عنصر مجموعة رئيسي. يصنّف الأكسجين ضمن اللافلزّات، ويكون في الشروط العاديّة من الضغط ودرجة الحرارة على شكل غاز ثنائي الذرّة O2. ليس له لون أو طعم أو رائحة.
يتميّز الأكسجين الذرّي بنشاطه الكيميائي الكبير، حيث أنّه من المؤكسدات القويّة، ويميل إلى الارتباط مع العناصر الأخرى لتشكيل المركّبات الكيميائيّة، وخاصّة الأكاسيد. كما يعدّ أحد أهمّ العناصر الموجودة في الأرض، وهو واسع الانتشار، حيث يشكّل غاز الأكسجين 20.94% من تركيب الغلاف الجوّي للأرض؛ بالإضافة إلى وجود شكل متآصل منه وهو الأوزون O3. إنّ أكثر العناصر وفرة في القشرة الأرضية هو الأكسجين، حيث يوجد بنسبة 48.9% وزناً، وهو يأتي في المرتبة الثانية بعد الحديد من حيث وفرة العناصر في تركيب الأرض ككل. يوجد الأكسجين الذرّي بوفرة في الكون، حيث يعدّ ثالث عنصر من حيث الوفرة بعد الهيدروجين والهيليوم. هناك ثلاثة نظائر مستقرّة للأكسجين 16O و 17O و 18O، أكثرها وفرةً هو الأكسجين-16، حيث تبلغ وفرته الطبيعيّة 99.8%.
للأكسجين أهميّة حيويّة كبيرة جداً، حيث لا غنى عنه لاستمرار الحياة على سطح الأرض ، فهو أساس عملية التنفّس الخلوي عند الإنسان والحيوانات، كما يدخل في عملية التركيب الضوئي عند النباتات. بالإضافة إلى ذلك فهو أساس عملية الاحتراق، كما يسهم في عمليات التآكل.
التاريخ وأصل التسمية
التجارب الأولى
كانت عملية الاحتراق منذ قرون العصر الحجري أحد أكثر الظواهر فائدةً بالنسبة للإنسان عبر تاريخه، وفي نفس الوقت أحد أكثر الظواهر غموضاً في تفسيرها. انبرى لتفسير هذه الظاهرة عددٌ كبيرٌ من الفلاسفة والعلماء منذ عصور الإغريق وما بعدهم، مثل فيلو البيزنطي،[2] مروراً بعلماء الخيمياء والكيمياء المسلمين في العصور الوسطى، وقدّموا لذلك العديد من التفسيرات، حيث كانت النار أحد العناصر التقليديّة الأربعة التي يتكوّن منها الكون حسب المفهوم السائد آنذاك.
في العصور التالية، ومع بداية عصر النهضة الأوروبية قام ليوناردو دا فينشي بإعادة تجربة فيلو البيزنطي، والتي قام فيها بتنكيس إناء فوق شمعة مشتعلة مع إحاطة عنق الإناء بالماء، فوجد ارتفاع منسوب الماء بشكل تدريجي مع مرور الوقت. لاحظ دافنشي أنّ قسماً من الهواء يُستهلك أثناء الاشتعال وأثناء التنفس.[3] في أواخر القرن السابع عشر برهن روبرت بويل أنّ الهواء ضروري من أجل عملية الاحتراق، إلّا أنّ العالم جون مايو (1641–1679) أظهر فيما بعد وبشكل أدقّ أنّ قسماً فقط من الهواء هو الذي يلزم لعمليّة الاحتراق، وأسماه spiritus nitroaereus.[4][5] لاحظ مايو أيضاً أن الأنتيموان يزداد وزنه عندما يسخّن، واستنتج من ذلك أنّ المادّة التي أسماها nitroaereus هي التي تتّحد مع الفلزّ.[4] نشر مايو أبحاثه سنة 1668 تحت اسم "De respiratione".[5]
نظرية الفلوجستون
ظهر في القرن السابع عشر في أوروبا مفهوم وجود مادّة خفيّة وخفيفة تسهم في عملية الاحتراق، وكانت تسمى فلوجستون، والتي كان يزعم أنّها تتحرر عند احتراق المادّة، حيث أنّ الحرارة كانت تفهم على أنّها مادّة.
على الرغم من أنّ إنتاج الأكسجين قد تمّ في تجارب مخبريّة على يدي كل من روبرت هوك وأولة بورك وميخائيل لومونوسوف، إلّا أنّ هؤلاء العلماء لم يتعرّفوا على الأكسجين كعنصر كيميائي مستقل.[6] ويعود سبب ذلك إلى سواد الفكرة الفلسفيّة للاحتراق والمبنيّة على نظرية الفلوجستون، والتي أطلقها الخيميائي يوهان يواخيم بيشر سنة 1667، ثم عدّلت من قبل الكيميائي غيورغ شتال سنة 1731، ممّا ساهم في انتشارها.[7]
كانت نظرية الفلوجستون تنصّ على أنّ المادّة القابلة للاشتعال مكوّنة من قسمين، الأوّل من الفلوجستون، والذي ينطلق عند الاحتراق، والثاني كان يدعى كالكس calx، والذي كان يظنّ أنّه المكوّن الحقيقي للمادّة.[3] بالتالي فإنّ المواد التي كانت تحترق دون أن تترك كثيراً من الرماد كان يظنّ أنّ معظمها مؤلّف من الفلوجستون، مثل الخشب أو الفحم، في حين أنّ المواد غير القابلة للاشتعال والتي تتآكل مثل الحديد، فإنّها تحوي القليل منه. ما عزّز من انتشار هذه النظرية هو عدم معرفة أنّ الغازات المنطلقة من عمليّة الاحتراق لها كتلة، إذ أن معظم المواد التي كانت تحرق كان وزنها ينقص.[3] بالمقابل، مع ازدياد عدد الباحثين في مجال الاحتراق، وملاحظة ازدياد وزن الفلزات عند تآكلها، على الرغم من أنّها حسب نظرية الفلوجستون يجب أن تنقص، كلّ ذلك أدّى إلى تصدّع هذه النظريّة.
الاكتشاف

كان كارل فلهلم شيله أوّل من اكتشف عنصر الأكسجين كعنصر كيميائي مستقلّ وذلك سنة 1771، إلّا أنّه لم ينشر أبحاثه إلّا سنة 1777، وفي تلك الأثناء، وفي سنة 1774 قام جوزيف بريستلي وبشكل منفصل ومستقل باكتشاف العنصر أيضاً أثناء البحث في آليّة عمليّة الاحتراق.[8]

ففي سنة 1771 قام العالم كارل فلهلم شيله أثناء أبحاثه على مفهوم الاحتراق بتسخين مركّبات مثل أكسيد المنغنيز الرباعي أو فوق منغنات البوتاسيوم مع حمض الكبريتيك المركّز (كان يدعى حينها زيت الزاج)، فحصل على غاز عديم اللون. كان الغاز الناتج يساعد على عمليّة الاحتراق، فأسماه شيله باسم هواء النار، ونسبه إلى مصدره فأسماه أيضاً هواء الزاج، ووجد أيضاً أنّ الهواء العادي يتكوّن من ذلك الهواء المساعد على الاشتعال، ومن هواء غير مساعد على الاشتعال، أسماه الهواء الفاسد. لم يقم شيله بنشر أبحاثه فوراً، بل أرسلها من أجل النشر سنة 1775، ولم تنشر إلّا في سنة 1777، وذلك تحت عنوان «أطروحة عن الهواء والنار».[9]
وخلال تلك الأثناء وبشكل منفصل تمكّن العالم جوزيف بريستلي بعد حوالي سنتين من اكتشاف شيله بعمل تجارب على مركّبات الزئبق، حيث قام بتسخين أكسيد الزئبق الثنائي HgO بوضعه في أنبوب وتسليط أشعّة الشمس المركّزة عليه، فحصل على غاز يساعد على الاحتراق، أسماه "dephlogisticated air"،[10] وقام بنشر أبحاثه سنة 1774 تحت عنوان «بحث في اكتشافات جديدة في الهواء»، والتي أدرجها ضمن كتابه «تجارب وملاحظات على أنواع مختلفة من الهواء».[3] كان بريستلي السبّاق في نشر أبحاثه حول الاكتشاف، في حين أنّ شيله لم يقم بنشر أبحاثه إلا سنة 1777،[11] لذلك ينسب البعض اكتشاف الأكسجين إلى بريستلي.

على الرغم من اكتشاف هذا الغاز من قبل هذَين العالِمَين، إلّا أنّ دوره الفعلي في عمليّة الاحتراق لم يكن قد فُهم بعد، إلى أن أتى العالم أنطوان لافوازييه ووضّح من خلال تجاربه سنة 1774 أنّ الاحتراق لا يطلق الفلوجستون كما كان يعتقد في تلك الآونة، إنّما يتمّ عن طريق الارتباط مع عنصر كيميائي موجود في الهواء المساعد على الاحتراق. من أجل توضيح ذلك، بيّن لافوازييه أنّ المادّة عندما تحترق لا يقلّ وزنها، بل العكس يزيد، وذلك نتيجة لارتباط ذلك العنصر. كما بيّن أنّ الهواء هو مزيج من غازين، الأوّل يساعد على الاحتراق وعلى التنفّس أسماه هواء الحياة vital air، ومن الهواء غير المساعد على الحياة وأسماه آزوت (الاسم الفرنسي للنتروجين)، ونشر أبحاثه سنة 1777 تحت عنوان «عن الاحتراق بشكل عام».[10] في سنة 1777 أعاد لافوازييه تسمية العنصر المساعد على الاحتراق باسم oxygène، وذلك من الإغريقيّة ὀξύς (أكسيس) بمعنى حمض أو لاذع، ومن γεννάω (جين) بمعنى مولّد، أي أنّ الكلمة تحمل معنى مولّد الحمض، حيث أنّه كان يعتقد خاطئاً أنّ الأكسجين كان أساسياً لتشكيل جميع الأحماض على الإطلاق،[12] وذلك انطلاقاً من أنّ أكثر الأحماض اللاعضويّة المعروفة في ذلك الزمن كانت تحوي على عنصر الأكسجين، إلى أن عرف بعد ذلك أنّ هناك أحماض لا تحوي الأكسجين، وأنّ أساس الأحماض هو الهيدروجين، إلا أنّ الاسم بقي على ما هو عليه.
التاريخ اللاحق
أيقن العلماء في أواخر القرن التاسع عشر أنّه يمكن إسالة الهواء، وبالتالي فصل مكوّناته وذلك عن طريق الضغط والتبريد. وكان الفيزيائي راؤول بكتيه أوّل من سيّل الأكسجين سنة 1877، وذلك عندما كان يعمل على تبخير ثنائي أكسيد الكبريت السائل من أجل إسالة ثنائي أكسيد الكربون، والذي تبخّر بدوره ليبرّد الأكسجين بشكل كافٍ لتسييله بشكل مؤقّت. أرسل بكتيه برقية إلى الأكاديميّة الفرنسيّة للعلوم لإعلامهم باكتشاف الأكسجين السائل.[13] وبعد ذلك بيومين فقط، أعلن الفيزيائي لويس بول كايتيه طريقته الخاصّة في إسالة الأكسجين الجزيئي.[13] في كلتا الحالتين، كانت كميّة الأكسجين المسيّل غير كافية للتوثيق، بالإضافة إلى عدم استقرار الحالة الفيزيائيّة للعيّنات، إلى أن تمكّن كل من كارول أولشيفسكي وزيغمونت فروبليفسكي في سنة 1883 من الحصول على الأكسجين السائل بحالة مستقرّة.[14] كان كارل فون ليندة أوّل من قام بإسالة الغازات على مستوى صناعي وذلك سنة 1895 من خلال عملية ليندة الصناعيّة.[15] وفي سنة 1891 تمكّن العالم جيمس ديوار من الحصول على كمّيّة كافية من الأكسجين السائل لدراسته.[16] لاحقاً، وفي سنة 1901 ظهرت تقنية لحام باستخدام مزيج من الأسيتيلين والأكسجين المضغوط.[15]
الوفرة الطبيعيّة
إنّ الأكسجين هو أكثر العناصر الكيميائيّة وفرةً في الأرض من حيث الكتلة، وهو ثالث أكثر العناصر وفرةً في الكون بعد الهيدروجين والهيليوم.
| ع. ذ. | العنصر | الكسر الكتلي مقدّر بأجزاء في المليون | ||
|---|---|---|---|---|
| 1 | هيدروجين | 739,000 | 71 × مرّة من الأكسجين (العمود الأحمر) | |
| 2 | هيليوم | 240,000 | 23 × مرّة من الأكسجين (العمود الأحمر) | |
| 8 | أكسجين | 10,400 | ||
| 6 | كربون | 4,600 | ||
| 10 | نيون | 1,340 | ||
| 26 | حديد | 1,090 | ||
| 7 | نتروجين | 960 | ||
| 14 | سيليكون | 650 | ||
| 12 | مغنيسيوم | 580 | ||
| 16 | كبريت | 440 | ||
في الكون
يأتي الأكسجين في المرتبة الثالثة من حيث وفرة العناصر الكيميائيّة في الكون، وذلك بعد الهيدروجين والهيليوم.[18] تبلغ قيمة الكسر الكتلي للأكسجين في النظام الشمسي حوالي 0.8 %، مما يوافق كسر عددي (ذرّي) بحوالي 500 جزء في المليون.[19] لا يوجد الأكسجين في الفضاء الخارجي بالشكل الجزيئي O2 إلّا بكمّيّات نادرة وقليلة جداً، حيث يكون في الغالب مرتبطاً في مركّبات مع ذرّات الغبار الكوني.[20]
لم يتكوّن الأكسجين في بداية كناتج لعمليّة تخليق الانفجار العظيم النووي للعناصر، إنّما تكوّن كلّ نظيرٍ من نظائر الأكسجين بطريقة محدّدة. فمعظم كمّيّات النطير 16O قد تشكّلت بكمّيّات كبيرة في النجوم العملاقة من خلال عمليّة احتراق الهيليوم (عملية ألفا الثلاثيّة)، مع وجود كمّيّات تشكّلت في عملية احتراق النيون.[21] يتمّ في عملية ألفا الثلاثيّة تفاعل ثلاث نوى من الهيليوم للحصول على 12C، والذي يتفاعل بدوره مع نواة هيليوم إضافيّة (جسيم ألفا) لينتج 16O. ينتج 17O بشكل أساسي من عمليّة احتراق الهيدروجين وتحوّله إلى هيليوم في تفاعلات دورة CNO النوويّة، ممّا يجعله من النظائر الشائعة الوفرة في مناطق احتراق الهيدروجين في النجوم.[21] أمّا 18O فيُحصل عليه من اندماج أربع نوى من الهيليوم 4He مع نواة من 14N، ممّا يجعل أكسجين-18 من النظائر شائعة الوفرة في المناطق الغنيّة بالهيليوم أثناء مراحل تطوّر النجوم العملاقة.[21]
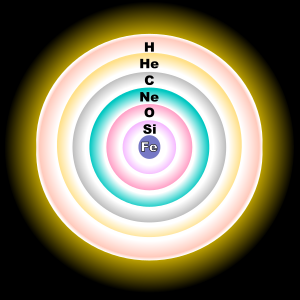
يلعب الأكسجين دوراً مهمّاً في توليد الطاقة في نجوم النسق الأساسي مثل الشمس، وهو يعدّ أحد مكوّناتها الثانويّة بنسبة تصل إلى 0.9% من كتلتها.[10] في دورة كربون-نيتروجين-أكسجين (دورة CNO) المهمّة في تخليق النجوم، يدخل الأكسيجن على هيئة ناتج وسطي في التفاعلات النوويّة. في المراحل الأخيرة من تطوّر النجوم العملاقة تحدث عملية احتراق الأكسجين كخطوة من أجل استهلاك الأكسجين كوقود نووي، وذلك من أجل تشكيل نوى نجوم أكثر ضخامة. تحوي أغلب الأقزام البيضاء، والتي تمثل مآل حوالي 97% من كافّة النجوم، على عنصر الأكسجين في تركيبها بالإضافة إلى الهيليوم والكربون.[22]
إنّ كوكب الأرض غنيّ بالأكسجين وذلك بالمقارنة مع أقرانه من الكواكب القريبة، حيث تبلغ نسبة الأكسجين في المريخ حوالي 0.1% حجماً، وهي أقلّ بذلك بكثير في كوكب الزهرة. ينتج الأكسجين في الكوكبين المذكورين بشكل حصري من الأشعّة فوق البنفسجيّة التي يمكن أن تفكّك الجزيئات الحاوية على الأكسجين مثل ثنائي أكسيد الكربون.
على الأرض
إنّ الأكسجين هو أكثر العناصر الكيميائيّة انتشاراً على سطح الأرض.[23] فبالإضافة إلى وجوده في غلاف الأرض الجوي، فهو يتوفّر في كل من غلاف الأرض الصخري وغلاف الأرض المائي وغلاف الأرض الحيوي. تبلغ قيمة الكسر الكتلي للأكسجين في الغلاف الأرضي ما نسبته 50.5%،[24] وذلك إلى عمق يصل إلى 16 كم في الغلاف الصخري،[25]

يوجد الأكسجين على شكل جزيء في الغلاف الجوي وعلى شكل غاز منحل في مياه البحر، في حين أنّ الشكل الأكثر انتشاراً هو دخوله في تركيب المركّبات الكيميائيّة داخل وعلى سطح الأرض. تحوي أغلب المعادن، وبالتالي الصخور، على الأكسجين في تركيبها. من ضمنها معادن السيليكات، مثل الفلدسبار والميكا ومعدن الأوليفين، والكربونات (مثل كربونات الكالسيوم في الحجر الجيري) والأكاسيد (مثل ثنائي أكسيد السيليكون في الكوارتز).[24]
يشكّل الأكسجين 20.95% حجماً من الهواء،[26] والتي تعادل 23.16% كتلةً،[10][26][27] في حين أنّ نسبته في الماء تبلغ 88.8%.[10][26] تجدر الإشارة إلى أنّ نسبة الأكسجين في ماء البحر (86%) أقلّ منها في الماء العادي، وذلك بسبب وجود كمّيّات كبيرة من الأملاح المنحلّة التي لا تحوي في تركيبها على الأكسجين، مثل كلوريد الصوديوم.
يعود ارتفاع نسبة الأكسجين في الأرض إلى دورة الأكسجين، وهي دورة حيويّة جيولوجيّة كيميائيّة (بيوجيوكيميائية)، تصف حركة الأكسجين ضمن الأغلفة الثلاثة الأساسية للأرض، وهي الغلاف الجوي والحيوي والصخري. إنّ العامل الأساسي المحرّك لدورة الأكسجين هو التركيب الضوئي، والذي يعدّ مسؤولاً عن الشكل الحالي للغلاف الجوّي للأرض. يتحرّر الأكسجين من عملية التركيب الضوئي إلى الغلاف الجوي، بالمقابل، فإن التنفّس الخلوي للكائنات على سطح الأرض، وتحلّلها في باطن الأرض، يزيلها من الغلاف الجوّي. بالتالي فإنّ كمّيّة الأكسجين الموجوة في الأرض تبقى ثابتة وتكون في حالة من التوازن. في التوازن الحالي يحدث الإنتاج والاستهلاك في نفس المعدّل، وهو تقريباً 1/2000 من كمّيّة أكسجين الغلاف الجوي الكلّيّة كلّ سنة. تدعى هذه الحالة التي يوجد فيها الأكسجين من التوازن باسم الحالة الثابتة. تشير الأبحاث التي تراقب مستويات الأكسجين في الغلاف الجوّي إلى حدوث تناقص تدريجي، والذي يعود سببه إلى استهلاك الطاقة عبر حرق الوقود الأحفوري.[28]
الإنتاج والتحضير
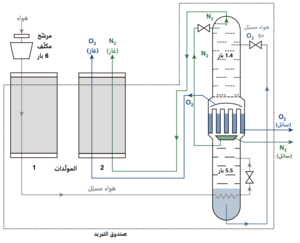
ينتج الأكسجين صناعياً في الوقت الراهن بشكل كامل تقريباً من إسالة الهواء وتقطيره بشكل مجزّأ ومستمر. تسمّى هذه العملية باسم عملية ليندة، والتي تنسب إلى كارل فون ليندة الذي طوّرها أوّل مرّة سنة 1902، ثمّ طورها جورج كلود لاحقاً لجعل العملية أكثر ربحيّة اقتصادياً.[25] كما يمكن الإنتاج من خلال عملية امتزاز الهواء على الزيوليت لفصل الغازات المرافقة والإبقاء على الأكسجين. يبلغ إنتاج الأكسجين من الطرق المعتمدة على الهواء حوالي 100 مليون طن سنوياً.[9]
لإنتاج الأكسجين حسب طريقة كلود، يتمّ ضغط الهواء بواسطة ضاغط إلى حوالي 5-6 بار، ثم يبرّد وينقّى من ثنائي أكسيد الكربون وبخار الماء والغازات الأخرى بواسطة مرشّح. يبرّد الغاز عن طريق تمريره عبر مبادل حراري تمرّ فيه غازات من العمليّة إلى درجات حرارة قريبة من نقطة غليانها، ثم يسمح لها بالتمدّد في حجرات توربينيّة، بالتالي يمكن إعادة كسب جزء من الطاقة التي صرفت على الضغط.[29] هذه الجزئية من عملية كلود، هي التي توفّر في الطاقة بالمقارنة مع عمليّة ليندة الأصلية، ممّا يجعل عمليّة كلود أكثر اقتصاديّة.
تتمّ عمليّة الفصل الفعليّة لمزيج الأكسجين والنتروجين المكوّن للهواء من خلال عملية تقطير تجري في عمودي تجزئة لهما ضغطان مختلفان. تحدث عملية التقطير حسب مبدأ التيار المعاكس، أي أنّ الغاز المتبخّر يكسب طاقة عن طريق حرارة التبخّر ويندفع إلى أعلى العمود، أمّا السائل المتكثّف فيقطر إلى الأسفل. بما أن للأكسجين نقطة غليان أعلى من النتروجين، فإنّه يسهل تكثيفه ويجمع عادة من أسفل العمود على شكل سائل، في حين يجمع النتروجين من أعلاه على شكل غاز.[9] يتمّ الفصل بعد ذلك عند ضغط يتراوح بين 5-6 بار،[30] في عمود تجزئة يعرف باسم عمود التجزئة متوسّط الضغط،[29] حيث يفصل النتروجين، ويؤخذ السائل المتكثّف الغنيّ بالأكسجين إلى عمود منخفض الضغط (حوالي 0.5 بار) حيث يفصل الأكسجين هناك.[30] بعد ذلك ينقّى غاز الأكسجين من الآثار النزرة للغازات النبيلة مثل الكريبتون والزينون وذلك في عمود منفصل.
يمكن الحصول على كمّيّات صغيرة من الأكسجين من عمليّات صناعيّة أخرى. فعلى سبيل المثال ينتج الأكسجين عند إنتاج الهيدروجين بالتحليل الكهربائي للماء. كما يحصل عليه من امتزاز الغازات الأخرى الموجودة في الهواء بشكل نوعي، وذلك عن طريق تمرير الهواء خلال مناخل جزيئيّة مثل الزيوليت، حيث يمتز النتروجين وثنائي أكسيد الكربون عليها، ويبقى الأكسجين مع الآرغون،[31] في مزيج غازي تتراوح فيه نسبة الأكسجين بين 90% إلى 93%.[9] بشكل متوافق يتحرر النتروجين من سرير الزيوليت المشبع بالنتروجين من خلال تخفيض الضغط في حجرة العمليّة، وبتحويل قسم من غاز الأكسجين من سرير الإنتاج وتمريره باتجاه معاكس لمجرى التدفّق. تجرى هذه العمليّة لمرّات عدّة من أجل إعادة تنشيط الزيوليت في سرير المفاعلات، ممّا يسمح بتزويد مستمر من الأكسجين الغازي. تعرف هذه العمليّة باسم امتزاز تأرجح الضغط، وهي وسيلة غير محتاجة للتبريد.[32]
من بين الطرق القديمة لإنتاج الأكسجين هناك طريقة تعتمد على التفاعلات الكيميائية لتوليد الأكسجين في جهاز مولد الأكسجين الكيميائي. تعتمد تلك الطريقة على تسخين أكسيد الباريوم بوجود الهواء إلى 500 °س، حيث ينتج فوق أكسيد الباريوم، والذي يسخن بدوره إلى 700 °س، مما يؤدي إلى تحرر الأكسجين نتيجة التفكك الحراري. كانت هذه الطريقة تمثل الخيار الوحيد للحصول على الأكسجين النقي قبل تطوير طريقة ليندة.
-
- تشكّل فوق أكسيد الباريوم
-
- تحرّر الأكسجين وانطلاقه، والحصول على أكسيد الباريوم مجدداً.
عادة ما يخزن الأكسجين المنتج صناعيّاً في أسطوانات غاز مضغوطة، وينقل عادة على شكل أكسجين مسيّل لأسباب اقتصاديّة، بحيث أن الليتر الواحد من الأكسجين المسيّل يكافئ 840 ليتر من الأكسجين الغازي عند الضغط الجوي ودرجة حرارة مقدارها 20 °س.[9]
يمكن تحضير الأكسجين مخبريّاً من تسخين بعض المركّبات اللاعضويّة الغنيّة بالأكسجين أو مفاعلتها مع مختزلات قويّة ممّا يؤدي إلى تحرير الأكسجين. من أمثلة هذه المركّبات كلّ من فوق منغنات البوتاسيوم ونترات البوتاسيوم وكلورات البوتاسيوم وكرومات البوتاسيوم. من بين الطرق الأخرى لتحضير الأكسجين مخبريّاً تفاعل تفكك الماء الأكسجيني (فوق أكسيد الهيدروجين) على صفيحة من النيكل مغطّاة بالبلاتين.[30] أو بإجراء عملية تحليل كهربائي لمحلول من البوتاس الكاوي بوجود قطب كهربائي من النيكل.
النظائر
للأكسجين ثلاثة نظائر مستقرة و14 نظيراً مشعّاً تتراوح كتلتها بين 12O و 28O[33]، وكلّ النظائر المشعّة لها عمر نصف أقلّ من ثلاث دقائق. إنّ النظائر المستقرّة للأكسجين هي أكسجين-16 16O وأكسجين-17 17O وأكسجين-18 18O، لكن أكسجين-16 هو أكثرها وفرة طبيعية، حيث تبلغ نسبته في الطبيعة 99.762%،[28] أمّا باقي النظائر فأقلّ من 1%، حيث 17O وفرته 0.037 %، في حين أنّ 18O وفرته 0.20 %.
إنّ أكثر النظائر المشعّة للأكسجين استقراراً هو النظير أكسجين-15، والذي عمر النصف له يبلغ 122.24 ثانية،[33] والنظير أكسجين-14 بعمر نصف مقداره 70.61 ثانية.[28] أمّا باقي النظائر المشعّة فلها قيم ضئيلة جدّاً من عمر النصف لا تتجاوز 27 ثانية، أضف إلى أنّ معظمها لا يتجاوز 83 ميلي ثانية.[28] إنّ أكثر نمط اضمحلال للنظائر الأخفّ من 16O هو الإصدار البوزيتروني +β [34][35][36] والذي يعطي النتروجين. أمّا أكثر نمط اضمحلال شيوعاً بالنسبة للنظائر الأثقل من 18O فهو اضمحلال بيتا ليعطي الفلور.[28]
للنظير 17O ميزة نوويّة فريدة، وهي امتلاكه لقيمة لف مغزلي نووي تبلغ 5/2 وهي قيمة مميّزة،[37] ممّا يجعل لها تطبيقات في قياسات الرنين المغناطيسي النووي NMR، أمّا باقي نظائر الأكسجين المستقرّة فلها لفّ مغزلي نووي مقداره 0، وبالتالي فهي غير فعّالة لتقنية NMR. يستخدم النظير 15O في تقنية التصوير المقطعي بالإصدار البوزيتروني.[38]

يستخدم قياس تراكيز النظير 18O في مجال علم المناخ القديم من أجل معرفة حال المناخ في العصور الجيولوجيّة القديمة في المناطق القطبيّة، وذلك بناءً على حقيقة أنّ جزيئات الماء الحاوية على 16O، هي أخفّ بنسبة 12% من جزيئات الماء الحاوية على النظير الأثقل 18O، بالتالي فهي تتبخر بشكل أسرع.[39] ممّا يعني بالتالي أنّ الطبقات الجليديّة الحاوية على نسبة مرتفعة نسبياً من 18O كانت قد تشكّلت في أوقات حارّة نسبيّاً، لأنّ حالات التبخّر الشديدة تحصل فقط في الحقبات الزمنيّة الحارّة، ممّا يؤدّي إلى تشكّل الغيوم الحاوية على نسبة مرتفعة من 18O. كلّما ارتفعت درجة حرارة الأرض كلّما ازدادت نسبة 18O في الغيوم، والتي يمكن أن تكون ضمن الهطولات المطرية أو الثلجية في الأماكن القطبيّة، أمّا في الحقبات الزمنيّة الباردة، فإنّ 18O يتركّز في الترسّبات البحريّة، إذ أنّ الجليد سيتكوّن من جزيئات الماء الحاوية على النظير الأخف 16O.[39] يرمز لهذا الأسلوب في الأوساط العلمية بالرمز δ18O. إنّ تحليل النظائر في العيّنات اللبّيّة الجليديّة أو العيّنات المأخوذة من المناطق الرسوبية في أعماق البحار، بالإضافة إلى تحديد نسبة تركيز النظيرين 18O/16O في تلك العينات بواسطة تقنية مطيافية الكتلة، يعطي معلومات عن متوسّط درجة حرارة الأرض وعن السجلّ التاريخي للاحترار العالمي في الفترات القديمة من عمر الأرض.[40] بالإضافة إلى ذلك، فإنّ تحديد عدد التفاوتات بين الأوقات الحارّة (الصيف) والأوقات الباردة (الشتاء) يفيد في معرفة عمر العيّنة اللبّيّة.
الخواص الفيزيائيّة
يكون الأكسجين في الشروط العاديّة من الضغط ودرجة الحرارة جزيئاً ثنائي الذرة O2 على هيئة غاز عديم اللون والرائحة والمذاق. يبلغ طول الرابطة O–O في جزيء الأكسجين الثنائي 121 بيكومتر، أمّا طاقة الرابطة فمقدارها 498 كيلوجول/مول.[41]
يؤدّي تبريد الأكسجين إلى الدرجة −182.95 °س (90.20 كلفن) إلى تكثيفه بحيث يُحصل على الأكسجين السائل أزرق اللون.[42] يحصل على الأكسجين السائل عالي النقاوة من التقطير التجزيئي للهواء المسيّل،[43] وهي مادّة مرتفعة النشاط الكيميائي ويجب فصلها عن المواد القابلة للاشتعال. عند درجات حرارة منخفضة جدّاً دون −218.79 °س (54.36 كلفن) يتجمّد الأكسجين على هيئة بلورات زرقاء من الأكسجين الصلب.[26][42] في الحالة الصلبة يكون لجزيئات الأكسجين مغناطيسيّة مسايرة، أمّا البنية البلّوريّة فتكون متعدّدة الأشكال حسب درجة الحرارة. ففي مجال عند درجات الحرارة بين −218.75 و −229.35 °س يكون الأكسجين في نظام بلّوري مكعّب،[26] وفي المجال بين −229.35 و −249.26 °س يكون الأكسجين في نظام بلّوري ثلاثي،[26] في حين أنّه عند درجات حرارة أقلّ من −249.26 °س يكون الأكسجين في نظام بلّوري أحادي الميل.[26] تبلغ قيمة النقطة الثلاثيّة للأكسجين عند −218.79 °س (54.36 كلفن) و 148 باسكال (0.148 كيلوباسكال)،[44] أمّا النقطة الحرجة فتقع عند ضغط مقداره 50.4 بار ودرجة حرارة مقدارها −118.4 °س (154.7 كلفن)،[45] في حين أنّ الكثافة الحرجة تبلغ قيمتها 0.436 غ/سم3.[46]

إنّ انحلاليّة غاز الأكسجين في الماء أكبر من انحلاليّة غاز النتروجين، إلّا أنّها على الرغم من ذلك تعدّ ضعيفة.[47] تتعلّق الانحلاليّة بالضغط ودرجة الحرارة، حيث ترتفع مع انخفاض درجة الحرارة ومع ازدياد الضغط. فعند درجة حرارة 0 °س وعند ضغط جزئي من أكسجين الهواء مقداره 212 هكتوباسكال فإنّ كمّيّة الأكسجين المنحلّة في الماء النقي تبلغ 14.6 مغ/ل، مقابل 7.6 مغ/ل عند الدرجة 20 °س.[6][47]
يمكن للأكسجين أن يتوهّج داخل أنبوب تفريغ وذلك بلون أبيض. لتحقيق ذلك ينبغي ضبط شروط التشغيل كالتالي: الضغط داخل الأنبوب (التخلية) حوالي 5-10 ميلي بار، جهد عالي مقداره 1.8 كيلوفولط، شدّة تيّار مقدارها 18 ميلي أمبير، وتردّد مقداره 35 كيلوهرتز. تترافق ظاهرة التوهّج الطيفي للأكسجين الجزيئي مع حالات توهّج طبيعيّة مثل الشفق القطبي والتوهّج الليلي.[48] إنّ امتصاص الأشعّة فوق البنفسجيّة في طبقات الجوّ العليا يعطي الأكسجين الذرّي، والذي له دور مهم في كيمياء الغلاف الجوّي.[49]
التآصل
بالإضافة إلى الأكسجين الجزيئي O2 (ثنائي الأكسجين)، والذي يمثّل الشكل الشائع من العنصر على سطح الأرض، فإنّ للأكسجين متآصلات أخرى، أشهرها الأوزون O3، مع وجود متآصلات أقلّ شهرة مثل الأكسجين الذرّي بالإضافة ثماني الأكسجين O8.

يعدّ الأوزون من متآصلات الأكسجين المعروفة، وهو يتألّف من ارتباط ثلاث ذرّات أكسجين (ثلاثي الأكسجين)، ويكون على شكل غاز أزرق اللون له رائحة مميّزة. من خواص الأوزون أنّه نشيط كيميائيّاً وفعّال بشكل كبير، إذ يصنّف من ضمن المؤكسدات القويّة، كما يصنّف ضمن المواد المؤذية للأنسجة الرئويّة.[50] ينتج الأوزون في طبقات الجو العليا من تفاعل اتحاد O2 مع الأكسجين الذرّي O، الناتج عن انفصام الرابطة بين ذرتي الأكسجين في جزيء الأكسجين الثنائي تحت تأثير الأشعّة فوق البنفسجيّة.[12] كما ينتج الأوزون أيضاً من تفاعل ثنائي أكسيد النتروجين مع الأكسجين تحت تأثير الأشعّة فوق البنفسجيّة. يعدّ الأوزون الأساس في تشكيل طبقة الأوزون، التي تلعب دوراً مهمّاً في امتصاص الأشعّة فوق البنفسجيّة القادمة إلى الأرض، وبالتالي الوقاية من الإشعاع.[12] بالمقابل، عند وجود الأوزون بالقرب من سطح الأرض فإنّه يعدّ من ملوّثات الهواء عندما يتشكّل كناتج ثانوي من عوادم السيارات.[50]
عند تعريض الأكسجين إلى ضغوط مرتفعة تتجاوز 10 غيغا باسكال تتشكّل مادة صلبة حمراء اللون، والتي أظهر تركيبها بادئ الأمر بواسطة تقنيّة مطيافيّة الكتلة أنّها مكوّنة من الأكسجين الرباعي O4 شبه المستقر.[51][52] تبيّن لاحقاً سنة 2006 أنّه عند تعريض الأكسجين لضغوط تصل إلى 20 غيغا باسكال فإنّ المادّة الحمراء المتشكّلة تتكوّن من حلقات من ثماني الأكسجين O8.[53] يكون لهذا التجمّع من الذرّات بنية بلّوريّة حسب النظام البلّوري الثلاثي، ويحتمل أن يكون للمادة خواص مؤكسدة قويّة أكبر من الأكسجين الثنائي O2 أو الأوزون O3، لذلك فمن المقترح استخدامها من أجل وقود الصواريخ.[51][52]
اكتشف سنة 1990 أنّه عند تعريض الأكسجين الصلب إلى ضغوط تتجاوز 96 غيغا باسكال فإنّه يحصل على طور فلزّي من الأكسجين،[54] كما بيّنت التجارب لاحقاً سنة 1998 أنّ ذلك الطور يصبح ذا موصلية فائقة عند درجات حرارة منخفضة جدّاً.[55]
البنية الجزيئيّة
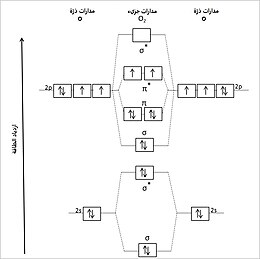
يكون الأكسجين في الشروط العاديّة على شكل غاز ثنائي الذرة، يسمّى في الأوساط العلميّة باسم ثنائي الأكسجين، وله الصيغة O2. إنّ التوزيع الإلكتروني للأكسجين يكون على الشكل He] 2s2 2p4]. ترتبط ذرتا الأكسجين كيميائيّاً في الجزيء O2 برابطة مضاعفة، تكون ناشئة عن ملء المدارات الجزيئيّة الناتجة عن تداخل المدارات الذريّة لكلّ ذرة أكسجين. يمكن تمثيل البنيّة الجزيئية للأكسجين باستخدام مخطّط المدارات الجزيئيّة، والذي توزّع فيه الإلكترونات مع تزايد الطاقة بشكل تدريجي حسب مبدأ أوفباو (البناء) وذلك من المدارات منخفضة الطاقة إلى الأعلى حتى الامتلاء. لا تسهم المدارات σ و *σ للإكترونات 2s في الرابطة بين ذرتي الأكسجين؛ بالمقابل فإنّ تداخل مدارين ذريّين (إلكترونين اثنين) من المدارات 2p يسهم في تشكيل رابطة سيغما σ تتموضع على طول محور الرابطة الجزيئيّة [O-O]. من جهة أخرى يعطي تداخل زوج من المدارات الذرّيّة 2p (أربعة إلكترونات) رابطة من باي π، والتي تكون عمودية على محور الرابطة الجزيئيّة [O-O]. بالتالي يبقى إلكترونين اثنين من المدارات 2p غير مقترنين وموجودين في المدار *π المضاد للترابط، واللّذان يسهمان في تشكيل الرابطة المضاعفة في جزيء O2،[56] كما يسهمان في مقدرة الأكسجين على تشكيل نوع كيميائي ثنائي الجذر.
تميل المدارات الجزيئيّة متساوية الطاقة والحاوية على إلكترونات غير مقترنة إلى الانفطار، وهذا ما يحصل بالنسبة للزوج الإلكتروني في المدار *π لجزيء الأكسجين، بحيث نحصل على حالة تخص اللف المغزلي تعرف باسم الحالة الثلاثيّة. لذلك فإن الحالة القاعيّة لجزيء O2 تعرف باسم الأكسجين الثلاثي.[57] تكون جزيئات الأكسجين في الحالة الثلاثيّة ذات مغناطيسية مسايرة، أي أنّها تتميّز بخاصّة مغناطيسيّة عند وجود مجال مغناطيسي،[58] وذلك بسبب العزم المغناطيسي الناتج عن الإلكترونات غير المقترنة في الجزيء.[16]
في الحالة المثارة يوجد الأكسجين في حالة تعرف باسم الأكسجين الأحادي، وتنشأ هذه الحالة من اقتران اللف المغزلي للإلكترونات.[59][60] يكون الأكسجين في هذه الحالة أشدّ نشاطاً كيميائيّاً، وهو يتشكّل في حالات عديدة في الطبيعة، مثل عمليّة التركيب الضوئي حيث يتشكّل من الماء باستخدام طاقة الشمس،[61] كما تتشكل في طبقة التروبوسفير من التفكّك الضوئي للأوزون من الأشعّة فوق البنفسجيّة،[62] بالإضافة إلى تشكّله في الجهاز المناعي كمصدر للأكسجين الفعّال.[63] تسهم الكاروتينات في النباتات في عمليّة امتصاص الطاقة المرتفعة للأكسجين الأحادي وتحويله إلى الأكسجين الثلاثي منخفض الطاقة ممّا يقلّل من أضرار إلحاق الأذى بالأنسجة.[64]
يمكن إجراء عمليّة تحضير الأكسجين الأحادي مخبريّاً بعدّة طرق إمّا بطريقة كيميائيّة ضوئيّة من الأكسجين الثلاثي، أو كيميائيّاً من مركّبّات حاوية على الأكسجين. لا يمكن الحصول على الأكسجين الأحادي بشكل مباشر من تعريض الأكسجين الثلاثي لإشعاع كهرومغناطيسي (مثل الضوء) وذلك لأسباب كموميّة تتمثّل في قواعد الاختيار بالنسبة لامتصاص الأشعّة الكهرومغناطيسيّة. لتجاوز حالة المنع هذه يمكن التعريض للإشعاع الكهرومغناطيسي بالفوتونات بشكل متزامن مع تصادم جزيئين اثنين. يحدث نتيجة هذا الفعل امتصاص في المجال الأحمر من الطيف الكهرومغناطيسي، ولذلك يظهر الأكسجين السائل بلون أزرق. يمكن إجراء العمليّة باستخدام مواد كيميائيّة مساعدة كالصباغ مثل أزرق الميثيلين أو الإيوسين، ممّا يسهّل من الحصول على الأكسجين الأحادي بأسلوب كيميائي ضوئي. يمكن الحصول على الأكسجين الأحادي كيميائيّاً من فوق الأكاسيد، فعند معالجة فوق أكسيد الهيدروجين (الماء الأكسجيني) مع تحت كلوريت الصوديوم يتشكّل حمض فوق أوكسو حمض الكلوريك وهو غير مستقرّ، ويتفكّك بسرعة مع تحرّر الأكسجين الأحادي. يمكن الحصول أيضاً على الأكسجين الأحادي مخبريّاً من تفاعل الكلور في وسط قلوي من الماء الأكسجيني.[65]
الخواص الكيميائيّة
الأكسجين نشيط كيميائياً وله تفاعليّة مرتفعة، بحيث أنّه لا يوجد في الشروط العادية على شكل عنصر حر، إنّما على شكل جزيئي. تتّسم تفاعلات الأكسجين أنّها تفاعلات أكسدة-اختزال، يقوم فيها الأكسجين باستقبال إلكترونين اثنين لتشكيل الأكسيد الموافق، بالتالي يصنّف العنصر ضمن المؤكسدات. يكون للشكل السائل من الأكسجين قوّة أكسدة أكبر من غاز الأكسجين، وهو الحال أيضاً مع الشكل الذرّي O، والذي يعدّ من المواد الأكالة، بحيث أنّه على سبيل المثال، يسبّب تآكلاً للمركبات الفضائية عند المدار الأرضي المنخفض.[66]

يتفاعل الأكسجين الذرّي بشكل مباشر مع أغلب العناصر الكيميائيّة الأخرى، مع وجود استثناءات من اللافلزّات والفلزّات النبيلة. يمكن أن يتفاعل الأكسجين مع النتروجين تحت شروط خاصة مثل البرق في طبقات الجو أو داخل محرك الاحتراق الداخلي.[67] أمّا الفلور فيتفاعل مع الأكسجين فقط عند درجات حرارة منخفضة وتحت تفريغ كهربائي. بالمقابل فإنّ غاز الأكسجين يتفاعل ببطء شديد عند الشروط العاديّة من الضغط ودرجة الحرارة؛ يعود السبب في ذلك إلى أنّ التفاعل يحتاج إلى طاقة تنشيط مرتفعة والتي يمكن تجاوزها برفع درجة الحرارة أو باستخدام الأشعّة فوق البنفسجيّة أو باستخدام حفّاز ملائم. يلزم لبعض التفاعلات وجود آثار من جذر كيميائي حرّ، كما هو الحال في مخلوط هيدروجين وأكسجين الانفجاري، حيث تسهم في دور تحفيز التفاعل التسلسلي. من جهة أخرى، تشكّل الكثير من الفلزّات، مثل الألومنيوم والتيتانيوم، أثناء تفاعلها مع الأكسجين طبقة من الأكسيد على سطحها تقوم بدور مخمّل يمنع استمرار التفاعل، ممّا يحميها من التآكل.
يمكن للأكسجين أن يتصرّف كيميائيّاً على هيئة ربيطة مع الفلزّات الانتقاليّة مشكّلاً معقّدات تناسقيّة ثنائيّة الأكسجين. يتضمّن هذا الصنف من المركّبات كلّ من بروتينات الهيم مثل الهيموغلوبين والميوغلوبين.[68]
التحليل الكيميائي
- التقليدي
يؤكسد الأكسجين المنحل أيونات المنغنيز الثنائي في المحاليل إلى المنغنيز بحالات أكسدة أعلى. يعدّ هذا التفاعل الكيميائي أساس اختبار فينكلر لتحديد كمّيّة الأكسجين المنحلّ، والذي يعتمد على إضافة فائض من اليود، والذي يقوم عند تحميض الوسط باختزال المنغنيز مرّة أخرى إلى المنغنيز الثنائي، ويتحرّر بذلك اليود الثنائي، والذي تحدّد كمّيّته باستخدام المعايرة اليوديّة باستخدام أيون ثيوكبريتات (ثيوسلفات)، ممّا يعطي بالتالي مؤشّراً على كمّيّة الأكسجين المنحلّة.[69]
- الآلي
تستخدم حسّاسات الأكسجين (حسّاس لامدا) من أجل تحديد كمّيّة غاز الأكسجين في الوسط المحيط داخل محرّكّات البنزين مثلاً وذلك لأعراض بيئيّة. لتحقيق ذلك يمرّر المزيج الغازي الصادر عن عادم السيارات عبر الحسّاس، والذي يكون على شكل أنبوب يحوي الإتريوم المطعّم بالزركونيا والمغلّف بالبلاتين على هيئة قطب إلكتروني. تؤدّي الضغوط الجزئيّة المختلفة للأكسجين إلى حدوث فرق كمون مختلف على الأقطاب الكهربائيّة، ممّا يمكّن من قياس نسبة الأكسجين بنسب تصل إلى بضعة أجزاء في المليون وذلك في مجالات مختلفة من درجات الحرارة تتراوح بين 300 °س إلى 1500 °س.[70][71][72]
يعتمد قطب كلارك على استخدام طرق أمبيريّة لتحديد تركيز الأكسجين المنحلّ.[73] يتكون القطب (المسرى) من مجموعة من أقطاب من البلاتين ومن الفضّة/كلوريد الفضّة Ag/AgCl الموجودة في وسط من كهرل مفصول بغشاء من التفلون عن العيّنة. يستطيع الأكسجين المنحل الانتشار والنفوذ عبر الغشاء إلى المحلول الكهرلي، وعند ذلك يمكن اختزاله في مجال جهد يتراوح بين −600 إلى -800 ميلي فولت في المهبط، بحيث تتناسب كمّيّة الأكسجين المنحلّ مع شدّة التيّار.[72]
يمكن تحديد كمّيّة الأكسجين بطرق بصريّة عن طريق الاعتماد على حقيقة أنّ الأكسجين يستطيع إخماد فلوريّة الجزيئات المثارة.[74] بالتالي أصبح من الممكن تطوير حسّاسات بصريّة تعتمد على مبدأ تخامد فلوريّة جزيئات خاصّة تصطنع كيميائيّاً من معقّدات تناسقيّة مصمّمة على ذرّة مركزيّة من فلزّات انتقاليّة مثل الروثينيوم (Ru(II والإريديوم (Ir(II والبلاتين (Pt(II والبالاديوم (Pd(II، أما الربيطات فتكون من مشتقّات البيبيريدين والفينانثرولين والبورفيرين.[75] تغلّف تلك الحسّاسات ضمن شبكة بوليمرية، ويكفي لإثارة الحسّاس وجود مصدر ضوئي من ليزر أشباه الموصلات. تصل الدرجة الحدّيّة لقياس تركيز الأكسجين إلى 5 جزء في البليون حجماً.[76]
المركّبات الكيميائيّة
يشكّل الأكسجين مركّبات كيميائيّة مع كافّة العناصر الكيميائيّة تقريباً ما عدا الغازات النبيلة التالية: الهيليوم والنيون والآرغون. للأكسجين كهرسلبيّة مرتفعة، لذلك فإنّ حالة الأكسدة -2 هي السائدة في أغلب مركّباته على شكل أكاسيد. لا يكون للأكسجين حالة أكسدة موجبة إلّا في المركّبات التي يرتبط فيها الأكسجين مع عنصر أكثر كهرسلبيّة منه، مثل الفلور، والذي يشكّل معه مركّب ثنائي فلوريد ثنائي الأكسجين O2F2 (حالة الأكسدة +1)، ومركّب ثنائي فلوريد الأكسجين OF2 (حالة الأكسدة +2). بما أنّ استقطاب الشحنة السالبة في المركّبات المذكورة يكون عند ذرّة الفلور، بالتالي فإنّ تلك المركّبات تصنّف ضمن الفلوريدات وليس ضمن الأكاسيد.
بالإضافة إلى مركّبات الأكاسيد، يوجد الأكسجين أيضاً في مركّبات أيونيّة على شكل فوق أكسيد 2−O2 (حالة أكسدة −1) و أكسيد فائق −O2 (حالة أكسدة −1/2) وأوزونيد −O3 (حالة أكسدة −1/3)، بالإضافة إلى كاتيون ثنائي أكسجينيل +O2.
تتعلّق نوعيّة الرابطة الكيميائيّة للأكسجين في مركّباته مع العنصر الشريك فيها، فهي إمّا أن تكون رابطة تساهميّة أو رابطة أيونيّة.
الأكاسيد
يشكّل الأكسجين مركّبات الأكاسيد مع معظم العناصر الكيميائيّة تقريباً، وذلك بسبب الكهرسلبيّة المرتفعة للعنصر. يعدّ الماء H2O أشهر مركّبات الأكسجين الكيميائيّة، وهو من الناحية الكيميائيّة أكسيد للهيدروجين. يرتبط الهيدروجين مع الأكسجين برابطة تساهميّة في جزيء الماء، ولكنّ الشحنة الكهربائيّة السالبة الموجودة على ذرّة الأكسجين من الزوج الإلكتروني الحرّ تؤدّي إلى تشكيل روابط هيدروجينيّة مع جزيئات ماء مجاورة،[77] ممّا يؤدّي إلى ترابط الذرّات واقترابها من بعضها البعض بنسبة تصل إلى 15% من أيّ سائل عادي تترابط ذرّاته بمجرد قوى فان دير فالس.[78]
تعدّ أكاسيد اللافلزّات من المركّبات واسعة الانتشار في الطبيعة ذات صفة تساهميّة، مثل أكاسيد الكربون (أحادي وثنائي أكسيد الكربون)، بالإضافة إلى أكاسيد النتروجين وأكسيد الكبريت (توضيح)أكسيد الكبريت.

يكون نوع الرابطة الكيميائيّة بين الأكسجين والفلزّات المختلفة في الأكاسيد ذات صفة أيونيّة على الغالب. يتفاعل الأكسجين مع الفلزّات القلويّة والقلويّة الترابيّة ليعطي أكاسيد ذات صفات قاعديّة، مثل أكسيد الصوديوم Na2O وأكسيد الكالسيوم CaO.
مع ارتفاع رقم الأكسدة يكون لبعض الأكاسيد صفة مذبذبة (أمفوتيريّة، يتفاعل المركّب مع كلّ من الأحماض والقواعد) مثل أكسيد الألومنيوم، في حين أنّ لبعض الأكاسيد صفة حمضيّة واضحة كما هو الحال مع أكسيد الكروم السداسي.
توجد الكثير من الفلزّات في الطبيعة على هيئة أكاسيد، والتي تمثّل بالتالي المصدر الطبيعي لإنتاج وتعدين تلك الفلزّات. من أمثلة هذه المعادن في القشرة الأرضيّة كلّ من ثنائي أكسيد السيليكون SiO2 (السيليكا) والموجود في صخور الغرانيت والكوارتز، وأكسيد الألومنيوم الموجود في صخور البوكسيت والكوروند، وأكسيد الحديد الثلاثي الموجود في الهيماتيت والصدأ.
هناك بعض الحالات التي لا يكون فيها الأكسجين في مركّباته حسب قياس اتحاديّة العناصر، حيث تبدي العناصر تكافؤاً مختلفاً عند اتّحادها مع الأكسجين، وتعرف تلك المركّبات باسم دون الأكاسيد، ومن أمثلتها دون أكسيد البورون ودون أكسيد الكربون.
مركّبات الرابطة O-O
يستطيع الأكسجين تشكيل مركّبات عدّة حاوية على الرابطة أكسجين-أكسجين O-O مثل مركّبات فوق الأكاسيد والأكاسيد الفائقة والأوزونيد. لفوق الأكاسيد مثل الماء الأكسجيني (فوق أكسيد الهيدروجين) بنية حاوية على الأيون 2−O2، ويكون الأكسجين برقم أكسدة مقداره -1. نتيجة الانفصام السهل للرابطة O-O تستطيع مركّبات فوق الأكاسيد تشكيل جذور كيميائيّة بشكل سهل، وهي مركّبات مؤكسدة قويّة وتستخدم كمواد قاصرة.
يكون للأكسجين حالة أكسدة مقدارها −½ في الأكاسيد الفائقة، والتي تحوي على أنيون −O2، وهي تعدّ من أنواع الأكسجين التفاعليّة. من أمثلة تلك المركّبات كلّ من فائق أكسيد الصوديوم وفائق أكسيد البوتاسيوم وفائق أكسيد الليثيوم. أمّا الأوزونيدات فهي مركّبات مشتقّة من الأوزون وتحوي في بنيتها على الأنيون −O3. يوجد هناك أملاح من مركّبات أوزونيد، بالإضافة إلى مركّبات أوزونيد عضويّة، والتي تتشكّل من تفاعل إضافة الأوزون إلى الألكينات.
الهيدروكسيدات
تمثّل مركّبات الهيدروكسيد مجموعة واسعة من مركّبات الأكسجين، والحاوية على الهيدروجين أيضاً في تركيبها. للهيدروكسيدات طبيعة أيونيّة في الغالب، وذلك لوجود أيون هيدروكسيد فيها، ومن أشهر أمثلتها هيدروكسيد الصوديوم NaOH وهيدروكسيد البوتاسيوم KOH.
الأحماض الأكسجينيّة
يحصل على الأحماض الأكسجينيّة من أكاسيد اللافلزّات وأكاسيد الفلزّات ذات أرقام الأكسدة العليا مع الماء (الأكاسيد الحمضيّة). من أمثلة تلك الأحماض كل من حمض الكبريتيك وحمض النتريك.
عادة ما تزداد قيمة ثابت تفكّك الحمض بازدياد عدد ذرّات الأكسجين فيه.
مركّبات الأكسجين العضويّة
يمثّل الأكسجين بالإضافة إلى الكربون والهيدروجين والنتروجين والكبريت أحد أهمّ العناصر في الكيمياء العضويّة، حيث يدخل في تركيب العديد من المجموعات الوظيفيّة، والتي تشكّل الوحدات البنائيّة المميّزة للمركّبات العضويّة.
يمكن للأكسجين أن يرتبط مع الكربون إمّا على هيئة رابطة أحاديّة كما هو الحال في مركّبات الإيثر، أو على هيئة رابطة مضاعفة كما هو الحال في مركّبات الكربونيل.

هناك أصناف عدّة من مركّبات الأكسجين العضويّة وهي تشمل:
- الكحولات: وهي مركّبات عضويّة تحوي على مجموعة الهيدروكسيل الوظيفيّة -HO، ويرتبط فيها الكربون مع الأكسجين برابطة أحاديّة. أبسط مركّبات الكحولات وأشهرها هي الميثانول CH3OH والإيثانول C2H5OH.
- الفينولات: وهي مركّبات عضويّة حاوية على مجموعة هيدروكسي على الأقل متّصلة بحلقة عطريّة.
- الإيثرات: وهي مركّبات عضويّة تحوي على رابطة -O- المؤلّفة من ذرّة أكسجين مرتبطة برابطة أحاديّة مع ذرتي كربون على طرفيها. أشهر مركّبات الإيثر هو ثنائي إيثيل الإيثر C2H5-O-C2H5.
- الألدهيدات: وهي مركّبات عضويّة تحوي على المجموعة الوظيفيّة R–CHO، حيث يمثّل R الباقي العضوي، أمّا CHO فتكون على شكل مجموعة كربونيل طرفيّة، يرتبط فيها الكربون الطرفي مع ذرّة هيدروجين. أشهر مركّبات الألدهيد وأبسطها هو فورمالدهيد HCOH.
- الكيتونات وهي مركّبات عضويّة حاوية على مجموعة كربونيل وظيفيّة غير طرفيّة R–CO–R، تربط بين باقيين عضويّين في المركّب. يعدّ الأسيتون من أمثلة الكيتونات الشهيرة.

- الأحماض الكربوكسيليّة وهي مركّبات عضويّة حاوية على مجموعة الكربوكسيل R–COOH الوظيفيّة. ومن أشهر أمثلة تلك الأحماض كل من حمض الفورميك HCOOH وحمض الخليك CH3COOH.
- الإسترات: وهي مركّبات عضويّة حاوية على مجموعة الإستر الوظيفيّة R–CO–O–R، وهي ناتجة عن تفاعل حمض كربوكسيلي مع كحول، ومن أمثلتها أسيتات الإيثيل.
- بلاماء الحمض (الأنهيدريدات) وهي مركّبات عضويّة ناتجة عن نزع جزيء ماء من جزيئتي حمض كربوكسيلي، حيث أنّ لها الصيغة العامّة R-CO-O-CO-R. من أمثلة هذه المركّبات بلاماء حمض الخليك.
- الأميدات: وهي مركّبات عضويّة لها الصيغة العامة R-C(O)-NR، ومن أمثلتها مركب ثنائي ميثيل فورماميد CH3)2NC(O)H) وأسيتاميد CH3CONH2.
توجد أيضاً مركّبات عضويّة أخرى للأكسجين مثل المركّبات الحلقيّة غير المتجانسة مثل الفوران ورباعي هيدرو الفوران و4،1-ديوكسان.
هناك العديد من المركّبات العضويّة الحاوية على الأكسجين في تركيبها والتي لها دور حيوي كبير مثل السكريّات والدهون والأحماض الدهنيّة والأحماض الأمينيّة والبروتينات، بالإضافة إلى مركّبات الفوسفات العضويّة والتي تدخل في تركيب الجزيئات الحاملة للطاقة مثل ثلاثي فوسفات الأدينوسين ATP وثنائي فوسفات الأدينوسين ADP.
الدور الحيوي
التشكّل في الغلاف الجوّي

لم يكن غاز الأكسجين الحر O2 موجوداً في الغلاف الجوّي للأرض عند بداية تشكّله، وذلك قبل حوالي 3.5 بليون سنة، أي قبل وجود الحياة البدائية على سطح الأرض مثل البكتيريا القديمة. ظهر الأكسجين الحرّ بكمّيّات جيّدة أثناء حقبة الطلائع القديمة قبل فترة زمنيّة تتراوح بين 2.7 إلى 2.3 بليون سنة مضت.[79] في البليون سنة الأولى كانت كمّيّات الأكسجين المنتجة من المتعضّيات الحيّة البسيطة تتّحد مع مصهور الحديد في المحيطات من أجل تشكيل حزم من خامات الحديد في طبقات الأرض. بعد انتهاء تلك المرحلة وتشبّع المحيطات، بدأ الأكسجين الحرّ بالانطلاق من تلك الخزّانات لتصل إلى نسبة 10% من القيمة الحاليّة للأكسجين قبل حوالي 1.7 بليون سنة مضت.[79][80]
منذ بداية حقبة العصر الكامبري منذ 540 مليون سنة مضت، ارتفعت مستويات غاز الأكسجين O2 في الغلاف الجوّي إلى نسب تتراوح بين 15% و 30% حجماً.[81] إلى نهاية العصر الفحمي قبل حوالي 300 مليون سنة وصلت مستويات O2 في الغلاف الجوّي إلى نسبة أعظميّة تبلغ 35% حجماً،[81] والتي لربما ساهمت في تكوين الأحجام الكبيرة من الحشرات والبرمائيات في ذلك الوقت.[82]
ساهمت التباينات في نسبة الأكسجين في الغلاف الجوّي في تحديد شكل المناخ في الحقبات والعصور الموافقة. عند تناقص نسبة الأكسجين في الجوّ تقلّ كثافة الغلاف الجوّي، ممّا يرفع من تبخّر مياه المسطّحات المائيّة، فتزداد بالتالي نسبة الهطولات، ممّا يؤدّي إلى الوصول إلى درجات حرارة أكثر دفئاً.[83] حسب المعدّل الحالي من التركيب الضوئي، فإنه يلزم حوالي 2000 سنة لإعادة توليد كافّة كمّيّة غاز الأكسجين O2 في الغلاف الجوّي الحالي.[84]
التركيب الضوئي والتنفّس الخلوي

كان شكل الحياة السائد على الأرض قبل فترة تكون الأكسجين في الغلاف الجوّي هو الكائنات اللاهوائيّة، والتي يمكن أن تكون قد انقرضت كمّيّات كبيرة منها عندما أصبحت نسبة الأكسجين في الغلاف الجوّي مرتفعة. على سبيل المثال، إنّ الأكسجين سامّ بالنسبة للبكتيريا اللاهوائيّة الإجباريّة، والتي كانت هي الشكل السائد على الأرض إلى أن بدأ الأكسجين في التجمّع في الغلاف الجوّي للأرض قبل حوالي 2.5 بليون سنة خلال عمليّة الأكسجة العظيمة، أي بعد حوالي بليون سنة من ظهور تلك المتعضيّات.[85][86] يتيح التنفّس الخلوي باستخدام الأكسجين O2 إنتاج كمّيّات أكبر من الجزيئات الحاملة للطاقة مثل ATP بالمقارنة مع التنفّس اللاهوائي.[87] يحدث التنفّس الخلوي للأكسجين في جميع حقيقيّات النوى بما فيها المتعضيّات المعقّدة من نباتات وحيوانات وصولاً للإنسان.
ينتج الأكسجين الحر في الطبيعة على شكله الجزيئي O2 من عمليّة التركيب الضوئي والتي تتضمّن عمليّة تفكّك ضوئي لجزيئات الماء. تشير بعض التقديرات إلى أنّ حوالي 70% من الأكسجين الحرّ الموجود في الأرض ينتج من الأشنيّات الخضراء والزراقم الموجودة في البيئة البحريّة، في حين أنّ الباقي هو من النباتات الموجودة على اليابسة،[88] في حين أنّ تقديرات أخرى تشير إلى أنّ المحيطات تساهم بحوالي 45% من الأكسجين الجوّي سنويّاً.[89]
يمكن تمثيل عمليّة التركيب الضوئي بالصيغة العامّة التاليّة:[90]
تحدث عملية التركيب الضوئي في البلاستيدات الخضراء في النباتات، وتتطلّب لحدوثها طاقة أربع فوتونات، وتتمّ العمليّة في عدّة خطوات، والتي تكون نتيجتها تشكيل بروتون عبر الأغشية الخلويّة لاصطناع ثلاثي فوسفات الأدينوسين (ATP) عن طريق الفسفرة الضوئيّة.[91] يتحرر جزيء O2 المتبقي بعد أكسدة جزيء الماء وينطلق إلى الهواء المحيط.
إنّ الأكسجين الجزيئي O2 ضروري من أجل التنفّس الخلوي في كافّة الكائنات الهوائيّة. يستخدم الأكسجين داخل الجسم الحيّ في المتقّدرات الخلويّة لإنتاج جزيئات ATP خلال الفسفرة التأكسديّة بعمليّة معاكسة للتركيب الضوئي، حيث يستخدم الأكسجين في تفاعل حرق السكر لإنتاج الطاقة. إنّ تفاعل إدخال الأكسجين في تركيب منتجات الاستقلاب يتمّ عادّة بوساطة إنزيميّة من إنزيمات أكسجيناز وذلك أثناء تقويض الغذاء داخل جسم الإنسان.
ينتشر الأكسجين في الفقاريّات عبر الأغشية في الرئتين إلى خلايا الدمّ الحمراء. يرتبط الأكسجين مع الهيموغلوبين (خضاب الدم) مغيّراً لونه من الأحمر المزرقّ إلى الأحمر القانئ، [50] وفي نفس الوقت يتحرّر CO2 من كريّات الدمّ نتيجة تأثير بور. أمّا اللافقاريّات فمنها من يستخدم الهيموسيانين لعمليّة نقل الأكسجين مثل الرخويّات وبعض مفصليّات الأرجل، والبعض الآخر يستخدم هيميرثرين مثل العناكب.[27] يستطيع ليتر من الدمّ في جسم الإنسان أن يحلّ 200 سم3 من الأكسجين الجزيئي O2.[27] يتركّز الأكسجين في الجهاز التنفسي، حيث يمكن التعبير عن تركيزه في الدمّ باستخدام الضغط الجزئي.[92]
| الوحدة | ضغط الغاز في الحويصلات الرئويّة | أكسجين الدمّ الشرياني | أكسجين الدمّ الوريدي |
|---|---|---|---|
| كيلو باسكال kPa | 14.2 | 11[93]-13[93] | 4.0[93]-5.3[93] |
| ميليمتر زئبقي mmHg | 107 | 75[94]-100[94] | 30[95]-40[95] |
الحياة المائيّة

ينحلّ الأكسجين الجزيئي O2 في مياه المحيطات، وتزداد تلك الانحلاليّة بانخفاض درجة الحرارة، ولهذه الخاصيّة أهمّيّة حيويّة على الحياة الحيوانيّة في المحيطات، وخاصّة بالقرب من المناطق القطبيّة، والتي تقدّم دعماً للكثير من الكائنات الحيّة التي يتكاثر نموّها كنتيجة لارتفاع محتوى الأكسجين.[96]
إن الماء الملوّث بالمغذّيات النباتيّة مثل النترات أو الفوسفات يمكن أن يعزّز من نموّ الطحالب في عمليّة تدعى باسم التتريف، والتي تكون نتائجها سلبيّة، إذ أن تحلّل هذه المتعضيّات والمواد الحيويّة الأخرى يمكن أن يخفّض من كمّيّة الأكسجين المنحلّ في الأجسام المائية الحادثة فيها تلك الظاهرة. يمكن التحقّق من جودة المياه وفق هذا المنظور ياستخدام تحليل طلب الأكسجين الكيميائي الحيوي، أو من كمّيّة الأكسجين الجزيئي اللازمة لإعادته إلى التراكيز الطبيعيّة.[97]
الاستخدامات
التطبيقات الطبّيّة

بما أنّ الأكسجين هو أساس عملية التنفّس الخلوي عند الإنسان، لذلك فإنّ استخدام الأكسجين في التطبيقات الطبّيّة أمر بالغ الأهميّة. يعدّ العلاج بالأكسجين أحد الوسائل المستخدمة لعلاج عدد من الأمراض الرئويّة مثل داء الانسداد الرئوي المزمن وذات الرئة، ولبعض أمراض القلب، ولأيّ مرض يتطلّب وجود حاجة لأخذ الأكسجين الغازي من أجل تجنّب حدوث حالة نقص التأكسج.[98][99]
على هذا الأساس يزوّد المصابين بكمّيّات إضافيّة من الأكسجين في حالات الإسعاف والحالات الحرجة.[99] من جهة أخرى، وحسب توصيات منظّمة الصحّة العالميّة فإنّ استنشاق الأكسجين يعدّ أحد الوسائل الملائمة لعلاج نوبات الصداع العنقودي.[100] يمكن مراقبة كمّيّة الأكسجين في الدمّ عن طريق قياس التأكسج أو عن طريق قياس نسبة غازات الدم الشرياني.[101]
يستخدم التطبيب بالضغط العالي حجرات خاصة تدعى باسم حجرة الضغط العالي، والتي تقوم بتزويد ضغوط جزئية مرتفعة من غاز الأكسجين O2 يوضع فيها المريض المحتاج للعلاج، وأحياناً الطاقم الطبي عند اللزوم.[102] يستخدم هذا الأسلوب لعلاج حالات مرضيّة مثل التسمّم بأحادي أكسيد الكربون والغنغرينا الغازيّة (أو الموات الغازي) ومرض تخفيف الضغط.[103] في حالة التسمّم بأحادي أكسيد الكربون مثلاً، يفيد رفع تراكيز غاز الأكسجين O2 في الرئتين بإزاحة أحادي أكسيد الكربون من مجموعة الهيم في الهيموغلوبين.[104][105] أمّا في حالة الغنغرينا الغازيّة، يكون غاز الأكسجين سامّاً للبكتريا اللاهوائيّة المسبّبة للمرض، بالتالي فإنّ زيادة الضغط الجزئي للأكسجين يساعد في التخلّص منها.[106][107] من جهة أخرى، فإنّ زيادة تراكيز الأكسجين في دمّ المصابين بمرض تخفيف الضغط يعدّ جزءاً من علاج ذلك المرض، والذي يحدث للغوّاصين الذين لا يقومون بخفض تدريجي للضغط، ممّا يؤدي إلى تشكّل فقاعات من غازات خاملة من النتروجين والهيليوم داخل الدمّ، ممّا يؤثّر على انحلاليّة الأكسجين في الدمّ.[98][108][109]
يتطلّب العلاج بالأكسجين وجود تجهيزات ومصادر تزوّد بالأكسجين، وعادة ما يتمّ الأمر بشكل أسطوانات من غاز الأكسجين على هيئة خيمة أكسجين، والتي استبدلت في الوقت الحالي في المستشفيات ومراكز العلاج بأقنعة الأكسجين، والتي يمكن أن توضع على هيئة كمّامة أو قنوات أنفية موصولة بجهاز التنفّس الاصطناعي.[110] قد تتطلّب بعض الحالات إدخال الأكسجين عبر أنبوب تنفسي يدخل إلى الرغامى عبر شقّ في مقدّمة العنق.[99]
غاز التنفّس

إنّ الأهميّة الحيويّة للأكسجين تجعله من المكوّنات الهامّة لأجهزة دعم الحياة في التطبيقات التي يدخل فيها الأكسجين على شكل غاز التنفس وذلك في مجالات عدّة.
يحتاج روّاد الفضاء إلى غاز الأكسجين في رحلاتهم، ويتمّ التزويد بالأكسجين في بذلات الفضاء على شكل غاز يحيط جسمهم بالهواء المضغوط، والذي يكون فيه ضغط الأكسجين مخفّفاً بحوالي ثلث قيمة الضغط النظامي، وذلك بشكل يضمن وجود ضغط جزئي طبيعي من غاز الأكسجين O2 في مجرى الدمّ لديهم.[111][112]
يعتمد الغوّاصون وطاقم الغوّاصات على التزوّد بالأكسجين المولّد صناعياً من أجل تأمين غاز للتنفّس، والذي يكون غالباً على شكل مزيج من الأكسجين والهواء تحت الضغط النظامي. يستخدم الأكسجين النقي أو القريب من النقاوة الكاملة في الغوص من أجل تسريع عملية تخفيف الضغط في الأعماق الضحلة عند نهاية الغوص الاحترافي أو الغوص التقني، وهو آمن للاستخدام لأعماق تصل إلى 6 أمتار (العمق الأعظمي للاستخدام بالشكل النقي) وذلك من أجل حالات تخفيف الضغط أو لإسعاف المصابين من الغوّاصين في حالات الطوارئ عند تلك الأعماق.[113][114] يلزم تمديد غاز الأكسجين بغازات خاملة مثل النتروجين والهيليوم من أجل الغوص لأعماق أكبر، وذلك لتجنّب حدوث التسمّم بالأكسجين.[113]
تزوّد طائرات الرحلات باحتياطي من غاز الأكسجين O2، والذي يؤمّن تلقائيّاً في حال حدوث انخفاض في ضغط الحجرة. يؤدّي الانخفاض المفاجئ في الضغط إلى تفعيل أجهزة توليد الأكسجين فوق كل مقعد، حيث تنسدل أقنعة الأكسجين من الأعلى. عند سحب الأشرطة التي تسمح بتدفّق الأكسجين، يتحرّر مسحوق من الحديد إلى محلول من كلورات الصوديوم داخل عبوة موجودة في القناع، بحيث يسمح التفاعل الكيميائي الناشر للحرارة بتوليد الأكسجين.[97]
تطبيقات صناعية

يستخدم حوالي 55% من غاز الأكسجين O2 المنتج تجارياً من أجل صهر خام الحديد إلى فولاذ.[97] يحقن غاز الأكسجين عبر ماسورة ضغط مرتفع إلى مصهور الحديد من أجل إزالة شوائب الكبريت والفائض من الكربون، وذلك على شكل الأكاسيد الموافقة SO2 و CO2 على الترتيب. إنّ تفاعلات الأكسدة تلك ناشرة للحرارة، لذلك تزداد درجات الحرارة إلى 1700 °س.[97]
تستهلك الصناعات الكيميائيّة حوالي 25% من إنتاج الأكسجين التجاري.[97] يفاعل الإيثيلين مع غاز الأكسجين O2 لإنتاج أكسيد الإيثيلين، والذي يحوّل بدوره إلى غليكول الإيثيلين، والذي يعدّ من المواد المهمّة جدّاً كمادّة أوّليّة في صناعة اللدائن والأنسجة.[97]
أمّا 20% المتبقيّة من الأكسجين المنتح تجارياً فهي تستهلك في مجالات عدّة منها التطبيقات الطبّيّة، وكمادّة مؤكسدة في وقود الصواريخ، بالإضافة إلى استخدامه في مجال معالجة المياه.[97] يستخدم الأكسجين أيضاً في مجال اللحام بالغاز، حيث يؤدّي إحراق غاز الأسيتيلين بالأكسجين إلى إصدار لهب مرتفع درجة الحرارة، يسهم في عملية قطع التركيبات المعدنيّة عند تمرير كمّيّات كبيرة من غاز الأكسجين.[115]
متفرّقات
منذ منتصف تسعينات القرن العشرين انتشر في اليابان والولايات المتّحدة الأمريكيّة حانات تزوّد روادها بكميات إضافية من الأكسجين بغرض الاستجمام مقابل أجر معين.[116] كما درج استنشاق كميات إضافية من الأكسجين عند الرياضيين في بعض الرياضات مثل كرة القدم الأمريكيّة بهدف تعزيز الأداء. إن الأثر الفيزيولوجي لمثل هذه الأمور محل شك، حيث يعتقد في أغلب الأحيان أنّ ذلك الأمر يعود إلى تأثير البلاسيبو (الغفل).[116]
المخاطر
إن معيار الرابطة الوطنية للوقاية من الحرائق رقم 704 يقوم بتقييم غاز الأكسجين المضغوط كغير خطر على الصحة وغير قابل للإشتعال وغير متفاعل ولكن مؤكسٍد. تم إعطاء الأكسجين السائل المجمد (LOX) تصنيف خطر على الصحة تقييم 3 (وذلك لأنه يزيد خطر فرط التأكسج بتفاعله والتي مصدرها من الأبخرة الكثيفة، وأيضاً من أجل الخطر الشائع للسوائل المبردة مثل الإصابة بقضمة الصقيع)، وجميع التقييمات الأخرى هي متماثلة كنموذج الغاز المضغوط.
سمّيّة الأكسجين

يمكن أن يكون غاز الأكسجين O2 سامّاً عند ضغوط جزئيّة مرتفعة، الأمر الذي قد يؤدّي إلى حدوث اختلاجات ومشاكل صحّيّة أخرى.[113][118] تبدأ ظاهرة التسمّم بالأكسجين بالظهور عند ضغوط جزئيّة أعلى من 50 كيلوباسكال، والتي تعادل نسبة من الأكسجين مقدارها 50% في الشروط العاديّة، أي حوالي 2.5 مرة من القيمة الطبيعيّة عند مستوى سطح البحر. لذلك فإنّ نسبة الأكسجين في تطبيقات غاز التنفس بالنسبة للمستشفيات أو بذلات الفضاء عادةً ما تكون حوالي 30 كيلوباسكال.[6]
أمّا بالنسبة للغوص، فإنّ احتماليّة وقوع حالات تسمّم بالأكسجين تكون مرتفعة، إذ أنّ التنفّس المطوّل لمزيج من الهواء يحوي على ضغط جزئي من الأكسجين يتجاوز 60 كيلوباسكال يمكن أن يؤدّي إلى حدوث تليّف رئوي.[119] إنّ التعرّض إلى ضغوط جزئيّة من الأكسجين تتجاوز 160 كيلوباسكال (حوالي 1.6 جو) يمكن أن يؤدّي إلى اختلاجات مميتة. يمكن أن تحدث حالة حادّة من التسمّم بالأكسجين عند الغوّاصين في حال تنفّس مزيج من الهواء الطبيعي (نسبة الأكسجين 21% عند أعماق تصل إلى 66 م أو أكثر، ويمكن أن يحدث الأمر نفسه عند تنفّس الأكسجين النقي 100% عند عمق 6 أمتار أو أكثر.[119][120][121][122]

الانفجار ومخاطر أخرى
إنّ وجود الأكسجين بتراكيز مرتفعة قد يكون سبباً لحدوث مخاطر الانفجار.[124] يعود هذا الأمر ليس إلى الأكسجين نفسه، فهو غير قابل للاشتعال، إنّما للطبيعة المؤكسدة لهذا الغاز، بحيث أنّ وجوده بالقرب من وقود قابل للاشتعال يمكن أن يؤدّي إلى حدوث انفجارات عند وجود شرارة أو مصدر حراري.[124] ينطبق هذا الأمر نفسه على المواد المؤكسدة ذات المحتوى العالي من الأكسجين مثل فوق الأكاسيد والكلورات وفوق الكلورات (البيركلورات) والنترات وثنائي الكرومات، لأنّها قادرة على تحرير الأكسجين.
يجب توخّي الحذر والالتزام بشروط السلامة عند نقل وتخزين الأكسجين السائل، وذلك من أجل التقليل من مخاطر الانفجار.[124] بالإضافة إلى ذلك، فإنّ انسكاب الأكسجين السائل وامتصاصه من مواد عضويّة مثل الخشب أو الأسفلت يمكن أن يسبّب حدوث انفجار صاعق لتلك المواد بشكل غير متوقّع عند تعرّضها لصدمات ميكانيكيّة متتاليّة.[124] كما هو الحال مع باقي السوائل ذات التبريد العميق، فإنّ هناك مخاطر حدوث عضّة برد للجلد أو العينين.
اقرأ أيضاً
المصادر
- Cook، Gerhard A.؛ Lauer، Carol M. (1968). "Oxygen". في Clifford A. Hampel (المحرر). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. ص. 499–512. LCCN:68-29938. مؤرشف من الأصل في 2022-09-01.
- Emsley، John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ص. 297–304. ISBN:0-19-850340-7. مؤرشف من الأصل في 2022-05-31.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - Raven، Peter H.؛ Evert، Ray F.؛ Eichhorn، Susan E. (2005). Biology of Plants (ط. السابعة). New York: W.H. Freeman and Company Publishers. ص. 115–27. ISBN:0-7167-1007-2. مؤرشف من الأصل في 2022-12-10.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link)
المراجع
- ^ Q116176016، ص. 56، QID:Q116176016
- ^ Jastrow، Joseph (1936). Story of Human Error. Ayer Publishing. ص. 171. ISBN:0-8369-0568-7. مؤرشف من الأصل في 2020-04-21.
- ^ أ ب ت ث Cook، Gerhard A.؛ Lauer، Carol M. (1968). "Oxygen". في Clifford A. Hampel (المحرر). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. ص. 499. LCCN:68-29938. مؤرشف من الأصل في 2022-09-01.
- ^ أ ب Britannica contributors (1911). "John Mayow". Encyclopaedia Britannica (ط. الحادية عشر). مؤرشف من الأصل في 2020-02-17. اطلع عليه بتاريخ 2007-12-16.
{{استشهاد بكتاب}}:|مؤلف=باسم عام (مساعدة) - ^ أ ب World of Chemistry contributors (2005). "John Mayow". World of Chemistry. Thomson Gale. ISBN:0-669-32727-1. مؤرشف من الأصل في 2020-04-17. اطلع عليه بتاريخ 2007-12-16.
{{استشهاد بكتاب}}:|مؤلف=باسم عام (مساعدة) - ^ أ ب ت Emsley، John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ص. 299. ISBN:0-19-850340-7. مؤرشف من الأصل في 2022-05-31.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ Morris، Richard (2003). The last sorcerers: The path from alchemy to the periodic table. Washington, D.C.: Joseph Henry Press. ISBN:0-309-08905-0. مؤرشف من الأصل في 2021-02-25.
- ^ E. Pilgrim: Entdeckung der Elemente, Mundus Verlag, Stuttgart 1950.
- ^ أ ب ت ث ج Emsley، John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ص. 300. ISBN:0-19-850340-7. مؤرشف من الأصل في 2022-05-31.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ أ ب ت ث ج Cook، Gerhard A.؛ Lauer، Carol M. (1968). "Oxygen". في Clifford A. Hampel (المحرر). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. ص. 500. LCCN:68-29938. مؤرشف من الأصل في 2022-09-01.
- ^ Joseph Priestley: „An Account of Further Discoveries in Air. By the Rev. Joseph Priestley, LL.D. F. R. S. in Letters to Sir John Pringle, Bart. P. R. S. and the Rev. Dr. Price, F. R. S.“, in: Phil. Trans., January 1, 1775, 65, S. 384–394; دُوِي:10.1098/rstl.1775.0039
- ^ أ ب ت Parks، G. D.؛ Mellor، J. W. (1939). Mellor's Modern Inorganic Chemistry (ط. 6th). London: Longmans, Green and Co.
- ^ أ ب Daintith، John (1994). Biographical Encyclopedia of Scientists. CRC Press. ص. 707. ISBN:0-7503-0287-9.
- ^ Poland – Culture, Science and Media. Condensation of oxygen and nitrogen. Retrieved on October 4, 2008. نسخة محفوظة 4 أكتوبر 2010 على موقع واي باك مشين.
- ^ أ ب How Products are Made contributors (2002). "Oxygen". How Products are Made. The Gale Group, Inc. مؤرشف من الأصل في 2019-04-03. اطلع عليه بتاريخ 2007-12-16.
{{استشهاد بكتاب}}:|مؤلف=باسم عام (مساعدة) - ^ أ ب Emsley، John (2001). "Oxygen". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. ص. 303. ISBN:0-19-850340-7. مؤرشف من الأصل في 2022-05-31.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ Croswell، Ken (فبراير 1996). Alchemy of the Heavens. Anchor. ISBN:0-385-47214-5. مؤرشف من الأصل في 2019-09-11.
- ^ Emsley 2001, p.297
- ^ A. M. Davies (Edt.): Treatise on Geochemistry, Volume 1: Meteorites, Comets, and Planets, Elsevier, 2003, ISBN 0-08-044720-1.
- ^ "لماذا لا يوجد سوى القليل جدا من الأكسجين في الفضاء ؟". arabic.rt.com/. 12.05.2015. مؤرشف من الأصل في 19 نوفمبر 2018. اطلع عليه بتاريخ 06.08.2015.
{{استشهاد بخبر}}: تحقق من التاريخ في:|تاريخ الوصول=و|تاريخ=(مساعدة) - ^ أ ب ت Meyer، B.S. (19–21 سبتمبر 2005). "Nucleosynthesis and Galactic Chemical Evolution of the Isotopes of Oxygen" (PDF). Workgroup on Oxygen in the Earliest Solar System. http://www.lpi.usra.edu/meetings/ess2005/. Proceedings of the NASA Cosmochemistry Program and the Lunar and Planetary Institute. Gatlinburg, Tennessee. 9022. مؤرشف من الأصل (PDF) في 2020-04-17.
{{استشهاد بمنشورات مؤتمر}}:|مسار المؤتمر=بحاجة لعنوان (مساعدة) - ^ Kippenhahn, Weigert: Stellar Structure and Evolution, 1. Auflage, Springer, Berlin 1991, ISBN 3-540-58013-1.
- ^ Claude Allègre, Gérard Manhès, Éric Lewin: Chemical composition of the Earth and the volatility control on planetary genetics. In: Earth and Planetary Science Letters, 2001, 185 (1–2), S. 49–69; دُوِي:10.1016/S0012-821X(00)00359-9.
- ^ أ ب "Oxygen". Los Alamos National Laboratory. مؤرشف من الأصل في 2007-10-26. اطلع عليه بتاريخ 2007-12-16.
- ^ أ ب dtv-Atlas Chemie, Band 1, dtv-Verlag (2000).
- ^ أ ب ت ث ج ح خ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. de Gruyter, Berlin 2007, (ردمك 978-3-11-017770-1), S. 497–540
- ^ أ ب ت Emsley 2001, p.298
- ^ أ ب ت ث ج Scripps Institute. "Atmospheric Oxygen Research". مؤرشف من الأصل في 2019-03-15. اطلع عليه بتاريخ 2015-07-26.
- ^ أ ب "Funktionsprinzip einer Sauerstoff-Produktionsanlage". مؤرشف من الأصل في 2016-06-20. اطلع عليه بتاريخ 2015-07-25.
- ^ أ ب ت N.N. Greenwood, A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9, S. 775–839.
- ^ "Prinzip der Gastrennung durch Adsorption (air liquide)". مؤرشف من الأصل في 2016-04-19. اطلع عليه بتاريخ 2015-07-25.
- ^ "Non-Cryogenic Air Separation Processes". UIG Inc. 2003. مؤرشف من الأصل في 2018-10-03. اطلع عليه بتاريخ 2007-12-16.
- ^ أ ب The Nubase evaluation of nuclear and decay properties(engl.; PDF; 1,0 MB) نسخة محفوظة 12 أغسطس 2013 على موقع واي باك مشين.
- ^ "NUDAT 13O". مؤرشف من الأصل في 2018-10-04. اطلع عليه بتاريخ 2009-07-06.
- ^ "NUDAT 14O". مؤرشف من الأصل في 2018-10-04. اطلع عليه بتاريخ 2009-07-06.
- ^ "NUDAT 15O". مؤرشف من الأصل في 2018-10-04. اطلع عليه بتاريخ 2009-07-06.
- ^ NMR-Eigenschaften von Sauerstoff bei www.webelements.com [وصلة مكسورة] نسخة محفوظة 28 يوليو 2014 على موقع واي باك مشين.
- ^ Agostini، D.؛ Iida، H.؛ Takahashi، A. (1995). "Positron emission tomography with oxygen-15 of stunned myocardium caused by coronary artery vasospasm after recovery". British Heart Journal. ج. 73 ع. 1: 69–72. DOI:10.1136/hrt.73.1.69. PMC:483759. PMID:7888266.
- ^ أ ب Emsley 2001, p.304
- ^ Lisiecki، L. E.؛ Raymo، M. E. (يناير 2005). "A Pliocene-Pleistocene stack of 57 globally distributed benthic δ18O records" (PDF). Paleoceanography. ج. 20: PA1003. Bibcode:2005PalOc..20.1003L. DOI:10.1029/2004PA001071. مؤرشف من الأصل (PDF) في 2019-09-27.
Lisiecki، L. E.؛ Raymo، M. E. (مايو 2005). "Correction to "A Pliocene-Pleistocene stack of 57 globally distributed benthic δ18O records"". Paleoceanography. ج. 20 ع. 2: PA2007. Bibcode:2005PalOc..20.2007L. DOI:10.1029/2005PA001164.
data: دُوِي:10.1594/PANGAEA.704257 - ^ Chieh، Chung. "Bond Lengths and Energies". University of Waterloo. مؤرشف من الأصل في 2018-10-13. اطلع عليه بتاريخ 2007-12-16.
- ^ أ ب Lide، David R. (2003). "Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, and critical temperatures of the elements". CRC Handbook of Chemistry and Physics (ط. 84th). Boca Raton, Florida: CRC Press. ISBN:0-8493-0595-0.
- ^ "Overview of Cryogenic Air Separation and Liquefier Systems". Universal Industrial Gases, Inc. مؤرشف من الأصل في 2018-10-21. اطلع عليه بتاريخ 2007-12-15.
- ^ M.J. Kirschner: Oxygen in Ullmann's Encyclopedia of Industrial Chemistry, 2012 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, دُوِي:10.1002/14356007.a18_329.
- ^ National Physical Laboratory, Kaye and Laby Tables of Physical and Chemical Constants, 16. Auflage, 1995; D. Ambrose, M.B. Ewing, M.L. McGlashan, Critical constants and second virial coefficients of gases. نسخة محفوظة 24 أغسطس 2017 على موقع واي باك مشين.
- ^ J. A. Dean: Lange's Handbook of Chemistry, 15. Edition, McGraw-Hill, 1999; Section 6; Table 6.5 Critical Properties.
- ^ أ ب "Air solubility in water". The Engineering Toolbox. مؤرشف من الأصل في 2019-04-04. اطلع عليه بتاريخ 2007-12-21.
- ^ Krupenie، Paul H. (1972). "The Spectrum of Molecular Oxygen". Journal of Physical and Chemical Reference Data. ج. 1 ع. 2: 423. DOI:10.1063/1.3253101. ISSN:0047-2689.
- ^ Guy P. Brasseur؛ Susan Solomon (15 يناير 2006). Aeronomy of the Middle Atmosphere: Chemistry and Physics of the Stratosphere and Mesosphere. Springer Science & Business Media. ص. 220–. ISBN:978-1-4020-3824-2. مؤرشف من الأصل في 2020-04-21.
- ^ أ ب ت Stwertka، Albert (1998). Guide to the Elements (ط. Revised). Oxford University Press. ص. 48–49. ISBN:0-19-508083-1. مؤرشف من الأصل في 2022-07-16.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ أ ب Cacace، Fulvio؛ de Petris، Giulia؛ Troiani، Anna (2001). "Experimental Detection of Tetraoxygen". Angewandte Chemie International Edition. ج. 40 ع. 21: 4062–65. DOI:10.1002/1521-3773(20011105)40:21<4062::AID-ANIE4062>3.0.CO;2-X. PMID:12404493.
- ^ أ ب Ball، Phillip (16 سبتمبر 2001). "New form of oxygen found". Nature News. مؤرشف من الأصل في 2013-10-21. اطلع عليه بتاريخ 2008-01-09.
- ^ Lundegaard، Lars F.؛ Weck، Gunnar؛ McMahon، Malcolm I.؛ Desgreniers، Serge؛ وآخرون (2006). "Observation of an O8 molecular lattice in the phase of solid oxygen". Nature. ج. 443 ع. 7108: 201–04. Bibcode:2006Natur.443..201L. DOI:10.1038/nature05174. PMID:16971946. مؤرشف من الأصل في 2017-06-27.
- ^ Desgreniers، S؛ Vohra، Y. K.؛ Ruoff، A. L. (1990). "Optical response of very high density solid oxygen to 132 GPa". J. Phys. Chem. ج. 94 ع. 3: 1117–22. DOI:10.1021/j100366a020.
- ^ Shimizu، K.؛ Suhara، K.؛ Ikumo، M.؛ Eremets، M. I.؛ وآخرون (1998). "Superconductivity in oxygen". Nature. ج. 393 ع. 6687: 767–69. Bibcode:1998Natur.393..767S. DOI:10.1038/31656.
- ^ أ ب Jack Barrett, 2002, "Atomic Structure and Periodicity, (Basic concepts in chemistry, Vol. 9 of Tutorial chemistry texts), Cambridge, U.K.:Royal Society of Chemistry, p. 153, ISBN 0-85404-657-7, see [1] accessed January 31, 2015. نسخة محفوظة 2020-05-30 على موقع واي باك مشين.
- ^ Jakubowski، Henry. "Chapter 8: Oxidation-Phosphorylation, the Chemistry of Di-Oxygen". Biochemistry Online]. Saint John's University. مؤرشف من الأصل في 2018-10-05. اطلع عليه بتاريخ 2008-01-28.
- ^ "Demonstration of a bridge of liquid oxygen supported against its own weight between the poles of a powerful magnet". University of Wisconsin-Madison Chemistry Department Demonstration lab. مؤرشف من الأصل في 2007-12-17. اطلع عليه بتاريخ 2007-12-15.
- ^ Keisuke Hasegawa: Direct measurements of absolute concentration and lifetime of singlet oxygen in the gas phase by electron paramagnetic resonance. In: Chemical Physics Letters, 2008, 457 (4–6), S. 312–314; دُوِي:10.1016/j.cplett.2008.04.031.
- ^ N.V. Shinkarenko, V.B. Aleskovskiji: „Singlet Oxygen: Methods of Preparation and Detection“, in: Russian Chemical Reviews, 1981, 50, S. 320–231; دُوِي:10.1070/RC1981v050n03ABEH002587.
- ^ Krieger-Liszkay، Anja (13 أكتوبر 2004). "Singlet oxygen production in photosynthesis". Journal of Experimental Botanics. Oxford Journals. ج. 56 ع. 411: 337–46. DOI:10.1093/jxb/erh237. PMID:15310815.
- ^ Harrison، Roy M. (1990). Pollution: Causes, Effects & Control (ط. 2nd). Cambridge: Royal Society of Chemistry. ISBN:0-85186-283-7. مؤرشف من الأصل في 2022-06-12.
- ^ Wentworth، Paul؛ McDunn، JE؛ Wentworth، AD؛ Takeuchi، C؛ Nieva، J؛ Jones، T؛ Bautista، C؛ Ruedi، JM؛ وآخرون (13 ديسمبر 2002). "Evidence for Antibody-Catalyzed Ozone Formation in Bacterial Killing and Inflammation". Science. ج. 298 ع. 5601: 2195–219. Bibcode:2002Sci...298.2195W. DOI:10.1126/science.1077642. PMID:12434011. مؤرشف من الأصل في 2022-02-18.
- ^ Hirayama، Osamu؛ Nakamura، Kyoko؛ Hamada، Syoko؛ Kobayasi، Yoko (1994). "Singlet oxygen quenching ability of naturally occurring carotenoids". Lipids. Springer. ج. 29 ع. 2: 149–50. DOI:10.1007/BF02537155. PMID:8152349.
- ^ Lechtken، Peter (1974)، Singulett-Sauerstoff - Chemie in unserer Zeit، ص. 11–16
- ^ "Atomic oxygen erosion". مؤرشف من الأصل في 2007-06-13. اطلع عليه بتاريخ 2009-08-08.
- ^ Juergen Carstens: Berechnung der NOx-Rohemission eines Verbrennungsmotor im Schichtladebetrieb, The IP.com Journal, 2003.(بالألمانية) نسخة محفوظة 08 أغسطس 2014 على موقع واي باك مشين.
- ^ Crabtree، R. (2001). The Organometallic Chemistry of the Transition Metals (ط. 3rd). John Wiley & Sons. ص. 152. ISBN:978-0-471-18423-2.
- ^ L.G. Anderson, C. Haraldsson, R. Lindgren: „Gran linearization of potentiometric Winkler titration“, in: Marine Chemistry, 1992, 37 (3–4), S. 179–190; دُوِي:10.1016/0304-4203(92)90077-N.
- ^ J. Riegel, H. Neumann, H.-M. Wiedenmann: „Exhaust gas sensors for automotive emission control“, in: Solid State Ionics, 2002 152/153, S. 783–800; دُوِي:10.1016/S0167-2738(02)00329-6.
- ^ G. Eranna, B. C. Joshi, D. P. Runthala, R. P. Gupta: „Oxide Materials for Development of Integrated Gas Sensors – A Comprehensive Review“, in: Crit. Rev. Solid State Mat. Sci., 2004, 29, S. 111–188; دُوِي:10.1080/10408430490888977.
- ^ أ ب E. Gnaiger, H. Forstner: Polarographic Oxygen Sensors, Springer-Verlag, Berlin, Heidelberg, New York 1983.
- ^ J. R. Stetter, J. Li: „Amperometric Gas Sensors – A Review“. In: Chemical Reviews, 2008, 108 (2), S. 352–366; دُوِي:10.1021/cr0681039.
- ^ C. McDonagh, C. S. Burke, B. D. MacCraith: „Optical Chemical Sensors“. In: Chemical Reviews, 2008, 108 (2), S. 400–422; دُوِي:10.1021/cr068102g.
- ^ Y. Amao: „Probes and Polymers for Optical Sensing of Oxygen“, in: Microchimica Acta, 2003 143, S. 1–12; دُوِي:10.1007/s00604-003-0037-x.
- ^ P. Lehner, C. Staudinger, S. M. Borisov, I. Klimant: „Ultra-sensitive optical oxygen sensors for characterization of nearly anoxic systems“, in: Nature Communications, 2014 5, 4460; دُوِي:10.1038/ncomms5460.
- ^ Maksyutenko، P.؛ Rizzo، T. R.؛ Boyarkin، O. V. (2006). "A direct measurement of the dissociation energy of water". J. Chem. Phys. ج. 125 ع. 18: 181101. Bibcode:2006JChPh.125r1101M. DOI:10.1063/1.2387163. PMID:17115729.
- ^ Chaplin، Martin (4 يناير 2008). "Water Hydrogen Bonding". مؤرشف من الأصل في 2019-04-15. اطلع عليه بتاريخ 2008-01-06.
- ^ أ ب Crowe، S. A.؛ Døssing، L. N.؛ Beukes، N. J.؛ Bau، M.؛ Kruger، S. J.؛ Frei، R.؛ Canfield، D. E. (2013). "Atmospheric oxygenation three billion years ago". Nature. ج. 501 ع. 7468: 535–538. DOI:10.1038/nature12426. PMID:24067713.
- ^ Campbell، Neil A.؛ Reece، Jane B. (2005). Biology (ط. 7th). San Francisco: Pearson – Benjamin Cummings. ص. 522–23. ISBN:0-8053-7171-0.
- ^ أ ب Berner، Robert A. (1999). "Atmospheric oxygen over Phanerozoic time". Proceedings of the National Academy of Sciences of the USA. ج. 96 ع. 20: 10955–57. Bibcode:1999PNAS...9610955B. DOI:10.1073/pnas.96.20.10955. PMC:34224. PMID:10500106. مؤرشف من الأصل في 2008-03-07.
- ^ Butterfield، N. J. (2009). "Oxygen, animals and oceanic ventilation: An alternative view". Geobiology. ج. 7 ع. 1: 1–7. DOI:10.1111/j.1472-4669.2009.00188.x. PMID:19200141.
- ^ Christopher J. Poulsen, Clay Tabor, Joseph D. White. "Long-term climate forcing by atmospheric oxygen concentrations". AAAS. DOI:10.1126/science.1260670. مؤرشف من الأصل في 2018-04-21.
- ^ Dole، Malcolm (1965). "The Natural History of Oxygen" (PDF). The Journal of General Physiology. ج. 49 ع. 1: 5–27. DOI:10.1085/jgp.49.1.5. PMC:2195461. PMID:5859927. مؤرشف من الأصل (PDF) في 2008-10-01. اطلع عليه بتاريخ 2007-12-16.
- ^ "NASA Research Indicates Oxygen on Earth 2.5 Billion Years ago" (Press release). ناسا. 27 سبتمبر 2007. مؤرشف من الأصل في 2020-04-17. اطلع عليه بتاريخ 2008-03-13.
- ^ Zimmer، Carl (3 أكتوبر 2013). "Earth's Oxygen: A Mystery Easy to Take for Granted". New York Times. مؤرشف من الأصل في 2019-05-08. اطلع عليه بتاريخ 2013-10-03.
- ^ Freeman، Scott (2005). Biological Science, 2nd. Upper Saddle River, NJ: Pearson – Prentice Hall. ص. 214, 586. ISBN:0-13-140941-7.
- ^ Fenical، William (سبتمبر 1983). "Marine Plants: A Unique and Unexplored Resource". Plants: the potentials for extracting protein, medicines, and other useful chemicals (workshop proceedings). DIANE Publishing. ص. 147. ISBN:1-4289-2397-7. مؤرشف من الأصل في 2020-04-21.
- ^ Walker، J. C. G. (1980). The oxygen cycle in the natural environment and the biogeochemical cycles. Berlin: Springer-Verlag. مؤرشف من الأصل في 2022-02-18.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ Brown، Theodore L.؛ LeMay، Burslen (2003). Chemistry: The Central Science. Prentice Hall/Pearson Education. ص. 958. ISBN:0-13-048450-4. مؤرشف من الأصل في 2022-03-10.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ Raven 2005, 115–27
- ^ Charles Henrickson (2005). Chemistry. Cliffs Notes. ISBN:0-7645-7419-1.
- ^ أ ب ت ث مشتقّة من قيم mmHg باستخدام معامل التحويل 0.133322 kPa/mmHg
- ^ أ ب Chapter 5 of Dr. Martin's book All You Really Need to Know to Interpret Arterial Blood Gases, 2nd edition, published February 1999 by Lippincott Williams & Wilkins.. نسخة محفوظة 3 فبراير 2016 على موقع واي باك مشين.
- ^ أ ب The Medical Education Division of the Brookside Associates--> ABG (Arterial Blood Gas)Retrieved on December 6, 2009 نسخة محفوظة 12 أغسطس 2017 على موقع واي باك مشين.
- ^ From The Chemistry and Fertility of Sea Waters by H.W. Harvey, 1955, citing C.J.J. Fox, "On the coefficients of absorption of atmospheric gases in sea water", Publ. Circ. Cons. Explor. Mer, no. 41, 1907. Harvey notes that according to later articles in Nature, the values appear to be about 3% too high.
- ^ أ ب ت ث ج ح خ Emsley 2001, p.301
- ^ أ ب Cook & Lauer 1968, p.510
- ^ أ ب ت "المعالجةُ بالأكسجين". موسوعة الملك عبد الله بن عبد العزيز العربية للمحتوى الصحي. 17.02.2014. مؤرشف من الأصل في 4 مايو 2015. اطلع عليه بتاريخ 6 أغسطس 2015.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "WHO - Lifting The Burden: Aids for management of common headache disorders in primary care" (PDF). مؤرشف (PDF) من الأصل في 2016-09-10. اطلع عليه بتاريخ 2015-08-04.
- ^ F. J. Andrews, J. P. Nolan: „Critical care in the emergency department: monitoring the critically ill patient“, in: Emerg Med J, 2006, 23, S. 561–564; ببمد: 16794104.
- ^ Stephenson RN؛ Mackenzie I؛ Watt SJ؛ Ross JA (1996). "Measurement of oxygen concentration in delivery systems used for hyperbaric oxygen therapy". Undersea Hyperb Med. ج. 23 ع. 3: 185–8. PMID:8931286. مؤرشف من الأصل في 2011-08-11. اطلع عليه بتاريخ 2008-09-22.
- ^ Undersea and Hyperbaric Medical Society. "Indications for hyperbaric oxygen therapy". مؤرشف من الأصل في 2011-05-25. اطلع عليه بتاريخ 2008-09-22.
- ^ Undersea and Hyperbaric Medical Society. "Carbon Monoxide". مؤرشف من الأصل في 2008-07-25. اطلع عليه بتاريخ 2008-09-22.
- ^ Piantadosi CA (2004). "Carbon monoxide poisoning". Undersea Hyperb Med. ج. 31 ع. 1: 167–77. PMID:15233173. مؤرشف من الأصل في 2011-02-03. اطلع عليه بتاريخ 2008-09-22.
- ^ Hart GB؛ Strauss MB (1990). "Gas Gangrene – Clostridial Myonecrosis: A Review". J. Hyperbaric Med. ج. 5 ع. 2: 125–144. مؤرشف من الأصل في 2011-02-03. اطلع عليه بتاريخ 2008-09-22.
- ^ Zamboni WA؛ Riseman JA؛ Kucan JO (1990). "Management of Fournier's Gangrene and the role of Hyperbaric Oxygen". J. Hyperbaric Med. ج. 5 ع. 3: 177–186. مؤرشف من الأصل في 2011-02-03. اطلع عليه بتاريخ 2008-09-22.
- ^ Undersea and Hyperbaric Medical Society. "Decompression Sickness or Illness and Arterial Gas Embolism". مؤرشف من الأصل في 2008-07-05. اطلع عليه بتاريخ 2008-09-22.
- ^ Acott، C. (1999). "A brief history of diving and decompression illness". South Pacific Underwater Medicine Society Journal. ج. 29 ع. 2. ISSN:0813-1988. OCLC:16986801. مؤرشف من الأصل في 2011-09-05. اطلع عليه بتاريخ 2008-09-22.
- ^ Sim MA؛ Dean P؛ Kinsella J؛ Black R؛ وآخرون (2008). "Performance of oxygen delivery devices when the breathing pattern of respiratory failure is simulated". Anaesthesia. ج. 63 ع. 9: 938–40. DOI:10.1111/j.1365-2044.2008.05536.x. PMID:18540928. مؤرشف من الأصل في 2022-03-08.
- ^ Morgenthaler GW؛ Fester DA؛ Cooley CG (1994). "As assessment of habitat pressure, oxygen fraction, and EVA suit design for space operations". Acta Astronautica. ج. 32 ع. 1: 39–49. Bibcode:1994AcAau..32...39M. DOI:10.1016/0094-5765(94)90146-5. PMID:11541018.
- ^ Webb JT؛ Olson RM؛ Krutz RW؛ Dixon G؛ Barnicott PT (1989). "Human tolerance to 100% oxygen at 9.5 psia during five daily simulated 8-hour EVA exposures". Aviat Space Environ Med. ج. 60 ع. 5: 415–21. DOI:10.4271/881071. PMID:2730484.
- ^ أ ب ت Acott، C. (1999). "Oxygen toxicity: A brief history of oxygen in diving". South Pacific Underwater Medicine Society Journal. ج. 29 ع. 3. ISSN:0813-1988. OCLC:16986801. مؤرشف من الأصل في 2010-12-25. اطلع عليه بتاريخ 2008-09-21.
- ^ Longphre، J. M.؛ Denoble، PJ؛ Moon، RE؛ Vann، RD؛ وآخرون (2007). "First aid normobaric oxygen for the treatment of recreational diving injuries". Undersea Hyperb Med. ج. 34 ع. 1: 43–49. ISSN:1066-2936. OCLC:26915585. PMID:17393938. مؤرشف من الأصل في 2011-09-05. اطلع عليه بتاريخ 2008-09-21.
- ^ Cook & Lauer 1968, p.508
- ^ أ ب Bren، Linda (نوفمبر–ديسمبر 2002). "Oxygen Bars: Is a Breath of Fresh Air Worth It?". FDA Consumer magazine. U.S. Food and Drug Administration. مؤرشف من الأصل في 2007-10-18. اطلع عليه بتاريخ 2007-12-23.
- ^ Dharmeshkumar N Patel؛ Ashish Goel؛ SB Agarwal؛ Praveenkumar Garg؛ وآخرون (2003). "Oxygen Toxicity" (PDF). Indian Academy of Clinical Medicine. ج. 4 ع. 3: 234. مؤرشف من الأصل (PDF) في 2019-04-27.
- ^ Cook & Lauer 1968, p.511
- ^ أ ب Wilmshurst P (1998). "Diving and oxygen". BMJ. ج. 317 ع. 7164: 996–9. DOI:10.1136/bmj.317.7164.996. PMC:1114047. PMID:9765173.
- ^ Donald، Kenneth (1992). Oxygen and the Diver. England: SPA in conjunction with K. Donald. ISBN:1-85421-176-5.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part I". Br Med J. ج. 1 ع. 4506: 667–72. DOI:10.1136/bmj.1.4506.667. PMC:2053251. PMID:20248086.
- ^ Donald K. W. (1947). "Oxygen Poisoning in Man: Part II". Br Med J. ج. 1 ع. 4507: 712–7. DOI:10.1136/bmj.1.4507.712. PMC:2053400. PMID:20248096.
- ^ Chiles، James R. (2001). Inviting Disaster: Lessons from the edge of Technology: An inside look at catastrophes and why they happen. New York: HarperCollins Publishers Inc. ISBN:0-06-662082-1.
- ^ أ ب ت ث Werley، Barry L.، المحرر (1991). ASTM Technical Professional training. Fire Hazards in Oxygen Systems. Philadelphia: ASTM International Subcommittee G-4.05.
وصلات خارجية
| في كومنز صور وملفات عن: أكسجين |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
