|
تضامنًا مع حق الشعب الفلسطيني |
أمونيوم
| أمونيوم | |
|---|---|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
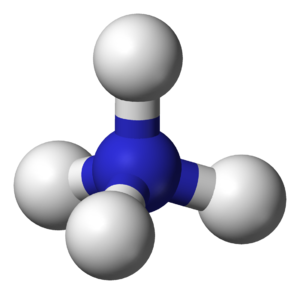
الأمونيوم[1] وهو أيون موجب (كاتيون) متعدد الذرات، صيغته الكيميائية +NH4 .[2][3][4] كتلته المولية مقدارها 18.04 غ/مول، وينتج من عملية إضافة بروتون (برتنة) للأمونيا. يتميز الأمونيوم بأنه قلوي له ثابت تشرد حمضي (pKa) مقداره 9.25 .
كيمياء الأمونيوم
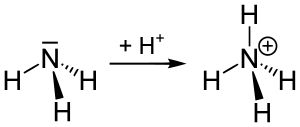
في شاردة الأمونيوم ترتبط ذرة النيتروجين المشحونة إيجاباً بأربع روابط مشتركة مع الهيدروجين. تتصرف شاردة الأمونيوم كحمض برونشتد لوري ضعيف، أي أن شاردة الأمونيوم قادرة على منح بروتون إلى قاعدة أقوى وذلك بالتخلي عن أي من ذرات الهيدروجين التي لديها، فتتحول بالتالي إلى الأمونيا. مما يعني أن شاردة الأمونيوم هي حمض مترافق مع القاعدة التي هي الأمونيا.
التوازن بين الأمونيا والأمونيوم:
تعتمد مقدرة الأمونيا في المحلول في تشكيل شاردة الأمونيوم على pH الوسط. أغلب مركبات الأمونيوم تكون في المحاليل، إلا أنه يمكن أن تتكون أيضاً في الحالة الغازية؛ فعلى سبيل المثال عندما يحصل تماس بين بخار الأمونيا مع بخار كلور الهيدروجين تنشأ سحابة بيضاء من كلوريد الأمونيوم، والتي تترسب أخيراً على شكل صلب على سطح المحلول.
الأملاح
تم العثور على كاتيون الأمونيوم في مجموعة متنوعة من الأملاح مثل كربونات الأمونيوم وكلوريد الأمونيوم ونترات الأمونيوم . معظم أملاح الأمونيوم البسيطة قابلة للذوبان في الماء. الاستثناء هو سداسي كلورو بلاتينات الأمونيوم ، الذي استخدم تكوينه في السابق كاختبار للأمونيوم. تعتبر أملاح الأمونيوم الموجودة في النترات وخاصة البيركلورات شديدة الانفجار ، وفي هذه الحالات يكون الأمونيوم هو العامل المختزل.
في عملية غير عادية ، تشكل أيونات الأمونيوم ملغمًا . يتم تحضير هذه الأنواع عن طريق التحليل الكهربائي لمحلول الأمونيوم باستخدام كاثود الزئبق. [5] يتحلل هذا الملغم في النهاية ليطلق الأمونيا والهيدروجين. [6]
لمعرفة ما إذا كان أيون الأمونيوم موجودًا في الملح ، يتم أولاً تسخين الملح بوجود هيدروكسيد قلوي يطلق غازًا له رائحة مميزة وهي بالطبع الأمونيا .
لتأكيد الأمونيا بشكل أكبر ، مرت عبر قضيب زجاجي مغموس في محلول حمض الهيدروكلوريك ( حمض الهيدروكلوريك ) مما ينتج عنه أبخرة بيضاء كثيفة من كلوريد الأمونيوم .
تتحول الأمونيا عندما تمر عبر محلول CuSO 4 ( كبريتات النحاس ) من اللون الأزرق إلى اللون الأزرق الغامق مكونًا كاشف شفايزر .
الأمونيا أو أيون الأمونيوم عند إضافته إلى كاشف نيسلر يعطي اللون البني المترسب المعروف باسم يوديد قاعدة المليون في الوسط الأساسي.
يعطي أيون الأمونيوم عند إضافته إلى حمض الكلوروبلاتينيك ترسبًا أصفر.
يعطي أيون الأمونيوم عند إضافته إلى كوبالتينيتريت الصوديوم ترسبًا أصفر.
يعطي أيون الأمونيوم عند إضافته إلى bitartrate البوتاسيوم ترسبًا أبيض
الترابط
زوج الإلكترون الوحيد على ذرة النيتروجين (N) في الأمونيا ، والممثل كخط فوق N ، يكون الرابطة مع بروتون (H +). فتكون جميع روابط N - H الأربعة متكافئة ، كونها روابط تساهمية قطبية. يحتوي الأيون على هيكل رباعي السطوح وهو متساوي إلكترونيًا مع الميثان والبوروهيدريد. كاتيون الأمونيوم يشبه كاتيون السيزيوم من حيث الحجم.
الأيونات العضوية
يمكن استبدال ذرات الهيدروجين في أيون الأمونيوم بمجموعة ألكيل أو مجموعة عضوية أخرى لتكوين أيون أمونيوم مستبدل (تسمية IUPAC : أيون أمين ). اعتمادًا على عدد المجموعات العضوية ، يُطلق على كاتيون الأمونيوم اسم أولي أو ثانوي أو ثالث أو رباعي . باستثناء كاتيونات الأمونيوم الرباعية ، فإن كاتيونات الأمونيوم العضوية هي أحماض ضعيفة.
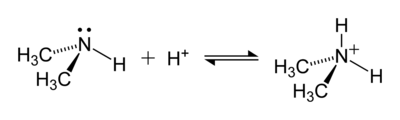
مثال على تفاعل مكون أيون أمونيوم هو ذلك بين ثنائي ميثيل أمين ، (CH 3 ) 2 NH ، وحمض لإعطاء داي ميثيل أمونيوم كاتيون ، (CH 3 ) 2 NH
2</br>
2 :
تحتوي كاتيونات الأمونيوم الرباعية على أربع مجموعات عضوية مرتبطة بذرة النيتروجين ، وهي تفتقر إلى ذرة هيدروجين مرتبطة بذرة النيتروجين. هذه الكاتيونات، مثل رباعي ن -butylammonium الموجبة، وتستخدم في بعض الأحيان ليحل محل الصوديوم أو البوتاسيوم أيونات لزيادة ذوبان أنيون يرتبط بها في المذيبات العضوية. تؤدي أملاح الأمونيوم الأولية والثانوية والثالثية نفس الوظيفة ، ولكنها أقل دهونًا. كما أنها تستخدم كمحفزات لنقل الطور وخافضات للتوتر السطحي .
فئة غير معتادة من أملاح الأمونيوم العضوية هي مشتقات من كاتيونات جذرية الأمين ، R 3 N + • مثل tris (4-bromophenyl) ammoniumyl hexachloroantimonate .
مادة الأحياء
أيونات الأمونيوم هي نفايات عملية التمثيل الغذائي للحيوانات . في الأسماك واللافقاريات المائية ، تفرز مباشرة في الماء. في الثدييات وأسماك القرش والبرمائيات ، يتم تحويلها في دورة اليوريا إلى اليوريا ، لأن اليوريا أقل سمية ويمكن تخزينها بكفاءة أكبر. في الطيور والزواحف والقواقع الأرضية ، يتم تحويل الأمونيوم الأيضي إلى حمض اليوريك ، وهو مادة صلبة ويمكن بالتالي التخلص منها بأقل قدر من فقدان الماء. [7]
الأمونيوم مصدر مهم للنيتروجين للعديد من الأنواع النباتية ، وخاصة تلك التي تنمو في التربة منخفضة الأكسجة. ومع ذلك ، فهو سام أيضًا لمعظم أنواع المحاصيل ونادرًا ما يتم استخدامه كمصدر وحيد للنيتروجين. [8]
المعدن
أيون الأمونيوم له خصائص مشابهة جدًا لكاتيونات الفلزات القلوية الثقيلة ، وغالبًا ما يعتبر مكافئًا قريبًا. [9] [10] [11] من المتوقع أن يتصرف الأمونيوم كمعدن (NH
4</br>
4 أيونات في بحر من الإلكترونات) عند ضغوط عالية جدًا ، مثل الكواكب الغازية العملاقة الموجودة بداخلها مثل أورانوس ونبتون . [10] [11]
في ظل الظروف العادية ، لا يوجد الأمونيوم كمعدن نقي ، ولكنه موجود كملغم (سبيكة مع الزئبق ). [12]
اقرأ أيضا
مراجع
- ^ Q113378673، ص. 28، QID:Q113378673
- ^ "معلومات عن أمونيوم على موقع fdasis.nlm.nih.gov". fdasis.nlm.nih.gov. مؤرشف من الأصل في 2019-07-25.
- ^ "معلومات عن أمونيوم على موقع rcsb.org". rcsb.org. مؤرشف من الأصل في 2019-12-27.
- ^ "معلومات عن أمونيوم على موقع thes.bncf.firenze.sbn.it". thes.bncf.firenze.sbn.it. مؤرشف من الأصل في 2019-07-25.
- ^ Pseudo-binary compounds نسخة محفوظة 27 يوليو 2020 على موقع واي باك مشين.
- ^
{{استشهاد بموسوعة}}: استشهاد فارغ! (مساعدة) - ^ Campbell، Neil A.؛ Jane B. Reece (2002). "44". Biology (ط. 6th). San Francisco: Pearson Education, Inc. ص. 937–938. ISBN:978-0-8053-6624-2. مؤرشف من الأصل في 2020-07-27.
- ^ Britto، DT؛ Kronzucker, HJ (2002). "NH4+ toxicity in higher plants: a critical review" (PDF). Journal of Plant Physiology. ج. 159 ع. 6: 567–584. DOI:10.1078/0176-1617-0774. مؤرشف من الأصل (PDF) في 2019-07-10.
- ^ Holleman، Arnold Frederik؛ Wiberg، Egon (2001)، Wiberg، Nils (المحرر)، Inorganic Chemistry، ترجمة: Eagleson، Mary؛ Brewer، William، San Diego/Berlin: Academic Press/De Gruyter، ISBN:0-12-352651-5
- ^ أ ب Stevenson، D. J. (20 نوفمبر 1975). "Does metallic ammonium exist?". نيتشر. ج. 258 ع. 5532: 222–223. Bibcode:1975Natur.258..222S. DOI:10.1038/258222a0.
- ^ أ ب Bernal، M. J. M.؛ Massey، H. S. W. (3 فبراير 1954). "Metallic Ammonium". Monthly Notices of the Royal Astronomical Society. ج. 114 ع. 2: 172–179. Bibcode:1954MNRAS.114..172B. DOI:10.1093/mnras/114.2.172.
- ^ Reedy، J.H. (1 أكتوبر 1929). "Lecture demonstration of ammonium amalgam". Journal of Chemical Education. ج. 6 ع. 10: 1767. Bibcode:1929JChEd...6.1767R. DOI:10.1021/ed006p1767.
| في كومنز صور وملفات عن: أمونيوم |



2(aq) + H2SO4(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c265d2824540c0b74a76f5b5a8977f15ebb759)
 + NH4+(aq) -> (NH4)2[PtCl6](s) + 2H+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a69d6ef31e3c9bcf45ee5c44678d905e8b2da4b7)
 + 3NH4(aq) -> (NH4)3[Co(NO2)6](s) + 3Na+(aq)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca9e44f38ac92628b9a0c11a84b0f472df75b722)