|
تضامنًا مع حق الشعب الفلسطيني |
ثنائي فلوريد ثنائي الأكسجين
| ثنائي فلوريد ثنائي الأكسجين | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Fluorooxy hypofluorite |
|
| أسماء أخرى | |
Difluorine dioxide Fluorine dioxide Perfluoroperoxide Fluorine peroxide Difluorine peroxide |
|
| المعرفات | |
| رقم CAS | 7783-44-0 |
| بوب كيم (PubChem) | 123257 |
| الخواص | |
| الصيغة الجزيئية | O2F2 |
| الكتلة المولية | 70.00 غ/مول |
| الكثافة | 1.45 غ/سم3 (عند نقطة الغليان) |
| نقطة الانصهار | −163.5° س |
| نقطة الغليان | −57 °س |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثنائي فلوريد ثنائي الأكسجين هو مركب كيميائي من الفلور والأكسجين له الصيغة O2F2، ويكون على شكل غاز بني اللون في الشروط العادية من الضغط ودرجة الحرارة.
التحضير
حضّر ثنائي فلوريد ثنائي الأكسجين لأول مرة من قبل الكيميائي أوتو روف Otto Ruff سنة 1933،[1] وذلك من التفاعل المباشر بين الفلور والأكسجين في منطقة تفريغ كهربائي:[2]
يمكن أن تتم العملية أيضاً من تسخين مزيج غازي الفلور والأكسجين إلى درجة 700 °س، ثم بالتبريد السريع في الأكسجين السائل.[3]
الخواص
عند الشروط العادية من الضغط ودرجة الحرارة يكون ثنائي فلوريد ثنائي الأكسجين على شكل غاز بني اللون، وفي الحالة السائلة على شكل سائل أحمر اللون، وفي الحالة الصلبة على شكل صلب برتقالي اللون.
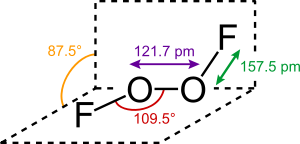
تشبه البنية الجزيئية لمركب ثنائي فلوريد ثنائي الأكسجين تلك التي لمركب فوق أكسيد الهيدروجين H2O2.[4]
إن المركب غير مستقر ويتفكك من الدرجة -95 °س،[5] وهو من العوامل المفلورة بالإضافة إلى كونه من المؤكسدات القوية. فعلى سبيل المثال، يكون لدى ثنائي فلوريد ثنائي الأكسجين القدرة على أكسدة الكلور إلى ثلاثي فلوريد الكلور ClF3، وكبريتيد الهيدروجين إلى سداسي فلوريد الكبريت.[6]
الاستخدامات
يستخدم ثنائي فلوريد ثنائي الأكسجين كعامل مُفَلْور، وذلك للحصول على الفلوريدات العليا من المعادن الثقيلة مثل النبتونيوم، غالباً على شكل سداسي فلوريد:[7]
المراجع
- ^ Ruff، O.؛ Mensel، W. (1933). "Neue Sauerstofffluoride: O2F2 und OF". Zeitschrift für anorganische und allgemeine Chemie. ج. 211 ع. 1–2: 204–208. DOI:10.1002/zaac.19332110122.
- ^ Kwasnik، W. (1963). "Dioxygen Difluoride". في Brauer، G. (المحرر). Handbook of Preparative Inorganic Chemistry (ط. 2nd). NY: Academic Press. ج. 1. ص. 162.
- ^ Mills، Thomas (1991). "Direct synthesis of liquid-phase dioxygen difluoride". Journal of Fluorine Chemistry. ج. 52 ع. 3: 267–276. DOI:10.1016/S0022-1139(00)80341-3.
- ^ A. J. Bridgeman, J. Rothery: "Bonding in mixed halogen and hydrogen peroxides", Journal of the Chemical Society, Dalton Transactions, 1999, S. 4077–4082 (دُوِي:10.1039/a904968a).
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. de Gruyter, Berlin 1995, ISBN 3-11-012641-9
- ^ Ralf Steudel: Chemie der Nichtmetalle; ISBN 978-3-11-012322-7.
- ^ P. Gary Eller, Larned B. Asprey, Scott A. Kinkead, Basil I. Swanson, Richard J. Kissane: „Reactions of Dioxygen Difluoride with Neptunium Oxides and Fluorides“, in: Journal of Alloys and Compounds, 1998, 269 (1–2), S. 63–66 (دُوِي:10.1016/S0925-8388(98)00005-X).
| في كومنز صور وملفات عن: ثنائي فلوريد ثنائي الأكسجين |