|
تضامنًا مع حق الشعب الفلسطيني |
كحول
كحول |

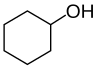
في الكيمياء الكحول (تحريف الغَوْل (جمعها: كحولات، أغوال)) هو نوع من المركبات العضوية التي تحمل على الأقل مجموعة وظيفية واحدة من الهيدروكسيل (−OH) مرتبطة بذرة كربون مشبعة. يشير مصطلح الكحول في الأصل إلى الكحول الأساسي الإيثانول (الكحول الإيثيلي) والذي يستخدم كدواء، وهو الكحول الرئيسي الموجود في المشروبات الكحولية. جميع المواد الكيميائية التي تتوافق مع الصيغة العامة CnH2n + 1OH تمثل فئة مهمة من الكحوليات، والتي يعتبر الميثانول والإيثانول أمثلة عليها. الكحولات الأحادية البسيطة التي هي موضوع هذه المقالة تشمل: الكحوليات الأولية (RCH2OH) والثانوية (R2CHOH) والثلاثية (R3COH).
تظهر اللاحقة -ol في الاسم الكيميائي الصادر عن الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) لجميع المواد التي تكون فيها مجموعة الهيدروكسيل هي المجموعة الوظيفية ذات الأولوية القصوى. تضاف البادئة hydroxy- إلى الاسم الكيميائي للمركب عند وجود مجموعة ذات أولوية أعلى في المركب. تشير أيضًا اللاحقة -ol في أسماء المركبات الأخرى (مثل الباراسيتامول أو الكوليسترول) أيضًا إلى أن المادة عبارة عن كحول، ومع ذلك فإن بعض المركبات التي تحتوي على مجموعات هيدروكسيل وظيفية لها أسماء غير مهمة لا تتضمن اللاحقة -ol أو البادئة هيدروكسي- ، على سبيل المثال سكريات الجلوكوز والسكروز.
الأنواع

الكحولات غالباً هي سوائل شفافة تتكون من مركبات عضوية، وهي عبارة عن اتحاد مجموعتين كيميائيتين هما مجموعة الهيدروكسيل ومجموعة ألكيل أي أنها تتكون من ذرات أكسجين وهيدروجين، وتعتبر أحد المشتقات العضوية للماء، لكن بتبديل إحدى ذرات الهيدروجين بمجموعة ألكيل، كما تحظى الكحولات بانتشار واسع في الكثير من التطبيقات في حياتنا اليومية، حيث تدخل في صناعة العطور ومستحضرات التجميل، وتستعمل أيضاً كمواد معقّمة للمعدات الطبية وغيرها، ويتواجد في بعض أنواع الوقود وفي المشروبات الكحولية إذ تحتوي على مادةٍ مخدرة تساعد في ذهاب العقل.
من الأمثلة على الكحولات:
التصنيف
تبعا لعدد مجموعات الهيدروكسيل
- أحادية الهيدروكسيل، الصيغة العامة: CnH2n+2O مثال: الكحول الميثيلي
- ثنائية الهيدروكسيل، الصيغة العامة: CnH2n+2O2 مثال: الجليكول
- ثلاثية الهيدروكسيل، الصيغة العامة: CnH2n+2O3 مثاله: الجلسرين أو الجلسرول
- عديدة الهيدروكسيل، الصيغة العامة: CnH2n+2OX مثاله: الجلوكوز
تبعا لطبيعة ذرة الكربون المرتبطة مباشرة بمجموعة الهيدروكسيل:
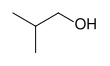
- أولية:ا لكحولات التي ترتبط فيها مجموعة الهيدروكسيل بذرة كربون ترتبط مباشرة بمجموعة ألكيل واحدة، الصيغة العامة: R-CH2-OH
- ثانوية:الكحولات التي ترتبط فيها مجموعة الهيدروكسيل بذرة كربون ترتبط مباشرة بمجموعتي ألكيل، الصيغة العامة: R2-CH-OH
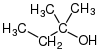
- ثالثية:الكحولات التي ترتبط فيها مجموعة الهيدروكسيل بذرة كربون ترتبط مباشرة بثلاث مجموعات ألكيل، الصيغة العامة: R3-C-OH
تصنيف الكحوليات الاحادية الهيدروكسيل:
ملاحظة: تصنف جميع الكحوليات احادية الهيدروكسيل إلى كحوليات احادية الدرجة وثنائية الدرجة وثلاثية الدرجة ويستثنى من هذة التصنيفات الكحول الميثيلي وذلك لأن ذرة الكربون المرتبطة بمجموعة الهيدروكسيل لاترتبط مباشرة بمجموعة ألكيل.
الخواص الفيزيائية والكيميائية
الكحول هي مركبات قطبية تمتاز بخاصية تكوين الاربطة الهيدروجينية بين جزيئاتها حيث أنها تحتوي على مجموعة الهيدروكسيل التي تعمل على تزايد التماسك بين الاربطة تمتاز بدرجة غليان وكثافة مرتفعتان، تذوب في المذيبات القطبية كالماء حيث إنها تكون مع الماء روابط هيدروجينية وتتميز كذلك بأنه كلما زادت كتلتها الجزيئية تقل درجة ذوبانه في الماء وتزداد درجة غليانه وانصهارة وكثافته.
درجة الغليان
ترتفع درجة غليان الكحولات بارتفاع عدد ذرات الكربون الموجودة في تركيبها، كما تمتلك الكحولات درجة غليان أعلى بكثير من غيرها من المركبات الأخرى مثل مجموعة الألكانات.
روابط الهيدروجين
ترتبط ذرات الهيدروجين الموجبة مع ذرات الأكسجين السالبة مكونةً بذلك ذرات قوية جداً تحتاج إلى طاقة هائلة لكسرها، يعود السبب في ذلك لارتفاع درجة غليان الكحولات.
الذوبان في الماء
تقل نسبة ذائبية الكحول بزيادة عدد ذرات الكربون في تركيبها، ويظهر ذلك جليّاً عند وجود أربع ذرات كربون في سلسلة الهيدروكربون المكونة للكحول.
الحمضية و القاعدية
تعتبر الكحولات من القواعد والأحماض الضعيفة.
تسمية الكحولات
- التسمية الشائعة: كحول + ألكيلي، مثال: كحول ميثيلي
- التسمية النظامية: يتم اختيار أطول سلسلة كربونية مستمرة تحتوي على مجموعة الهيدروكسيل كمركب ألكاني أساسي ويضاف إليها المقطع «ول». ترقم السلسلة بحيث تعطى ذرة الكربون الحاملة لمجموعة لبهيدروكسيل أصغر رقم ممكن بغض النظر عن موقع المجموعات الفرعية الأخرى.
| النوع | المعاددلة | اسم الاتحاد الدولي للكيمياء البحتة والتطبيقية | اسم شائع |
|---|---|---|---|
| مونوهيدريك كحول |
CH3OH | ميثانول | كحول الخشب |
| C2H5OH | إيثانول | كحول | |
| C3H7OH | إيزوبروبانول | كحول الأيزوبروبيل, كحول محمر | |
| C4H9OH | 1-بوتانول | بيوتانول, كحول بوتيل | |
| C5H11OH | بنتانول-1 | بنتانول, كحول أميل | |
| C16H33OH | Hexadecan-1-ol | كحول سيتيلي | |
| متعدد الهيدروكسيل كحول |
C2H4(OH)2 | Ethane-1,2-diol | إيثيلين غليكول |
| C3H6(OH)2 | Propane-1,2-diol | بروبيلين غليكول | |
| C3H5(OH)3 | Propane-1,2,3-triol | غليسرول | |
| C4H6(OH)4 | Butane-1,2,3,4-tetraol | إريثريتول, ثريتول | |
| C5H7(OH)5 | Pentane-1,2,3,4,5-pentol | زيليتول | |
| C6H8(OH)6 | hexane-1,2,3,4,5,6-hexol | مانيتول, سوربيتول | |
| C7H9(OH)7 | Heptane-1,2,3,4,5,6,7-heptol | فوليميتول | |
| غير المشبعة مركب أليفاتي الكحولات |
C3H5OH | Prop-2-ene-1-ol | أليل الكحول |
| C10H17OH | 3,7-Dimethylocta-2,6-dien-1-ol | جيرانيول | |
| C3H3OH | Prop-2-yn-1-ol | كحول Propargyl | |
| مركب أليفاتي حلقي الكحولات |
C6H6(OH)6 | Cyclohexane-1,2,3,4,5,6-hexol | إينوزيتول |
| C10H19OH | 5-Methyl-2-(propan-2-yl)cyclohexan-1-ol | منثول |
السُمية
التسمم بالكحول الميثيلي عن طريق الاستنشاق أو أبخرته أو عند غش المشروبات الروحية بدل من الكحول الإيثيلي، طرحه من الجسم بطئ ويحتاج إلى عدة أيام.
- الجرعة السامة : الجرعة المميتة حوالي (30-100 مل) وتختلف من شخص للأخر والأشخاص المدمنين على المشروبات الكحولية يكونوا أشد حساسية.
- المعالجة : إجراء التنفس الاصطناعي. يعطى حمض الفوليك وريديا لتسريع انطراح حمض النمل.
- عند التسمم الهضمي تجرى عملية غسل معوي.
- في حالة الجرعات الكبيرة تجرى عملية غسل للكلى.
كيمياء الكحول
طرق التحضير
طرق مخبرية
هناك ثلاث طرق عامة لتحضير الكحول:
- من هاليدات الألكيل : تتفاعل هاليدات الألكيل مع NaOH المائي أو KOH لتعطي كحولا أولية وملح.
R-Br + KOH → R-OH + KBr
- من الألدهيدات والكيتونات: يتم ارجاع هذه المركبات باستخدام بوروهيدريد الصوديوم أو ليتيوم ألمنيوم هيدريد:
R-CHO - [O] → R-OH
- من الألكينات : تفاعل هدرجة محفّز حمضيا acid catalysed باستخدام حمض الكبريت المكثف كوسيط (تعطي هذه الطريقة كحولا ثانوية وثالثية بشكل رئيسي)
- C2H4 + H2SO4 (l) → C2H5-HSO4
- C2H5-HSO4 + H2O → C2H5OH + H2SO4
يمكن تحضير الكحول الثانوية باستخدام الطريقتين الأخيرتين كما يلي:
طرق صناعية
- C12H22O11 → C6H12O6 + C6H12O6
- Invertase → glucose + fructose
- C6H12O6 + H2O → C2H5OH + CO2
- Glucose → zymase + ethanol
- إماهة : باستخدام الايثين أو ألكينات أخرى مأخوذة من أجزاء من الزيت المقطر. وباستعمال محفز من حمض الفوسفور تحت ضغط ودرجة حرارة عالية.
- ميثانول من بخار الماء: عملية اصطناع غازية يحدث فيها دمج لجزيء CO مع جزيئين H2 لإنتاج الميتانول باستخدام النحاس كمحفز، ZnO وAl2O3 كمحفزات عند درجة حرارة 250 °C وضغط 50يساوي -100 ضغط جوي.
- [CO + H2] + H2O (g) → CH3OH
التفاعلات
نزع البروتون
يمكن للكحول أن تسلك سلوك الحموض الضعيفة فتخضع لتفاعل نزع البروتون منتجة ملح الكوكسيد وذلك إما باستخدام هيدريد صوديوم أو ن-بوتيل الليتيوم أو باستخدام أحد معدنين: الصوديوم أو البوتاسيوم.H + 2 NaH → 2 R-O-Na+ + H2↑
- 2 R-OH + 2Na → 2R-O−Na+
- مثلا 2 إيثانول + 2 Na → 2 CH3-CH2-O−Na+
الماء مشابه للعديد من الكحول في درجة pKa لهم، لذلك فإن التوازن الكيميائي في تفاعل الكحول مع القلويات مثل هيدروكسيد الصوديوم ييل دوما نحو اليسار:
- R-OH + NaOH <=> R-O-Na+ + H2O (equilibrium to the left)
تفاعلات التبادل المحبة للنواة
لا تعتبر مجموعة الهيدروكسيل مجموعة مغادرة جيدة في تفاعلات التبادل المحبة للنواة، لذا فإن الكحول المعتدلة لا تشارك في هذه التفاعلات. لكن إذا حصلت برتنة للأكسجين الكحولي أولا لنحصل على R−OH2+,، عندئذ يكون لدينا مجموعة مغادرة ممتازة هي جزيئة الماء لكونها أكثر ثباتا ترموديناميا عندما تكون مستقلة ويحدث عندئذ تقاعل التبادل المحب للنواة.
الكحول الثالثية تتفاعل مباشرة مع حمض كلور الماء لإنتاج هاليدات ألكيل ثالثية، حيث يتم استبدال زمرة الهيدروكسيل بذرة كلور.
أما الكحول الثنائية والأولية فهي بحاجة لمنشط عند تفاعلها مع حمض كلور الماء، أهم هذه المنشطات التفاعلية هي كلوريد الزنك أو يمكن أحداث التحول مباشرة باستخدام كلوريد التيونيل

يمكن أيضا تحويل الكحول إلى بروميدات اللكيل باستخدام حمض بروم الماء أو ثلاثي بروميد الفوسفور.
- 3 R-OH + PBr3 → 3 RBr + H3PO3
تفاعلات نزع الماء
الكحول بحد ذاتها محبة للنواة، لذا فإن R−OH2+ يمكن أن يتفاعل مع ROH لإنتاج ايترات وماء. التفاعل يخضع بشكل عام لقاعدة زايتسيف، التي تقول أن الألكين الأكثر ثباتا (و هو عادة الألكين الأكثر تبادلية) هو الذي يتشكل. تختلف درجة سهولة هذا التفاعل حسب رتبة الغوال فالكحول الثالثية تخسر الماء في درجات حرارة أعلى من درجة حرارة الغرفة بقليل، في حين تحتاج الغوال الولية درجات حرارة أعلى بكثير.
المخطط التالي يبين تفاعل نزع الماء من ايتانول متحولا إلى ايتن:
الأسترة
- R-OH + R'-COOH ↔ R'-COOR + H2O
الأكسدة
3 CH3-CH(-OH)-CH3 + K2Cr2O7 + 4 H2SO4 → 3 CH3-C(=O)-CH3 + Cr2(SO4)3 + K2SO4 + 7 H2O
مراجع
| كحول في المشاريع الشقيقة: | |