|
تضامنًا مع حق الشعب الفلسطيني |
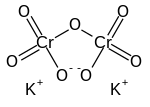
ثنائي كرومات البوتاسيوم
| ثنائي كرومات البوتاسيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
Potassium dichromate(VI) |
|
| أسماء أخرى | |
بيكرومات البوتاسيوم |
|
| المعرفات | |
| رقم CAS | 7778-50-9 |
| بوب كيم (PubChem) | 24502 |
| الخواص | |
| الصيغة الجزيئية | K2Cr2O7 |
| الكتلة المولية | 294.18 غ/مول |
| المظهر | بلورات برتقالية |
| الكثافة | 2.68 غ/سم3 (النمط α) |
| نقطة الانصهار | 398 °س (النمط α) |
| نقطة الغليان | ~ 500 °س يتفكك |
| الذوبانية في الماء | 4.9 غ/100 مل ماء (0 °س) 102 غ/100 مل ماء (100 °س) |
| المخاطر | |
| ترميز المخاطر | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثنائي كرومات البوتاسيوم هو مركب كيميائي له الصيغة K2Cr2O7، ويكون على شكل بلورات برتقالية اللون.
التاريخ
استخدم ثنائي كرومات البوتاسيوم من وليام هنري بيركن في أكسدة الأنيلين غير النقي للحصول على أول صباغ يحضر بشكل مصطنع وهو الموفين.
التحضير
يحضر ثنائي كرومات البوتاسيوم بشكل تقني من عملية صهر مشترك لمعدن الكروميت مع كربونات البوتاسيوم (البوتاس) وكربونات الكالسيوم (الحجر الجيري)، وبإجراء عملية الأكسدة بتيار من الهواء. يحصل بالعملية على مركب كرومات البوتاسيوم K2CrO4 الأصفر، والذي يعالج بالحمض وتجرى عليه عملية إعادة تبلور للحصول على ثنائي كرومات البوتاسيوم.
أما مخبرياً، فإن عملية تحضير ثنائي كرومات البوتاسيوم تتم من خلال تفاعل نترات البوتاسيوم مع أكسيد الكروم الثلاثي:
الخصائص
يكون ثنائي كرومات البوتاسيوم على شكل بلورات برتقالية اللون، غير حاوية على ماء التبلور، وليست ذات قابلية للاسترطاب، وذلك على العكس من مركب ثنائي كرومات الصوديوم.[1]
لثنائي كرومات البوتاسيوم خصائص مؤكسدة قوية، وخاصة في الأوساط الحمضية، إذ أنه في الأوساط القلوية يكون أنيون الكرومات 2−CrO4 هو السائد. عندما يضاف كاشف قلوي إلى محلول ثنائي كرومات البوتاسيوم البرتقالي فإن اللون يتحول إلى الأصفر بسبب تشكل أنيون الكرومات:
يتفكك المركب عند تعريضه لدرجات حرارة مرتفعة إلى كرومات البوتاسيوم وأكسيد الكروم الثلاثي، مع انطلاق لغاز الأكسجين:
الاستخدامات
يستخدم ثنائي كرومات البوتاسيوم بشكل واسع في المختبرات الكيميائية، حيث يدخل ككاشف في العديد من الاختبارات الكيميائية مثل تحديد نسبة الإيثانول واختبار الفضة واختبار ثنائي أكسيد الكبريت.
يستخدم في مجال الدباغة وذلك كمركب طليعي لشب الكروم.[1][2]
يستخدم في مجال معالجة الخشب من أجل التلطيخ اللوني لبعض الأنواع الخاصة مثل الماهوجني.[3]
احتياطات الأمان
يعد مركب ثنائي كرومات البوتاسيوم ضاراً بالصحة، فهو مثلاً من العوامل المسببة لمرض التهاب الجلد.[4]
للمركب تأثير سام على الأرانب وعلى القوارض، فتراكيز أقل من 14 مغ/كغ أظهرت 50% من حالات نفوق لحيوانات الاختبار تلك عند تعرضها لثنائي كرومات البوتاسيوم.[5]
كما هو الحال مع سائر مركبات الكروم، فإن مركب يصنف من المسرطنات، لذلك يجب أخذ الحذر والحيطة وارتداء معدات الوقاية الشخصية.[6]
المراجع
- ^ أ ب Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. دُوِي:10.1002/14356007.a07_067
- ^ M. Saha, C. R. Srinivas, S. D. Shenoy, C. Balachandran (مايو 1993). "Footwear dermatitis". Contact Dermatitis. ج. 28 ع. 5: 260–264. DOI:10.1111/j.1600-0536.1993.tb03428.x. PMID:8365123. مؤرشف من الأصل في 2021-03-23.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)[وصلة مكسورة] - ^ Jewitt، Jeff (1997). Hand-Applied Finishes. Newtown, CT USA: The Taunton Press, Inc. ISBN:1-56158-154-2. مؤرشف من الأصل في 2021-03-07.
- ^ Farokh J. Master (2003). Diseases of Skin. New Delhi: B Jain Pub Pvt Ltd. ص. 223. ISBN:81-7021-136-0. مؤرشف من الأصل في 2020-01-28.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ "Potassium dichromate MSDS". Sigma-Aldrich. مؤرشف من الأصل في 2020-01-28. اطلع عليه بتاريخ 2011-07-20.
{{استشهاد ويب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ "Potassium dichromate MSDS". JT Baker. مؤرشف من الأصل في 2018-10-02.
| في كومنز صور وملفات عن: ثنائي كرومات البوتاسيوم |