|
تضامنًا مع حق الشعب الفلسطيني |
إيثانولامين
| إيثانولامين | |
|---|---|
| اعتبارات علاجية | |
| معرّفات | |
| CAS | 141-43-5 |
| بوب كيم | CID 700 |
| درغ بنك | DB03994 |
| كيم سبايدر | 13835336 |
| المكون الفريد | 5KV86114PT |
| كيوتو | D05074 |
| ChEBI | CHEBI:16000 |
| ChEMBL | CHEMBL104943 |
| بيانات كيميائية | |
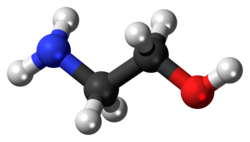
| الصيغة الكيميائية | C2H7NO |
| الكتلة الجزيئية | 1.0117 غرام لكل مول |
| بيانات فيزيائية | |
| نقطة الانصهار | 10.3 درجة مئوية °C (خطأ في التعبير: علامة ترقيم لم نتعرف عليها «[». °F) |
| تعديل مصدري - تعديل | |
الإيثانولامين (ويسمّى أيضًا ثنائي أمينو إيثانول، أو أحادي إيثانول أمين) مركب كيميائي عضوي له الصيغة الجزيئيّة HOCH2CH2NH2 أو C2H7NO.[1]
يحتوي جزيء الإيثانولامين ثنائي الوظائف على أمين أولي وكحول أولي. والإيثانولامين سائل لزج عديم اللون له رائحة تشبه رائحة الأمونيا (النشادر).[2] تدخل جزيئات الإيثانولامين في تكوين الأغشية الخلوية، لذا فإنّها تُعتبر أحد المواد البنائيّة الأساسية المكونة للحياة. كان يُعتقد في السابق أن مادة الإيثانولامين موجودة فقط على كوكب الأرض وعلى بعض الكويكبات الأخرى، ولكن في عام 2021، عُثر على أدلة توضح أن جزيئات الإثانولامين موجودة أيضاً في الفضاء وبين النجوم.[3]
تنتشر مشتقات الإيثانولامين في الطبيعة ومنها على سبيل المثال الليبيدات، وهي مركبات طليعية تدخل في تركيب مجموعة متنوعة من مركبات عديدات الأسيل-إيثانولامين التي تنظم العديد من العمليات الفسيولوجية للحيوانات والنباتات مثل إنبات البذور، والتفاعلات بين العوامل الممرضة للنبات، وتطور البلاستيدات الخضراء وتكوين الزهور في النباتات المزهرة،[4] والنباتات الطليعية. يتفاعل الإيثانولامين أيضًا مع حمض الأراكيدونيك ذو الصيغة الجزيئية (C20H32O2; 20:4, ω-6) ويكوّنان معاً الأنانداميد (AEA: C22H37NO2; 20:4, ω-6).[5]
يتكون الإيثانولامين من مجموعة من الكحولات الأمينية. وهناك فئة من مضادات الهيستامين تصنّف مركباتها ضمن مجموعة الإيثانولامين، وتشمل مركبات الكاربينوكسامين، والكليماستين، والديمينهيدرينات، والكلورفينوكسامين، والديفينهيدرامين، والدوكسيلامين.[6][7]
الإيثانولامين المخلّق صناعيّاً
 يمكن إنتاج مركب أحادي الإيثانولامين صناعياً عن طريق معالجة أكسيد الإيثيلين باستخدام الأمونيا المائية، وينتج التفاعل أيضًا ثنائي الإيثانولامين، وثلاثي الإيثانولامين. ويمكن التحكم في نسبة نواتج التفاعل عن طريق قياس العناصر المتفاعلة.[8]
يمكن إنتاج مركب أحادي الإيثانولامين صناعياً عن طريق معالجة أكسيد الإيثيلين باستخدام الأمونيا المائية، وينتج التفاعل أيضًا ثنائي الإيثانولامين، وثلاثي الإيثانولامين. ويمكن التحكم في نسبة نواتج التفاعل عن طريق قياس العناصر المتفاعلة.[8]
الكيمياء الحيوية
يتم إنتاج الإيثانولامين حيويًا عن طريق نزع شق الكربوكسيل من مركب السيرين تبعا للمعادلة التالية:[9]
HOCH2CH(CO2H)NH2 → HOCH2CH2NH2 + CO2
تُعتبر مركبات الإيثانولامين مثل فوسفاتيد الإيثانولامين ثاني أكثر المجموعات وفرة في الليبيدات الفسفورية، والمواد الموجودة في الأغشية الحيوية (وخاصة الأغشية الحيوية الموجودة في بدائيات النوى). كما أنها تستخدم في الجزيئات المرسلة مثل البالميتويليثانولاميد، والتي لها تأثير على المستقبلات من النوع CB1.[10]
التطبيقات
يُطلق على الإيثانولامين عادةً اسم أحادي الإيثانولامين (MEA) لتمييزه عن ثنائي الإيثانولامين (DEA) وثلاثي إيثانولامين (TEA). ويُستخدم كمادة خام في صناعة المنظفات، والمستحلبات، ومواد التلميع، والمستحضرات الصيدلانية، ومثبطات التآكل، والمواد الكيميائية الوسيطة. فعلى سبيل المثال، يؤدي تفاعل الإيثانولامين مع الأمونيا إلى تكوين الإيثيلين ديامين، وهو مركب طليعي لعامل مخلب شائع الاستخدام هو EDTA.
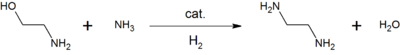
تنقية الغازات
يستطيع مركب أحادي الإيثانولامين تنقية الفحم المحترق والميثان المحترق، وانبعاثات مداخن الغاز الطبيعي المحترق من ثاني أكسيد الكربون (CO2) بكفاءة عالية. وتستخدم تقنية إزالة ثاني أكسيد الكربون باستخدام أحادي الإيثانولامين لتجديد الهواء في الغواصات.
تُستخدم محاليل أحادي الإيثانولامين في الماء كسائل مزيل للغازات في معالجات الأمين. فعلى سبيل المثال، يستخدم أحادي الإيثانولامين المائي لإزالة غاز ثاني أكسيد الكربون (CO2) وغاز كبريتيد الهيدروجين (H2S) من الغازات المختلفة مثل غاز المداخن، والغاز الطبيعي.[11] يعمل أحادي الإيثانولامين على تأيين المركبات الحمضية الذائبة مما يجعلها أكثر قطبية ومن ثمّ أكثر قابلية للذوبان.
يمكن إعادة تدوير محاليل أحادي الإيثانولامين عبر وحدات للتجديد. فعند تسخين محاليل أحادي الإيثانولامين المختلطة بالغازات يطرد أحادي الإيثانولامين غاز كبريتيد الهيدروجين المذاب أو غاز ثاني أكسيد الكربون حيث يمثلان قاعدة ضعيفة نوعًا ما، وينتج عن التفاعل محلول نقي من أحادي الإيثانولامين.[8][12]
استخدامات أخرى
يستخدم أحادي الإيثانولامين في المستخضرات الصيدلانية بشكل أساسي للتخزين المؤقت، أو تحضير المستحلبات، كما يمكن استخدامه كمنظم للأس الهيدروجيني في مستحضرات التجميل.[13]
يستخدم أحادي الإيثانولامين لبعض الأغراض العلاجية أيضًا كمادة تصليب تُعطى عن طريق الحقن كخيار علاجي للبواسير المصحوبة بأعراض حيث يمكن حقن ما بين 2-5 ملليغرام من أحادي الإيثانولامين في الغشاء المخاطي فوق البواسير مباشرة لإحداث تقرح وتثبيت مخاطي، ومن ثم منع البواسير من النزول خارج القناة الشرجية.
يدخل أحادي الإيثانولامين أيضاً ضمن مكونات سائل تنظيف الزجاج الأمامي للسيارات.[14]
التحكم في درجة الحامضية
عادةُ ما يُستخدم الإيثانولامين في زيادة قلوية الماء في الدورات البخارية لمحطات الطاقة مثل محطات الطاقة النووية التي تستخدم مفاعلات الماء المضغوط. ويكون الهدف من هذه العمليّة هو التحكم في تآكل المكونات المعدنية. ويتم اختيار الإيثانولامين (أو في بعض الأحيان أمين عضوي مشابه مثل المورفولين) لأنه لا يتراكم في الشقوق ومولدات البخار (الغلايات) بسبب تقلبها، بل يتوزّع بشكل موحّد نسبيًا طوال دورة البخار بأكملها. لذا يعتبر الإيثانولامين مكونًا رئيسيًا في مثل هذه التطبيقات لما يُعرف بالمعالجة الشاملة المتطايرة للمياه.
التفاعلات
عند تفاعل الإيثانولامين مع ثاني أكسيد الكربون، يتفاعل جزيئين من الإيثانولامين مع جزيء ثاني أكسيد الكربون في وجود حمض الكربونيك كوسط كيميائي لتكوين ملح كرباماتي،[15] والذي يمكن من خلال تسخينه الحصول على الإيثانولامين وثاني أكسيد الكربون مرة أخرى.
المراجع
- ^ "National Library of Medicine. PubChem. Ethanolomine". NIH, National Library of Medicine. مؤرشف من الأصل في 2021-10-08. اطلع عليه بتاريخ 2021-09-05.
- ^ Matthias Frauenkron, Johann-Peter Melder, Günther Ruider, Roland Rossbacher, Hartmut Höke (2002). "Ethanolamines and Propanolamines". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a10_001. ISBN:3527306730.
- ^ "First evidence of cell membrane molecules in space". Astronomy Magazine. 28 مايو 2021. مؤرشف من الأصل في 2021-10-14. اطلع عليه بتاريخ 2021-09-04.
- ^ Coutinho، Bruna G.؛ Mevers، Emily؛ Schaefer، Amy L.؛ Pelletier، Dale A.؛ Harwood، Caroline S.؛ Clardy، Jon؛ Greenberg، E. Peter (25 سبتمبر 2018). "A plant-responsive bacterial-signaling system senses an ethanolamine derivative". Proceedings of the National Academy of Sciences of the United States of America. ج. 115 ع. 39: 9785–9790. DOI:10.1073/pnas.1809611115. ISSN:0027-8424. PMC:6166808. PMID:30190434.
- ^ Marzo, V. Di; Petrocellis, L. De; Sepe, N.; Buono, A. (15 Jun 1996). "Biosynthesis of anandamide and related acylethanolamides in mouse J774 macrophages and N18 neuroblastoma cells". Biochemical Journal (بEnglish). 316 (Pt 3): 977–84. DOI:10.1042/bj3160977. PMC:1217444. PMID:8670178.
- ^ R. E. Reitmeier؛ V. Sivertz؛ H. V. Tartar (1940). "Some Properties of Monoethanolamine and its Aqueous Solutions". Journal of the American Chemical Society. ج. 62 ع. 8: 1943–1944. DOI:10.1021/ja01865a009.
- ^ Cough, Cold, and Allergy Preparation Toxicity في موقع إي ميديسين
- ^ أ ب Klaus Weissermel؛ Hans-Jürgen Arpe؛ Charlet R. Lindley؛ Stephen Hawkins (2003). "Chap. 7. Oxidation Products of Ethylene". Industrial Organic Chemistry. Wiley-VCH. ص. 159–161. ISBN:3-527-30578-5.
- ^ "Archived copy". مؤرشف من الأصل في 2012-08-21. اطلع عليه بتاريخ 2015-08-09.
{{استشهاد ويب}}: صيانة الاستشهاد: الأرشيف كعنوان (link) - ^ Calignano، A؛ La Rana، G؛ Piomelli، D (2001). "Antinociceptive activity of the endogenous fatty acid amide, palmitylethanolamide". European Journal of Pharmacology. ج. 419 ع. 2–3: 191–8. DOI:10.1016/S0014-2999(01)00988-8. PMID:11426841. مؤرشف من الأصل في 2021-07-15.
- ^ Emergency and Continuous Exposure Guidance Levels for Selected Submarine Contaminants. 2007. DOI:10.17226/11170. ISBN:978-0-309-09225-8. مؤرشف من الأصل في 2015-09-08.
- ^ "Ethanolamine". إدارة السلامة والصحة المهنية. مؤرشف من الأصل في 2013-05-03. اطلع عليه بتاريخ 2008-05-11.
- ^ F. Carrasco (2009). "Ingredientes Cosméticos". Diccionario de Ingredientes Cosméticos 4ª Ed. www.imagenpersonal.net. ص. 306. ISBN:978-84-613-4979-1.
- ^ Federal Motor Vehicle Safety Standards نسخة محفوظة 2021-11-21 على موقع واي باك مشين.
- ^ Lu، Yanyue (26 ديسمبر 2013). "Absorption of Carbon Dioxide in Ethanolamine Solutions". www.asianjournalofchemistry.co.in. مؤرشف من الأصل في 2021-11-21. اطلع عليه بتاريخ 2021-03-16.
| إيثانولامين في المشاريع الشقيقة: | |