|
تضامنًا مع حق الشعب الفلسطيني |
نحاس: الفرق بين النسختين
عبود السكاف (نقاش | مساهمات) ط (بوت:إزالة قالب:وصلة إنترويكي من وصلة زرقاء) |
عبود السكاف (نقاش | مساهمات) طلا ملخص تعديل |
||
| سطر 1: | سطر 1: | ||
{{عن|3=نحاس (توضيح)}} | {{عن|3=نحاس (توضيح)}} | ||
{{ميز|نحاس أصفر}} | {{ميز|نحاس أصفر}} | ||
| سطر 48: | سطر 47: | ||
من التطبيقات الأولى للنحاس في العصر الحديث استخدامُهُ في الأشكال الأولى من التصوير المعروف باسم فنّ [[نقش على النحاس|النقش على النحاس]] {{#tag:ref|Chalcography|group="ط"}} ولاحقاً في أسلوب التصوير المعروف باسم [[داجيرية]] {{#tag:ref|Daguerreotype|group="ط"}}، وكذلك في [[سك العملة|سكّ العملة]]؛ كما شاع استخدمه في إنشاء التماثيل، كما هو الحال في [[تمثال الحرية]] مثلاً، بالإضافة إلى استخدامه في إكساء سقوف وقبب العمارات،<ref name=":0" /> وكذلك في الإنشاءات مثل [[طلي بالنحاس|الطلي]] {{#tag:ref|Copper plating|group="ط"}} و[[تغميد بالنحاس|التغميد بالنحاس]] {{#tag:ref|Copper sheathing|group="ط"}}.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Copper and Brass in Ships|مسار = https://www.copper.org/education/history/60centuries/industrial_age/copperand.html|تاريخ الوصول = 30-09-2023| لغة =en|موقع = Copper Development Association Inc.| مسار أرشيف = https://web.archive.org/web/20220408173033/https://www.copper.org/education/history/60centuries/industrial_age/copperand.html | تاريخ أرشيف = 08-04-2022 }}</ref> كانت منشأة {{ط|تنقية الفلزّات شمالي ألمانيا}} {{#tag:ref|Norddeutsche Affinerie|group="ط"}} في مدينة [[هامبورغ]] (المعروفة حالياً باسم [[آوروبيس]] {{#tag:ref|Aurubis|group="ط"}} أوّل وأكبر منشأةٍ [[طلي كهربائي|للطلي الكهربائي]] {{#tag:ref|electroplating|group="ط"}} في أوروبا، وكان الإنتاج فيها قد بدأ سنة 1876.<ref>{{استشهاد مختصر|Stelter|2004|ص=558–562|لغة=en}}</ref> | من التطبيقات الأولى للنحاس في العصر الحديث استخدامُهُ في الأشكال الأولى من التصوير المعروف باسم فنّ [[نقش على النحاس|النقش على النحاس]] {{#tag:ref|Chalcography|group="ط"}} ولاحقاً في أسلوب التصوير المعروف باسم [[داجيرية]] {{#tag:ref|Daguerreotype|group="ط"}}، وكذلك في [[سك العملة|سكّ العملة]]؛ كما شاع استخدمه في إنشاء التماثيل، كما هو الحال في [[تمثال الحرية]] مثلاً، بالإضافة إلى استخدامه في إكساء سقوف وقبب العمارات،<ref name=":0" /> وكذلك في الإنشاءات مثل [[طلي بالنحاس|الطلي]] {{#tag:ref|Copper plating|group="ط"}} و[[تغميد بالنحاس|التغميد بالنحاس]] {{#tag:ref|Copper sheathing|group="ط"}}.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Copper and Brass in Ships|مسار = https://www.copper.org/education/history/60centuries/industrial_age/copperand.html|تاريخ الوصول = 30-09-2023| لغة =en|موقع = Copper Development Association Inc.| مسار أرشيف = https://web.archive.org/web/20220408173033/https://www.copper.org/education/history/60centuries/industrial_age/copperand.html | تاريخ أرشيف = 08-04-2022 }}</ref> كانت منشأة {{ط|تنقية الفلزّات شمالي ألمانيا}} {{#tag:ref|Norddeutsche Affinerie|group="ط"}} في مدينة [[هامبورغ]] (المعروفة حالياً باسم [[آوروبيس]] {{#tag:ref|Aurubis|group="ط"}} أوّل وأكبر منشأةٍ [[طلي كهربائي|للطلي الكهربائي]] {{#tag:ref|electroplating|group="ط"}} في أوروبا، وكان الإنتاج فيها قد بدأ سنة 1876.<ref>{{استشهاد مختصر|Stelter|2004|ص=558–562|لغة=en}}</ref> | ||
بعد دخول عصر [[كهرباء|الكهرباء]] منذ أواخر القرن التاسع عشر ازداد الطلب بشكلٍ كبيرٍ على النحاس، وذلك لاستخدامه في [[تمديد كهربائي|التمديدات الكهربائية]]؛ وكانت الولايات المتّحدة الأمريكية من الدول الرائدة في إنتاج النحاس لتأمين حاجة السوق. مع مرور الوقت تطوّرت وسائل استخراج وإنتاج النحاس، ففي سنة 1949 تمكّنت شركة [[أوتوكمبو]] {{#tag:ref|Outokumpu|group="ط"}} [[فنلندا|الفنلندية]] من ابتكار عملية [[صهر ومضي|الصهر الومضي]] {{#tag:ref|Flash smelting|group="ط"}} المتميّزة بكفاءتها.<ref>{{استشهاد مختصر|Honig|2014|ص=257|لغة=en}}</ref> في سنة 1967 | بعد دخول عصر [[كهرباء|الكهرباء]] منذ أواخر القرن التاسع عشر ازداد الطلب بشكلٍ كبيرٍ على النحاس، وذلك لاستخدامه في [[تمديد كهربائي|التمديدات الكهربائية]]؛ وكانت الولايات المتّحدة الأمريكية من الدول الرائدة في إنتاج النحاس لتأمين حاجة السوق. مع مرور الوقت تطوّرت وسائل استخراج وإنتاج النحاس، ففي سنة 1949 تمكّنت شركة [[أوتوكمبو]] {{#tag:ref|Outokumpu|group="ط"}} [[فنلندا|الفنلندية]] من ابتكار عملية [[صهر ومضي|الصهر الومضي]] {{#tag:ref|Flash smelting|group="ط"}} المتميّزة بكفاءتها.<ref>{{استشهاد مختصر|Honig|2014|ص=257|لغة=en}}</ref> في سنة 1967 أسّست كلّ من [[تشيلي]] و[[بيرو|البيرو]] و[[جمهورية الكونغو الديمقراطية]] و[[زامبيا]] [[المجلس بين الحكومي للدول المصدرة للنحاس|المجلس بين الحكومي للدول المصدّرة للنحاس]] {{#tag:ref|Intergovernmental Council of Countries Exporters of Copper (CIPEC)|group="ط"}} من أجل التحكّم بسوق النحاس، بشكلٍ مماثلٍ لما تقوم به منظّمة [[أوبك]] في سوق [[نفط|النفط]]، إلّا أنّه لم يُكتَب لهذا المجلس طول الاستمرار، إذ انحلّ في سنة 1988.<ref>{{استشهاد مختصر|Mingst|1976|ص=263–287|لغة=en}}</ref> | ||
== الوفرة الطبيعية == | == الوفرة الطبيعية == | ||
| سطر 108: | سطر 107: | ||
; المهبط | ; المهبط | ||
:<math>\mathrm{Cu^{2+} + 2 \ e^- \longrightarrow Cu}</math> | :<math>\mathrm{Cu^{2+} + 2 \ e^- \longrightarrow Cu}</math> | ||
[[ملف:Residuo_electronico_colombia_cobre_reciclaje_metales_2.jpg|تصغير|يمين|80 بك|أسلاك نحاسية مُهيَّأة لإعادة التدوير.]] | |||
وبتلك العملية تنحلّ قطعة النحاس الخام الموجودة على المصعد تدريجياً، في حين تترسّب أيونات النحاس على المهبط، بحيث يُحصَل في النهاية على نحاسٍ ذي [[درجة النقاوة|درجة نقاوة]] تصل إلى 99.99%. | وبتلك العملية تنحلّ قطعة النحاس الخام الموجودة على المصعد تدريجياً، في حين تترسّب أيونات النحاس على المهبط، بحيث يُحصَل في النهاية على نحاسٍ ذي [[درجة النقاوة|درجة نقاوة]] تصل إلى 99.99%. | ||
=== إعادة التدوير === | === إعادة التدوير === | ||
| سطر 169: | سطر 167: | ||
=== المركبات الكيميائية === | === المركبات الكيميائية === | ||
{| class="wikitable" style="float:left; clear:right; margin-left:1em; margin | {| class="wikitable" style="float:left; clear:right; margin-left:1em; margin:0 1em 0em 0;" | ||
! colspan="2" |حالات أكسدة النحاس المختلفة وأمثلةٌ من المركّبات الكيميائية عليها | ! colspan="2" |حالات أكسدة النحاس المختلفة وأمثلةٌ من المركّبات الكيميائية عليها | ||
|- | |- | ||
| سطر 271: | سطر 269: | ||
=== التوصيات الغذائية === | === التوصيات الغذائية === | ||
حدَّثت [[الأكاديمية الوطنية للطب (الولايات المتحدة الأمريكية)|الأكاديمية الوطنية للطبّ]] {{#tag:ref|National Academy of Medicine|group="ط"}} في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) {{#tag:ref|Institute of Medicine (IoM)|group="ط"}} [[كمية غذائية مرجعية|معدّل الحاجة التقريبي]] {{#tag:ref|Estimated Average Requirements (EARs)|group="ط"}} و[[كمية غذائية مرجعية|الكمّيّات المُوصى بتناولها]] {{#tag:ref|Recommended Dietary Allowances (RDAs)|group="ط"}} من النحاس في سنة 2001.<ref name="IoM">{{استشهاد مختصر|National Academies|2001|ص=224–257|لغة=en}}</ref> وفي حال عدم توفّر بيانات كافية من أجل تحديد الكمّيّات المذكورة عمدت الأكاديمية إلى وضع [[كمية غذائية مرجعية|قيم المدخول الكافي]] {{#tag:ref|Adequate Intakes (AIs)|group="ط"}} عوضاً عن ذلك، وذلك على الشكل التالي: مقدار 200 ميكروغرام من النحاس للأطفال من عمر 0-6 أشهر بالنسبة للذكور والإناث؛ وبمقدار 220 ميكروغرام من النحاس للأطفال من عمر 7-12 شهر بالنسبة للذكور والإناث.<ref name="IoM"/> بالنسبة لكلا الجنسين كانت الكمّيّات المُوصى بتناولها من النحاس على الشكل: مقدار 340 ميكروغرام للأطفال بين عمر 1-3 سنة؛ وبمقدار 440 ميكروغرام للأطفال بين عمر 4-8 سنة؛ وبمقدار 700 ميكروغرام للأطفال بين عمر 9-13 سنة؛ وبمقدار 890 ميكروغرام للناشئة بين عمر 14–18 سنة؛ وبمقدار 900 ميكروغرام للبالغين؛ وبمقدار 1000 ميكروغرام بالنسبة للحوامل، وبمقدار 1300 ميكروغرام للمرضعات.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Dietary Reference Intakes: RDA and AI for Vitamins and Elements| مسار = http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRI-Tables/2_%20RDA%20and%20AI%20Values_Vitamin%20and%20Elements.pdf?la=en| موقع = National Academy of Sciences|لغة = en|مسار أرشيف = https://web.archive.org/web/20181113060244/http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRI-Tables/2_%20RDA%20and%20AI%20Values_Vitamin%20and%20Elements.pdf?la=en|تاريخ أرشيف = | حدَّثت [[الأكاديمية الوطنية للطب (الولايات المتحدة الأمريكية)|الأكاديمية الوطنية للطبّ]] {{#tag:ref|National Academy of Medicine|group="ط"}} في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) {{#tag:ref|Institute of Medicine (IoM)|group="ط"}} [[كمية غذائية مرجعية|معدّل الحاجة التقريبي]] {{#tag:ref|Estimated Average Requirements (EARs)|group="ط"}} و[[كمية غذائية مرجعية|الكمّيّات المُوصى بتناولها]] {{#tag:ref|Recommended Dietary Allowances (RDAs)|group="ط"}} من النحاس في سنة 2001.<ref name="IoM">{{استشهاد مختصر|National Academies|2001|ص=224–257|لغة=en}}</ref> وفي حال عدم توفّر بيانات كافية من أجل تحديد الكمّيّات المذكورة عمدت الأكاديمية إلى وضع [[كمية غذائية مرجعية|قيم المدخول الكافي]] {{#tag:ref|Adequate Intakes (AIs)|group="ط"}} عوضاً عن ذلك، وذلك على الشكل التالي: مقدار 200 ميكروغرام من النحاس للأطفال من عمر 0-6 أشهر بالنسبة للذكور والإناث؛ وبمقدار 220 ميكروغرام من النحاس للأطفال من عمر 7-12 شهر بالنسبة للذكور والإناث.<ref name="IoM"/> بالنسبة لكلا الجنسين كانت الكمّيّات المُوصى بتناولها من النحاس على الشكل: مقدار 340 ميكروغرام للأطفال بين عمر 1-3 سنة؛ وبمقدار 440 ميكروغرام للأطفال بين عمر 4-8 سنة؛ وبمقدار 700 ميكروغرام للأطفال بين عمر 9-13 سنة؛ وبمقدار 890 ميكروغرام للناشئة بين عمر 14–18 سنة؛ وبمقدار 900 ميكروغرام للبالغين؛ وبمقدار 1000 ميكروغرام بالنسبة للحوامل، وبمقدار 1300 ميكروغرام للمرضعات.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Dietary Reference Intakes: RDA and AI for Vitamins and Elements| مسار = http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRI-Tables/2_%20RDA%20and%20AI%20Values_Vitamin%20and%20Elements.pdf?la=en| موقع = National Academy of Sciences|لغة = en|مسار أرشيف = https://web.archive.org/web/20181113060244/http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRI-Tables/2_%20RDA%20and%20AI%20Values_Vitamin%20and%20Elements.pdf?la=en|تاريخ أرشيف = 13-11-2018|تاريخ الوصول = 18-04-2018}}</ref> ومن أجل السلامة حُدِّدَ المستوى الأقصى المقبول {{#tag:ref|Tolerable upper intake levels (ULs)|group="ط"}} بالنسبة للنحاس بمقدار 10 ميليغرام في اليوم.<ref name="IoM"/> | ||
وضعت [[الهيئة الأوروبية لسلامة الأغذية]] {{#tag:ref|European Food Safety Authority (EFSA)|group="ط"}} مقادير ضابطة مقاربة، ولكنها أعلى نسبياً لما هو متّبع في الولايات المتّحدة. فبالنسبة للبالغين حُدِّدَت قيم المدخول الكافي بمقدار 1.3 و1.6 ميليغرام في اليوم بالنسبة للنساء والرجال على الترتيب؛ في حين أنّها بالنسبة للحوامل والمرضعات بمقدار 1.5 ميليغرام في اليوم؛ أمّا بالنسبة للأطفال والناشئة من عمر 1-17 سنة فتزداد القيم بشكل تدريجي من 0.7 إلى 1.3 ميليغرام في اليوم.<ref group="وب-إنج">{{استشهاد ويب | وضعت [[الهيئة الأوروبية لسلامة الأغذية]] {{#tag:ref|European Food Safety Authority (EFSA)|group="ط"}} مقادير ضابطة مقاربة، ولكنها أعلى نسبياً لما هو متّبع في الولايات المتّحدة. فبالنسبة للبالغين حُدِّدَت قيم المدخول الكافي بمقدار 1.3 و1.6 ميليغرام في اليوم بالنسبة للنساء والرجال على الترتيب؛ في حين أنّها بالنسبة للحوامل والمرضعات بمقدار 1.5 ميليغرام في اليوم؛ أمّا بالنسبة للأطفال والناشئة من عمر 1-17 سنة فتزداد القيم بشكل تدريجي من 0.7 إلى 1.3 ميليغرام في اليوم.<ref group="وب-إنج">{{استشهاد ويب | ||
| سطر 329: | سطر 327: | ||
[[ملف:Copper_Roof_Dresden_20070114.JPG|تصغير|150 بك|يسار|سقفٌ مصنوعٌ من النحاس لبرج من أبراج [[قلعة درسدن]].]] | [[ملف:Copper_Roof_Dresden_20070114.JPG|تصغير|150 بك|يسار|سقفٌ مصنوعٌ من النحاس لبرج من أبراج [[قلعة درسدن]].]] | ||
شاع منذ القدم استخدام [[النحاس في العمارة]] وضمن مواد البناء، وذلك نظراً لمقاومته [[تآكل|للتآكل]] وللعوامل الجوّية.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Architecture|مسار = http://eurocopper.org/copper/copper-architecture.html|موقع = European Copper Institute|لغة =en | شاع منذ القدم استخدام [[النحاس في العمارة]] وضمن مواد البناء، وذلك نظراً لمقاومته [[تآكل|للتآكل]] وللعوامل الجوّية.<ref group="وب-إنج">{{استشهاد ويب|عنوان = Architecture|مسار = http://eurocopper.org/copper/copper-architecture.html|موقع = European Copper Institute|لغة =en | ||
|مسار أرشيف = https://web.archive.org/web/20121009005711/http://eurocopper.org/copper/copper-architecture.html| تاريخ أرشيف = 09-10-2012}}</ref> إذ استُخدِمَ النحاس في [[تشييد السقف الداخلي|تشييد السقوف الداخلية]]، وفي عزل السقوف وبناء [[مزراب|المزاريب]] و[[ميزاب|الميازيب]]، وكذلك في بناء [[قبة|القبب]] و[[ذروة البرج|ذروات الأبراج]] و[[قنطرة (عمارة)|القناطر]] والأبواب. وعلى الخصوص كان استخدام النحاس في صنع سقوف الأبنية، إذ كان تشكّل [[صدأ النحاس]] {{#tag:ref|Patina|group="ط"}} ذو بعدٍ جماليٍّ في تصميم المدن عند المهندسين، بالإضافة إلى أن طبقة الصدأ تلك كانت تحمي وتقي مكوّنات البناء من التآكل.<ref group="وب-إنج">{{استشهاد ويب|عنوان = 1.3. Architectural Considerations: Weathering, Corrosion, Staining, Substrate, Solder, Sealants|مسار = https://www.copper.org/applications/architecture/arch_dhb/technical discussion/fundamentals/arch_considerations.html|موقع = Copper Development Association Inc.|لغة=en|مسار أرشيف = https://web.archive.org/web/20200421005830/https://www.copper.org/applications/architecture/arch_dhb/technical-discussion/fundamentals/arch_considerations.html| تاريخ أرشيف = 21-04-2020}}</ref> يمكن أن تتكوّن الطبقة من مركّبات كربونات وكبريتات النحاس بنسبٍ وكمّيّاتٍ مختلفة، وذلك حسب الظروف الجوّية المحيطة.<ref>{{استشهاد مختصر|Fitzgerald|1998|ص=2029-2050|لغة=en}}</ref><ref group="وب-إنج">{{استشهاد ويب|مسار=http://www.copperinfo.co.uk/resources/glossary.shtml |عنوان=Glossary of copper terms |موقع = Copper Development Association|لغة=en|تاريخ الوصول=14-09-2012|مسار أرشيف=https://web.archive.org/web/20120820053020/http://www.copperinfo.co.uk/resources/glossary.shtml | |مسار أرشيف = https://web.archive.org/web/20121009005711/http://eurocopper.org/copper/copper-architecture.html| تاريخ أرشيف = 09-10-2012}}</ref> إذ استُخدِمَ النحاس في [[تشييد السقف الداخلي|تشييد السقوف الداخلية]]، وفي عزل السقوف وبناء [[مزراب|المزاريب]] و[[ميزاب|الميازيب]]، وكذلك في بناء [[قبة|القبب]] و[[ذروة البرج|ذروات الأبراج]] و[[قنطرة (عمارة)|القناطر]] والأبواب. وعلى الخصوص كان استخدام النحاس في صنع سقوف الأبنية، إذ كان تشكّل [[صدأ النحاس]] {{#tag:ref|Patina|group="ط"}} ذو بعدٍ جماليٍّ في تصميم المدن عند المهندسين، بالإضافة إلى أن طبقة الصدأ تلك كانت تحمي وتقي مكوّنات البناء من التآكل.<ref group="وب-إنج">{{استشهاد ويب|عنوان = 1.3. Architectural Considerations: Weathering, Corrosion, Staining, Substrate, Solder, Sealants|مسار =https://www.copper.org/applications/architecture/arch_dhb/technical-discussion/fundamentals/arch_considerations.html|موقع = Copper Development Association Inc.|لغة=en|مسار أرشيف = https://web.archive.org/web/20200421005830/https://www.copper.org/applications/architecture/arch_dhb/technical-discussion/fundamentals/arch_considerations.html| تاريخ أرشيف = 21-04-2020}}</ref> يمكن أن تتكوّن الطبقة من مركّبات كربونات وكبريتات النحاس بنسبٍ وكمّيّاتٍ مختلفة، وذلك حسب الظروف الجوّية المحيطة.<ref>{{استشهاد مختصر|Fitzgerald|1998|ص=2029-2050|لغة=en}}</ref><ref group="وب-إنج">{{استشهاد ويب|مسار=http://www.copperinfo.co.uk/resources/glossary.shtml |عنوان=Glossary of copper terms |موقع = Copper Development Association|لغة=en|تاريخ الوصول=14-09-2012|مسار أرشيف=https://web.archive.org/web/20120820053020/http://www.copperinfo.co.uk/resources/glossary.shtml | ||
|تاريخ أرشيف=20-08-2012}}</ref> | |تاريخ أرشيف=20-08-2012}}</ref> | ||
| سطر 335: | سطر 333: | ||
=== متفرّقات === | === متفرّقات === | ||
وُجدَ أنّ النحاس يمتلك طبيعياً خواصّاً [[أسطح لمس سبائك النحاس ومضادة للميكروبات|مضادّةً للميكروبات]]؛<ref name=":1">{{استشهاد مختصر|Montero|2019|ص=1-10|لغة=en}}</ref><ref name=":2" group="وب-إنج">{{استشهاد ويب|تاريخ=05-2008|عنوان=EPA registers copper-containing alloy products|لغة=en|مسار=http://www.epa.gov/pesticides/factsheets/copper-alloy-products.htm|مسار أرشيف=https://web.archive.org/web/20150929135757/http://www.epa.gov/pesticides/factsheets/copper-alloy-products.htm|تاريخ أرشيف=29-09-2015|موقع=United States Environmental Protection Agency}}</ref> لذلك | وُجدَ أنّ النحاس يمتلك طبيعياً خواصّاً [[أسطح لمس سبائك النحاس ومضادة للميكروبات|مضادّةً للميكروبات]]؛<ref name=":1">{{استشهاد مختصر|Montero|2019|ص=1-10|لغة=en}}</ref><ref name=":2" group="وب-إنج">{{استشهاد ويب|تاريخ=05-2008|عنوان=EPA registers copper-containing alloy products|لغة=en|مسار=http://www.epa.gov/pesticides/factsheets/copper-alloy-products.htm|مسار أرشيف=https://web.archive.org/web/20150929135757/http://www.epa.gov/pesticides/factsheets/copper-alloy-products.htm|تاريخ أرشيف=29-09-2015|موقع=United States Environmental Protection Agency}}</ref> لذلك اقتُرحَ استخدامه ضمن مواد البناء في المرافق العامة مثل المشافي ومحطّات المواصلات العامّة.<ref>{{استشهاد مختصر|Biurrun|1999|ص=426–428|لغة=en}}</ref> كما يُستخدَم النحاس وسبائكه في تجهيز معدّات [[تربية الأحياء المائية]] {{#tag:ref|Aquaculture|group="ط"}} بسبب خواصّه [[مضاد الميكروبات|المضادّة للميكروبات]] {{#tag:ref|antimicrobial|group="ط"}} والمقاومة [[حشف حيوي|للحَشْف الحيوي]] {{#tag:ref|Biofouling|group="ط"}}. | ||
== في الحياة والثقافة العامة == | == في الحياة والثقافة العامة == | ||
| سطر 520: | سطر 518: | ||
{{معرفات مركب كيميائي}} | {{معرفات مركب كيميائي}} | ||
{{ضبط استنادي}} | {{ضبط استنادي}} | ||
{{شريط بوابات|إلكترونيات|العناصر الكيميائية|الكيمياء|تعدين|صيدلة|علم الأحجار الكريمة والمجوهرات|علم المواد|علم طبقات الأرض}} | {{شريط بوابات|إلكترونيات|العناصر الكيميائية|الكيمياء|تعدين|صيدلة|علم الأحجار الكريمة والمجوهرات|علم المواد|علم طبقات الأرض}} | ||
{{شريط محتوى متميز|1=مختارة|التاريخ=14 يناير 2024|النسخة=|تاريخ مراجعة الزملاء=13 نوفمبر 2023}} | |||
[[تصنيف:نحاس|*]] | [[تصنيف:نحاس|*]] | ||
النسخة الحالية 01:38، 16 فبراير 2024
| |||||||||||||||||||
| المظهر | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أحمر برتقالي
| |||||||||||||||||||
| الخواص العامة | |||||||||||||||||||
| الاسم، العدد، الرمز | نحاس، 29، Cu | ||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | ||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 11، 4، d | ||||||||||||||||||
| الكتلة الذرية | 63.546 غ·مول−1 | ||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s1] | ||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 1 (صورة) | ||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||
| الطور | صلب | ||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 8.94 غ·سم−3 | ||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 8.02 غ·سم−3 | ||||||||||||||||||
| نقطة الانصهار | 1357.77 ك، 1084.62 °س، 1984.32 °ف | ||||||||||||||||||
| نقطة الغليان | 2835 ك، 2562 °س، 4643 °ف | ||||||||||||||||||
| حرارة الانصهار | 13.26 كيلوجول·مول−1 | ||||||||||||||||||
| حرارة التبخر | 300.4 كيلوجول·مول−1 | ||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 24.440 جول·مول−1·كلفن−1 | ||||||||||||||||||
| ضغط البخار | |||||||||||||||||||
| |||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||
| أرقام الأكسدة | +1, +2, +3, +4 (أكاسيده قاعدية ضعيفة) | ||||||||||||||||||
| الكهرسلبية | 1.90 (مقياس باولنغ) | ||||||||||||||||||
| طاقات التأين | الأول: 745.5 كيلوجول·مول−1 | ||||||||||||||||||
| الثاني: 1957.9 كيلوجول·مول−1 | |||||||||||||||||||
| الثالث: 3555 كيلوجول·مول−1 | |||||||||||||||||||
| نصف قطر ذري | 128 بيكومتر | ||||||||||||||||||
| نصف قطر تساهمي | 4±132 بيكومتر | ||||||||||||||||||
| نصف قطر فان دير فالس | 140 بيكومتر | ||||||||||||||||||
| خواص أخرى | |||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | ||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة | ||||||||||||||||||
| مقاومة كهربائية | 16.78 نانوأوم·متر (20 °س) | ||||||||||||||||||
| الناقلية الحرارية | 401 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||
| التمدد الحراري | 16.5 ميكرومتر·متر−1·كلفن−1 (25 °س) | ||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) (مخمّر) 3810 متر·ثانية−1 | ||||||||||||||||||
| معامل يونغ | 110–128 غيغاباسكال | ||||||||||||||||||
| معامل القص | 48 غيغاباسكال | ||||||||||||||||||
| معامل الحجم | 140 غيغاباسكال | ||||||||||||||||||
| نسبة بواسون | 0.34 | ||||||||||||||||||
| صلادة موس | 3.0 | ||||||||||||||||||
| صلادة فيكرز | 369 ميغاباسكال | ||||||||||||||||||
| صلادة برينل | 874 ميغاباسكال | ||||||||||||||||||
| رقم CAS | 7440-50-8 | ||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||
| المقالة الرئيسية: نظائر النحاس | |||||||||||||||||||
| |||||||||||||||||||
النُّحاس عنصرٌ كيميائي رمزه Cu وعدده الذرّي 29، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة الحادية عشرة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. للنحاس لونٌ بنّيٌّ محمرٌّ مميّز؛ وهو فلزُّ طريٌّ ومطواع وقابل للسحب والطرق؛ ويمتاز بأنه موصل جيّد للكهرباء وناقل جيّد للحرارة أيضاً. يعدّ النحاس من الفلزّات القليلة التي يمكن أن توجد في الطبيعة على شكلها الحرّ، ولكنّه يدخل أيضاً في تركيب عددٍ من المعادن في القشرة الأرضيّة.
عَرَف الإنسان النحاس وتعامل به منذ التاريخ القديم في عددٍ من مناطق العالم؛ وكان أوّل فلزّ تمكّن الإنسان من صهره وسكّه في قوالب، وذلك في الفترة التاريخية بين 5000 إلى 4000 سنة قبل الميلاد، وتُعرَف تلك الحقبة التاريخية باسم «العصر النحاسي». أدّى سبك النحاس مع القصدير إلى الحصول على سبيكة البرونز قرابة سنة 3500 سنة قبل الميلاد؛ وكانت تلك أيضاً مرحلة محدّدة في التاريخ البشري، والتي يشار إليها باسم «العصر البرونزي». كان النحاس يُعدّن في روما القديمة بشكلٍ أساسيّ من جزيرة قبرص، ولذلك يسمّى في اللاتينيّة cuprum، ومن ذلك الاسم يُشتقّ الرمز الكيميائي لهذا العنصر.
يدخل النحاس في عدّة تطبيقات مثل صناعة الأسلاك الكهربائية وأجهزة القياس، وفي صناعة السبائك، وفي سكّ النقود المعدنية وصياغة الحلي والمجوهرات وفي الفنون الزخرفية. كما يدخل النحاس ضمن مواد البناء، وكانت صفائح النحاس مستخدمةً بشكلٍ كبيرٍ لإكساء أسطح وقبب المباني، والتي عندما تتأكسد تتحوّل إلى زنجار (أو صدأ النحاس) المتميّز باللون الأخضر. تُستخدَم مركّبات النحاس بشكلٍ واسعٍ من أجل كبح البكتريا وإبادة الفطريات؛ وفي مجال حفظ الخشب.
للنحاس دورٌ حيويٌّ مهمٌّ، فهو يصنّف ضمن العناصر المعدنية المهمّة للتغذية، لكونه ضرورياً لعمل عددٍ من الإنزيمات، مثل إنزيم سيتوكروم سي أكسيداز المهمّ لعمليّات تنفّس الخلايا؛ كما يعدّ النحاس مكوّناً من مكوّنات هيموسيانين، وهو خضاب الدم في بعض الكائنات الحيّة مثل الرخويات والقشريات. يحوي الإنسان وسطياً ما بين 1.5 إلى 2 ميليغرام من النحاس لكلّ كيلوغرام من وزن الجسم، وهو يتركّز في الكبد والعضلات والعظام.
التاريخ

يُصنّف النحاس ضمن أقدم الفلزّات التي اكتشفها الإنسان القديم واستخدمها في حياته اليومية في مختلف الحضارات في تاريخ البشرية.[وب-إنج 1]
العصور القديمة
- العصر النحاسي
عَرَف الإنسان النحاس منذ القدم، لأنّه من الممكن العثور على هذا الفلز بشكله الطبيعي الحرّ على سطح الأرض؛ لذلك يُصنَّف ضمن أقدم الفلزّات المكتَشَفة إلى جانب الذهب والحديد النيزكي.[وب-إنج 2] تعود أقدم السجلّات التاريخية للنحاس إلى قرابة 9000 سنة قبل الميلاد في منطقة الشرق الأوسط.[وب-إنج 3] إذ عُثِرَ في منطقة بلاد الرافدين في شمالي العراق على حِلْية متدليّة مصنوعة من النحاس يعود تاريخها إلى 8700 سنة قبل الميلاد.[1] مرَّ تاريخ تعدين النحاس بعدّة مراحل، إذ في البداية خضع النحاس الطبيعي لعمليّات تشغيل على البارد [ط 2]؛ ثمّ بمرحلة التلدين [ط 3]؛ ثمّ بمرحلة الصهر [ط 4]؛ وأخيراً بمرحلة السبك بالشمع المفقود [ط 5]. كانت تلك المراحل الأربع حاضرةً في جنوبي شرقي الأناضول في فترة العصر الحجري الحديث قرابة 7500 سنة قبل الميلاد. على العموم تسمّى الحقبة التاريخية الواقعة في أواخر العصر الحجري الحديث [ط 6] والمتقاطعة مع أوائل العصر البرونزي [ط 7] باسم «العصر النحاسي» [ط 8]، وتلك فترة تقع بين الألفية الخامسة قبل الميلاد والألفية الثالثة قبل الميلاد، وسُمّيَت بذلك لانتشار الاكتشافات الأثرية لأدوات مصنوعة من النحاس تعود إلى تلك الحقبة التاريخية.[2] من بين تلك الاكتشافات الأثرية ما عثر عليه في منطقة حجيرة الغزلان في الأردن، إذ توجد شواهد تدلّ على إنتاج النحاس هناك والاتجار به في المنطقة.[3]

كانت المرحلة التاريخية التي تمكّن الإنسان فيها من صهر النحاس فاصلةً ومهمّةً في التاريخ البشري، وقد اكتشفت عدّة مواقع أثرية في العالم بالإضافة إلى منطقة الشرق الأوسط تشير إلى هذه الممارسة؛ وذلك في الصين وأمريكا الوسطى وغرب إفريقيا على سبيل المثال؛ وكذلك في جنوب شرق آسيا حيث عُثِرَ هناك على مشغولات نحاسية مصنوعة وفق أسلوب السبك الدقيق [ط 9] تعود إلى الفترة ما بين 4000-4500 سنة قبل الميلاد.[وب-إنج 3] كما عُثِرَ في جبال الألب على مومياء تعود إلى رجل الجليد أوتزي [ط 10]، والذي عاش في حقبة العصر النحاسي بين 3300 إلى 3200 قبل الميلاد، وكان معه نصل فأسٍ مصنوعٍ من النحاس بنقاوة 99.7%؛ وتشير المستويات المرتفعة من الزرنيخ في شعره إلى احتمالية عمله ومساهمته في صهر النحاس.[وب-إنج 3] ساعدت الخبرة المكتَسَبة من صهر النحاس في تطوّر تعدين فلزّات أخرى، وخاصّةً في استخراج الحديد ضمن أفران النَّوْرات [ط 11][وب-إنج 3] كما كان صهر النحاس مقدّمةً لسَبكهِ مع القصدير للحصول على البرونز، الأمر الذي كان فاتحةً لدخول العصر البرونزي.[4]
- العصر البرونزي
كان البرونز الزرنيخيّ [ط 12] أوّل أشكال البرونز التي تمكّن الإنسان من تحضيره في الألفية الخامسة قبل الميلاد،[5] إذ أنّ الزرنيخ يرافق النحاس بشكلٍ طبيعيٍّ في خاماته.[6] أمّا ممارسة سبك النحاس مع القصدير للحصول على البرونز فقد بدأت في الألفية الرابعة قبل الميلاد،[7] ثمّ تأصّلت في الاستخدام البشري لإنتاج مُستلزَمات الحياة اليومية في أواخر الألفية الثالثة قبل الميلاد. عُثرَ على قطع أثرية عمرها يتجاوز 4500 سنة تعود إلى حضارة الفينكا [ط 13]؛[4] كما عُثرَ في بلاد الرافدين وحوض النيل على قطعٍ أثريّة من النحاس والبرونز صُنعَت قرابة 3000 سنة قبل الميلاد في عهد حضارتَي سومر ومصر القديمة.[8] مَثّلَت تلك الفترة التاريخية ما يعرف باسم «العصر البرونزي»، وقد انتهت مع بداية العصر الحديدي [ط 14]، وتتفاوت مدّتها مع اختلاف الموقع الجغرافي، إذ انتهى العصر البرونزي في الشرق الأدنى في الفترة ما بين 2000-1000 سنة قبل الميلاد،[9] وفي شمال أوروبا قرابة 600 سنة قبل الميلاد.[وب-إنج 4]
- العصور القديمة المتأخرة
عَرَف اليونانيون القدماء النحاس، وكان معروفاً باسم «خالكوس» [ط 15]؛ كما مثّل النحاس سلعةً مهمّةً بالنسبة للرومان القدماء أيضاً، وكان معروفاً عندهم باسم aes Cyprium، إذ يشير مقطع aes إلى مصطلح لاتيني عام يخصّ سبائك النحاس، أمّا مقطع Cyprium فيدلّ على جزيرة قبرص، حيث كان يستخرج بشكلٍ أساسيٍّ من هناك. مع مرور الوقت بُسِّطَت الكلمة إلى Cuprum. أَمَرَ الأباطرةُ الرومان مثل يوليوس قيصر وأغسطس [ط 16] باستخدام النحاس وسبائكه مثل النحاس الأصفر في سكّ العملات المعدنية الرومانية؛ وكانت ولايات قبرص وهسبانيا [ط 17] ووسط أوروبا من أكثر المناطق التي استخرج الرومانُ النحاسَ منها.[10][11]
العصور الوسطى
ساهم العلماء في عصر الحضارة الإسلامية في دراسة النحاس وتصنيفه، وتمكّنوا من تحضير مركّباته؛ كما انتشرت المواقع والأسواق التجارية التي اشتهرت بصناعة النحاس وتجارته، مثل مدينة الإسكندرية، التي اشتهرت منذ القدم بإنتاج وتصنيع البرونز الكُورِنْثِي [ط 18].[12]
تمكّن الأمريكيّون الأصليّون من استخراج النحاس، حيث عُثِرَ على مكتَشَفاتٍ أثريّة في مواقع قريبة من متنزه الجزيرة الملكية الوطنية [ط 19] تعود إلى الفترة التاريخية الواقعة بين 800 إلى 1600 سنة للميلاد. كما تمكّن سكّان أمريكا الجنوبية الأصليون من سبك النحاس والذهب في سبيكة كانت معروفة باسم «تُمْبَاغَا» [ط 20].[13]
العصور الحديثة

كان منجم فالون [ط 21] الواقع في السويد مصدراً رئيسياً لاستخراج النحاس في أوروبا، وقد بدأ التعدين فيه منذ القرن العاشر، إلى أن توقّف العمل فيه أواخر القرن العشرين (سنة 1992). أمّنَ هذا المنجم لوحده زهاء ثُلُثَي حاجة السوق في أوروبا من النحاس في القرن السابع عشر، كما ساعد بشكلٍ كبيرٍ في تمويل حَمَلات السويد العسكرية حينها.[14] مَثّل النحاس خامةً إستراتيجيةً بالنسبة للسويد، وكان غطاءً لعُملَتِها، والتي كانت في الفترة ما بين سنتي 1644 إلى 1768 على هيئة صفيحةٍ نقديّةٍ نحاسيّةٍ [ط 22].[وب-إنج 5]

من التطبيقات الأولى للنحاس في العصر الحديث استخدامُهُ في الأشكال الأولى من التصوير المعروف باسم فنّ النقش على النحاس [ط 23] ولاحقاً في أسلوب التصوير المعروف باسم داجيرية [ط 24]، وكذلك في سكّ العملة؛ كما شاع استخدمه في إنشاء التماثيل، كما هو الحال في تمثال الحرية مثلاً، بالإضافة إلى استخدامه في إكساء سقوف وقبب العمارات،[2] وكذلك في الإنشاءات مثل الطلي [ط 25] والتغميد بالنحاس [ط 26].[وب-إنج 6] كانت منشأة تنقية الفلزّات شمالي ألمانيا [ط 27] في مدينة هامبورغ (المعروفة حالياً باسم آوروبيس [ط 28] أوّل وأكبر منشأةٍ للطلي الكهربائي [ط 29] في أوروبا، وكان الإنتاج فيها قد بدأ سنة 1876.[15]
بعد دخول عصر الكهرباء منذ أواخر القرن التاسع عشر ازداد الطلب بشكلٍ كبيرٍ على النحاس، وذلك لاستخدامه في التمديدات الكهربائية؛ وكانت الولايات المتّحدة الأمريكية من الدول الرائدة في إنتاج النحاس لتأمين حاجة السوق. مع مرور الوقت تطوّرت وسائل استخراج وإنتاج النحاس، ففي سنة 1949 تمكّنت شركة أوتوكمبو [ط 30] الفنلندية من ابتكار عملية الصهر الومضي [ط 31] المتميّزة بكفاءتها.[16] في سنة 1967 أسّست كلّ من تشيلي والبيرو وجمهورية الكونغو الديمقراطية وزامبيا المجلس بين الحكومي للدول المصدّرة للنحاس [ط 32] من أجل التحكّم بسوق النحاس، بشكلٍ مماثلٍ لما تقوم به منظّمة أوبك في سوق النفط، إلّا أنّه لم يُكتَب لهذا المجلس طول الاستمرار، إذ انحلّ في سنة 1988.[17]
الوفرة الطبيعية
يُصنّف النحاس ضمن العناصر التي تتخلّق في النجوم العملاقة.[18] أمّا في القشرة الأرضية فيوجد النحاس بنسبةٍ تصل إلى 50 جزء في المليون [ط 33]،[19] وبذلك يأتي في المرتبة الخامسة والعشرين بالنسبة للوفرة الطبيعية فيها.[19] من الممكن العثور على النحاس في بعض الأحيان بشكله الطبيعي الحرّ من غير ارتباطٍ مع عناصر كيميائيّة أخرى. يوجد النحاس الطبيعي غالباً في الحِمَم البازلتية، إمّا على هيئة قطع [ط 34] من صَبّات متكتّلة أو على شكل متفرّع، فيما يدعى باسم التغصّن البلّوري [ط 35]. تشير بعض المصادر إلى أنّ وزن أكبر كتلةٍ من النحاس الطبيعي قد بلغ 420 طن، وكان قد عثر عليها سنة 1857 في ولاية ميشيغان الأمريكية.[19] للنحاس الطبيعي بنية حُبَيبيّة بلّورية، إلّا أنّ أكبر بلّورة أحادية [ط 36] كانت قد بلغت أبعادها 4.4×3.2×3.2 سم.[20]
-
قطع كِتَليّة من النحاس الطبيعي
-
تغصُّن بلّوري للنحاس الطبيعي
-
بلّورات مكعّبة من النحاس الطبيعي
-
تشكّل زائف [ط 37] للنحاس على هيئة أراغونيت [ط 38]

ولكن على الأغلب يوجد النحاس في الطبيعة مرتبطاً مع عناصر أخرى على هيئة معادن، وخاصّةً ضمن معادن الكبريتيدات [ط 39] مثل: كالكوبيريت [ط 40]، وبورنيت [ط 41]، وديغينيت [ط 42]، وكوفيليت [ط 43]، وكالكوسيت [ط 44]؛ وكذلك ضمن معادن أملاح السلفو [ط 45] مثل تتراهدريت [ط 46] وتينانتيت [ط 47] وإينارغيت [ط 48]؛ وضمن معادن الزرنيخات [ط 49] مثل معدَنَي كورنواليت [ط 50] وكلينوكلاس [ط 51]؛ وضمن معادن الكربونات مثل معدَنَي آزوريت [ط 52] ومالاكيت [ط 53]؛ بالإضافة إلى معادن الأكاسيد مثل معدني كوبريت [ط 54] وتينوريت [ط 55]؛ ومعادن الهاليدات مثل معدن أتاكاميت [ط 56]. بلغ عدد معادن النحاس المعروفة حتّى سنة 2019م 635 معدناً؛ وأكثر المعادن احتواءً على النحاس في الخامة هما معدَنا الكوبريت (بنسبةٍ تصل إلى 88%) والألغودونيت [ط 57] (بنسبة 83.6%)، بالإضافة إلى معادن باراميلاكونيت [ط 58] والتينوريت والكالكوسيت (بنسبة تصل إلى قرابة 80%).[وب-إنج 7]
لا يتجاوز تركيز النحاس في الغلاف الجوّي مقدار 1 نانوغرام/م3؛ أمّا تركيزه في التربة فيبلغ 150 مغ/كغ؛ وفي الغطاء النباتي مقدار 30 مغ/كغ؛ أمّا في الماء العذب فيصل متوسّط تركيز النحاس مقدار 2 ميكروغرام/الليتر مقابل 0.5 ميكروغرام/الليتر في ماء البحر.[21]
الاستخراج


يُستخرَج النحاس غالباً على هيئة معادن الكبريتيدات في مناجم التعدين السطحي [ط 59] من توضّعات الصخر السمّاقي النحاسية [ط 60]. من أشهر المواقع الغنيّة بالنحاس كلّ من منجم تشوكويكاماتا [ط 61] في تشيلي؛ ومنجم وادي بينغهام [ط 62] في ولاية يوتا ومنجم تشينو [ط 63] في ولاية نيومكسيكو في الولايات المتّحدة. تحتلّ تشيلي صدارةَ دول العالم في إنتاج النحاس وفق تقديرات هيئة المساحة الجيولوجية البريطانية [ط 64] في سنة 2005، وذلك بطاقةٍ إنتاجيّة تعادل قرابة ثلث مُجمَل الإنتاج العالمي؛ تليها الولايات المتّحدة ثمّ إندونيسيا والبيرو. كما تعدّ الصين من الدول الرائدة في إنتاج النحاس؛ أمّا في أوروبا فتعدّ بولندا والبرتغال والسويد من الدول ذات الإنتاج الوفير نسبياً من النحاس.
يمكن استخراج النحاس وفق عملية تصويل في الموقع [ط 65]، وقد جرى تطبيقها مثلاً في عدّة مواقع في ولاية أريزونا الأمريكية؛ ولكنّ الكمّيّات المُستحصَلة وفق هذه الطريقة ضئيلة ومحدودة نسبياً، ولا تفي بالمتطلّبات العالمية التي هي بازديادٍ مستمرٍّ.[22] لذلك يجرى التفكير باتّباع أسلوب التعدين في قاع البحر [ط 66] للحصول على النحاس ضمن عُقَيدَات متعدّدة الفلزّات [ط 67] المتوضّعة على أعماق تصل بين 3.5 إلى 6 كيلومتر في القاع، مثلما هو الحال مع فلزّي النيكل والكوبالت. يتراوح تركيز النحاس في خاماته بمقدار 0.6% وسطيّاً، وتعدّ الخامات الكبريتيدية أكثرها جدوى من الناحية الاقتصادية للاستخراج، وخاصّةً معدَنَي الكالكوبيريت CuFeS2 والبورنيت Cu5FeS4؛ وبدرجةٍ أقلّ، معدَنَي الكوفيليت CuS والكالكوسيت Cu2S.[23] من جهةٍ أخرى، يُقدّر أن يكون وسطي تركيز النحاس في العُقَيدات متعدّدة الفلزّات قرابة 1.3%؛ وتتضمّن الطرائق المستخدَمة لاستخراج النحاس منها عملية التصويل الكبريتي [ط 68] والصهر، بالإضافة إلى عمليّات أخرى.[24][وب-إنج 8]
الاحتياطي وذروة النحاس
وفقَ تقديرات نشرَتها مجموعة دراسة النحاس العالمية [ط 69] فإنّ الاحتياطات العالميّة المُخَمَّنة بناءً على بيانات مُستحصَلة من هيئة المساحة الجيولوجية الأمريكية [ط 70] تبلغ زهاء 870 مليون طن؛ أمّا موارد النحاس المُكتَشَفَة فتبلغ 2100 مليون طن، في حين أنّ الموارد غير المُكتَشَفة من هذا الفلز فتُقَدّر بقرابة 3500 مليون طن.[وب-إنج 9] ولكن على الرغم من أنّ النحاس كان معروفاً منذ آلاف السنين، إلّا أنّ أكثر من قرابة 95% من خامات هذا الفلز تقديرياً قد استُخرجَت من الأرض وخضعت إلى عمليّات صهر ومعالجة منذ بدايات القرن العشرين؛ ولذلك السبب صِيغَ تعبير «ذروة النحاس» [ط 71].[وب-إنج 10] إلّا أنّ تلك التقديرات تتفاوت بحدّ ذاتها مع مرور السنين نظراً اختلاف النمو الاقتصادي العالمي.[25] ولكن هناك تطوّرٌ مستمرٌّ في ترسيخ مفاهيم إعادة التدوير [ط 72] من أجل تأمين موارد النحاس في العصر الحديث.[وب-إنج 10]
الإنتاج

النحاس الخام
في البداية وقبل عمليّات التسخين يُزَاد تركيز النحاس في الخامات المُستخرَجة بعد سحقها وتفتيتها، وذلك إلى تراكيز أوليّة تتراوح بين 10-15% عن طريق عمليّات التعويم الزَبَدي [ط 73] أو الرشْح الحيوي [ط 74].[26]
من الأفران الصناعيّة المُستخدَمة بشكلٍ واسعٍ في إنتاج النحاس كلٌّ من الأفران العاكسة [ط 75] وكذلك أفران الصهر الومضي منذ بدايات ثمانينيّات القرن العشرين. يؤدّي تحميص [ط 76] خامات النحاس مع السيليكا [ط 77] وفحم الكوك وفق أسلوب الصهر الومضي إلى التخلّص من الحديد على هيئة خَبَث [ط 78]؛ إذ تستغلّ هذه العملية سهولة تحوّل كبريتيدات الحديد إلى الأكاسيد الموافقة:
والتي بدورها تتفاعل مع السيليكا لتشكّل خبثاً من السيليكات [ط 79]:
يطفو الخبثُ المتشكّلُ على سطح الكتلة المُسَخَّنة ليُستَحصَل على خليطٍ كبريتيديٍّ مصهورٍ للنحاس [ط 80]، والذي يتكوّن بشكلٍ رئيسيٍّ من كبريتيد النحاس الأحادي Cu2S؛ وقد يصل تركيز النحاس فيه زهاء 70%. يُصَبّ الخليط الكبريتيديُّ المَصهور والمتوهّج في مفاعلٍ ويُسخَّن، ثمّ يُمرّر فيه تيّار من أكسجين الهواء، ممّا يؤدّي إلى تحوّل كبريتيدات النحاس إلى الأكاسيد الموافقة:[23]
كما يُضمَنُ في هذه الخطوة التخلّص من باقي الحديد الموجود في الوسط على هيئة خبث. في الخطوة التالية يُفاعَل الباقي من كبريتيد النحاس الأحادي مع أكسيد النحاس الثنائي للحصول على النحاس الخام:
نسبة النحاس في النحاس الخام قرابة 98%، وتحوي النسبة المتبقيّة على شوائبٍ من الحديد والزنك، بالإضافة إلى فلزّاتٍ نبيلةٍ من الذهب والفضّة والبلاتين.
وسائل أخرى
يمكن الحصول على النحاس وفق تفاعل ألومنيوم حراري [ط 81] بين أكسيد النحاس الثنائي مع مسحوق الألومنيوم باستخدام فلوريد الكالسيوم على هيئة صُهَارة [ط 82]. كما يوجد هناك أيضاً أسلوبٌ آخرٌ تاريخي وقديم للحصول على النحاس من خاماته، وذلك وفق عمليّة التَمْليط [ط 83]، وهي عمليّة تتضمّن ترسيب النحاس من مُفاعَلة كبريتات النحاس الثنائي مع الحديد، لكنّ النحاس المُستَحصل وفق هذه العملية غير نقيّ. كان هذا الأسلوب شائعَاً للحصول على النحاس في الصين قبل قرابة ألف سنة.[27]
التنقية
يُنقَّى النحاس عادةً بأسلوب الاستخلاص الكهربائي [ط 84]؛ إذ يُوضَع النحاس الخام في خلية تحليل على المِصعد [ط 85]؛ مقابل قطعٍ من النحاس مرتفع النقاوة على المهبَط [ط 86] بوجود كهرل [ط 87] مؤلّف من محلول كبريتات النحاس الثنائي في حمض الكبريتيك. عند تطبيق جهدٍ كهربائيٍّ ملائمٍ تتأكسدُ كافّةُ شوائب الفلزّات الوضيعة الموجودة ضمن قطعة النحاس الخام وتنتقل على هيئة أيونات موجبة الشحنة (كاتيونات) إلى المحلول، في حين أنّ الشوائب من الفلزّات النبيلة تترسّب على هيئة وحلٍ مِصعَدِيّ [ط 88]، والذي يخضع بدوره إلى معالجات لاحقة.

- المصعد
- المهبط

وبتلك العملية تنحلّ قطعة النحاس الخام الموجودة على المصعد تدريجياً، في حين تترسّب أيونات النحاس على المهبط، بحيث يُحصَل في النهاية على نحاسٍ ذي درجة نقاوة تصل إلى 99.99%.
إعادة التدوير
إنّ النحاس قابلٌ لإعادة التدوير مثله مثل الألومنيوم؛ وبذلك يُستَحصل على نحاسٍ بجودةٍ جيّدةٍ تعادل ما يُستحصَل من الخامات الأرضية.[28] يأتي النحاس في المرتبة الثالثة من بين الفلزّات المُدَوَّرة بعد الحديد والألومنيوم؛ ويُقدّر أنّ 80% من النحاس المُستخرَج على الإطلاق لا يزال مُستخدَماً حتى الآن نتيجة عمليّات التدوير.[وب-إنج 11] وفقاً لتقريرٍ من الهيئة الدولية للموارد الطبيعية [ط 89] فإنّ الاستهلاك العالمي من النحاس في المجتمع يتراوح بين 35-55 كغ لكلّ نسمة، وهو يرتفع في الدول المتقدّمة ليصل إلى مجالٍ بين 140-300 كغ لكلّ نسمة. لا تختلف عمليّة إعادة تدوير النحاس كثيراً عن إنتاجه من خاماته، ولكنّها تتطلّب خطواتٍ أقلّ، إذ تُصهَرُ خردة النحاس مرتفع النقاوة في فرنٍ مخصّصٍ للصناعات المعدنية [ط 90]، ثمّ يخضع المصهور لتفاعلات أكسدة واختزال، ثم يُصَبّ على هيئة منتجاتٍ نصف مصنّعة مثل الكتل الخام [ط 91] أو الصَّبَّات [ط 92]؛ في حين أنّ الخردة منخفضة النقاوة تُذاب في حمض الكبريتيك، ثم تخضع إلى عملية تنقيةٍ كهربائية.[وب-إنج 12]
النظائر
يبلغ عدد نظائر النحاس تسعةً وعشرون نظيراً، منها نظيران مستقرّان، وهما نحاس-63 63Cu ونحاس-65 65Cu، ويؤلّف النظير 63Cu زهاء 69% من النحاس في الطبيعة، ولكلٍّ من النظِيرَين المذكورَين لفٌّ مغزليّ [ط 93] مقداره 3⁄2.[29] أمّا سائر النظائر فهي نظائر مشعّة، وأكثرها استقراراً هو النظير المشعّ نحاس-67 67Cu بعمر نصفٍ [ط 94] مقداره 61.83 ساعة.[29]
يوجد سبعة مصاوغات نوويّة [ط 95] معروفة للنحاس، وهي شبه مستقرّة [ط 96]، وأكثرها استقراراً هو 68mCu بعمر نصف 3.8 دقيقة. تضمحلّ نظائر النحاس ذات العدد الكتلي الأكبر من 64 وفق نمط اضمحلال بيتا [ط 97]؛ أمّا النظائر ذات العدد الكتلي الأقلّ من 64 فتضمحلّ وفق نمط انبعاث البوزيترون [ط 98]؛ مع العلم أنّ النظير نحاس-64، بعمر نصف مقداره 12.7 ساعة، يضمحلّ وفق النّمطَين المذكورَين سابقاً.[وب-إنج 13] يُستخدَم النظير نحاس-62 62Cu على هيئة قائفة مشعّة [ط 99] في تقنية التصوير المقطعي بالإصدار البوزيتروني [ط 100].[30]
الخواص الفيزيائية

يوجد النحاس في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلزٍّ ذي لون برتقاليٍّ مزهرٍّ، وعند التعرّض الطويل للهواء فإنّه يفقد لمعانه ويأخذ درجة لون بُنّيّةٍ مُحمَرّة، في حين أنّ مَخدَشَهُ [ط 101] ذو لونٍ أحمر مزهرّ. للنحاس عموماً لون خاصّ ومميّز، إذ يُنسَب إليه اللون النحاسي؛ وهو بذلك واحد من بضعة عناصر فلزّية ذات لون مغاير للون الرمادي أو الفضّي النمطي لأغلب الفلزّات.[31]
يقع النحاس في الجدول الدوري للعناصر في المجموعة الحادية عشرة إلى جانب الذهب والفضّة؛ وهي تعرف باسم فلزّات النقود [ط 102]، وتتميّز تلك الفلزات بقابليتها الكبيرة للسحب والطرق، كما تتميّز بمواصفاتها الجيّدة فيما يخصّ الناقلية الحرارية والموصلية الكهربائية. يعود السبب في تلك الخواص الفيزيائية المميّزة إلى البنية الذرّية لهذه العناصر؛ فالتوزيع الإلكتروني [ط 103] فيها متناظر، إذ يوجد فيه إلكترون تكافؤ وحيد في المدار s خارج غلاف تكافؤ ممتلئ في المدار d. ويؤدّي امتلاء الغلاف الإلكتروني d بالإلكترونات فيها إلى انخفاض مساهمة تلك الإلكترونات في التآثرات بين الذرّية [ط 104]، والتي تقوم بها الإلكترونات في الغلاف الإلكتروني s، وتكون على هيئة رابطة فلزّية. لكن تلك الرابطة الفلزّية في فلزّات النقود ضعيفة بالمقارنة مع الفلزّات الأخرى التي يكون فيها الغلاف الإلكتروني d غير ممتلئ؛ وذلك ما يفسّر انخفاضَ الصلادة لدى النحاس، وقابليتَه الكبيرة للسحب والطرق.[32]

يتميّز النحاس بناقليّته ومُوصِليَّته الممتازة، إذ يأتي في المرتبة الثانية بعد الفضّة وقبل الذهب من حيث الناقلية الحرارية والكهربائية من بين الفلزّات النقيّة عند درجة حرارة الغرفة. يعود السبب في ذلك بأنّ مقاومة الإلكترونات للانتقال في الفلزّات عند درجة حرارة الغرفة عائدٌ بشكلٍ أساسيٍّ إلى تبعثر وتشتّت [ط 108] الإلكترونات نتيجة الاهتزازات الحرارية [ط 109] للشبكة البلّورية، والتي عادةً ما تكون ضعيفةً في الفلزّات الطريّة.[32] يتميّز النحاس بأنّه موصلٌ جيّدٌ للكهرباء، إذ تبلغ قيمة الموصلية الكهربائية مقدار 59.6×106 سيمنز/متر. في حين تبلغ كثافة التيّار [ط 110] العظمى للنحاس في الهواء الطلق قرابة 3.1×106 أمبير/متر2؛ وعند قِيمٍ أعلى من ذلك يبدأ الفلزّ بالتسخّن بشكلٍ مطّردٍ.[33] يؤثّر وجود بعض الشوائب مثل الفوسفور أو الحديد على ناقلية النحاس ويضعّفُها؛ كما قد يخضع النحاس عند تماسه مع فلزّات أخرى إلى التآكل الجلفاني [ط 111].[وب-إنج 14]
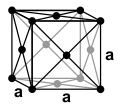
تبلغ كثافة النحاس مقدار 8920 كغ/م³، وبذلك ينتمي تصنيفياً إلى الفلزّات الثقيلة. يتبلور النحاس وفق نظامٍ بلّوري مكعّب مركزيّ الوجه [ط 112]، بالتالي يكون للذرّات المقدرة على تعبئة الفراغات بشكلٍ متراصٍّ [ط 113]، وتكون فيها الزمرة الفراغية [ط 114] من النمط Fm3m. أمّا قيمة ثابت الشبكة البلّورية [ط 115] a فيبلغ 3.615 أنغستروم (Å)، وذلك يوافق وجود أربع وحدات صيغة [ط 116] لكلّ وحدة خليّة [ط 117].[ألم 1]
الخواص الهندسية
تبلغ نقطة انصهار النحاس 1083.4 °س؛ ويمكن أن تبدأ عمليات التطريق الحرارية عند درجات حرارة تقع في مجالٍ بين 700-800 °س. تقع صلادة النحاس على مقياس موس [ط 118] ما بين 2.5 إلى 3، وهي توافق قيمة ما بين 77–99 وفق اختبار فيكرز للصلادة [ط 119]. يؤدّي التصلّد الانفعالي [ط 120] عن طريق التسبّب بحدوث عيوب بلّورية [ط 121] في الشبكة البلّورية [ط 122]، مثل الحدود الحُبَيبيّة [ط 123]، إلى إعاقة انسحاب المواد عند تطبيق جهدٍ ميكانيكي، ممّا يزيد من الصلادة. لهذا السبب فإنّه عادةً ما يُزَوّد النحاس تجارياً على هيئة حُبَيبَات بلّورية، والتي تتميّز بأنها ذات متانة أعلى من الشكل البلّوري الأحادي [ط 124].[34]

السبائك

يستطيع النحاس أن يشكّل عدداً كبيراً من السبائك مع العناصر الكيميائية الأخرى، والذي يتجاوز عددها 400 سبيكة.[وب-ألم 1] ولسبائك النحاس خواصٌ مميّزةٌ من حيث اللون ومقاومة التآكل وسهولة التشغيل الآلي، لذلك تدخل في العديد من التطبيقات العمليّة. من أقدم تلك السبائك وأشهرها سبيكة النحاس مع الزنك، والتي تعرف باسم النحاس الأصفر (أو الصُّفْر) [ط 126]؛ وكذلك سبيكة النحاس مع القصدير المعروفة باسم البرونز. مع مرور الزمن توسّع استخدام كلمة «برونز» للإشارة إلى سبيكة النحاس مع عناصر أخرى، مثلما هو الحال مع الزرنيخ أو الفوسفور أو الألومنيوم؛ ويُستخدَم برونز الألومنيوم بشكل واسع في مجال التزيين من أجل إضفاء لونٍ ذهبيّ.[19]
يُدمَجُ النحاس بشكلٍ شائعٍ في سبائك الفضّة والذهب، وخاصّةً في صياغة الحلي والمجوهرات، إذ يساهم في التحكّم بالعيار ودرجة اللون ونقطة انصهار السبيكة المرجوّة.[وب-إنج 15] يكثر في اليابان استخدام سبيكة «شاكودو» [ط 127] لأغراض التزيين، وهي مؤلّفة بشكل سائدٍ من النحاس مع نسبة تتراوح بين 4-10% من الذهب.[35] من جهةٍ أخرى، تُعرَف سبيكة «الذهب النوردي» [ط 128]، والخالية عمليّاً من الذهب، إذ تتكوّن بأغلبيتها من النحاس (89%)، بالإضافة إلى وجود نسبة قياسية من عناصر أخرى تتضمن 5% ألومنيوم و5% زنك و1% قصدير؛ وهي مستخدمةٌ في سكّ قطعة 50 سنت في منطقة اليورو.
يشكّل النحاس عدداً من السبائك مع النيكل؛ إذ تدعى سبيكة النحاس الحاوية على نسبة (60-90%) مع النيكل باسم النيكل النحاسي [ط 129]، وهي مستخدمةٌ بشكلٍ واسعٍ في سكّ النقود المعدنية؛[36] والتي حلّت محلّ النقود المعدنية التي كان يدخل الفضّة بشكلٍ واسعٍ في تركيبها.[وب-إنج 16] تتميّز سبيكةٌ مؤلّفةٌ من 90% نحاس و10% نيكل بخواصها الفريدة المقاومة للتآكل، ويوجد لها عددٌ معتبرٌ من التطبيقات، وخاصّةً في المجالات التي تكون فيها الأجسام على تماسٍ مع ماء البحر.[37] من السبائك المعروفة أيضاً للنحاس مع النيكل سبيكة فضّة النيكل [ط 130]، ويكون التركيب النمطي لها على الشكل: 47-64% نحاس و10-25% نيكل و15-42% زنك، مع إمكانية إدخال شوائبٍ من عناصر أخرى.[ألم 2]
الخواص الكيميائية


لا يتفاعل النحاس مع الماء، لكنه يتفاعل ببطءٍ مع أكسجين الهواء في تفاعل أكسدة مشكّلاً طبقةً بنّيّةً إلى سوداء اللون على السطح من أكسيد النحاس، والتي تقوم على العكس مما هو الحال في الصدأ في الحديد، بحماية باقي كتلة الجسم النحاسي من التآكل، وبذلك تقوم تلك الطبقة بدورٍ مخمّل [ط 132]. تتشكّل على الأسطح النحاسيّة المتعرّضة لوقت طويل إلى الهواء طبقةٌ خضراء من الزنجار [ط 133]، وهي مادّةٌ تتألّف كيميائياً من كربونات النحاس القاعدية، وتُسمّى صدأ النحاس [ط 134] وتلاحظ عادةً على أسطح المباني القديمة المكسوّة بالنحاس؛[2] أو التماثيل المصنوعة من النحاس وسبائكه، كما هو الحال في تمثال الحرية [ط 135].[وب-إنج 17] يفقد النحاس لمعانَه عند تعرّضه إلى بعض المركّبات الكبريتية، والذي يتفاعل معها على السطح مشكّلاً عدداً من مركّبات كبريتيد النحاس المختلفة.[38]
لا يُهاجَم النحاس في الشروط العادية من حمض الهيدروكلوريك؛[وب-ألم 2] ولكن بوجود شروطٍ مؤكسدةٍ فإنّ النحاس يصبح عرضةً للهجوم من الأحماض، فهو ينحلّ مثلاً في حمض الكبريتيك الساخن، كما ينحلّ أيضاً في حمض النتريك،[وب-ألم 3] والماء الملكي.[ألم 3] يستطيع مزيجٌ من بيروكسيد الهيدروجين (الماء الأكسجيني) مع حمض الهيدروكلوريك أو حمض الكبريتيك أن يذيبَ النحاس بشكلٍ سريع. يمكن للأحماض العضوية المركّزة أن تهاجم النحاس أيضاً؛ ولكن بالمقابل فإنّه ثابتٌ تجاه المحاليل القلوية. عند توهّج النحاس لدرجة الاحمرار يتفاعل النحاس مع الأكسجين ويشكّل طبقةً من أكسيد النحاس الأحادي؛ من جهةٍ أخرى، يؤدّي تعرّض النحاس إلى الهيدروجين أثناء المعالَجات الحرارية إلى حدوث تقصّف هيدروجينيّ [ط 136].
المركبات الكيميائية
| حالات أكسدة النحاس المختلفة وأمثلةٌ من المركّبات الكيميائية عليها | |
|---|---|
| +1 | CuCl، Cu2O، CuH، Cu2C2 |
| +2 | CuCl2، CuO، CuSO4 |
| +3 | KCuO2، K3CuF6 |
| +4 | Cs2CuF6 |
يمكن أن يوجد النحاس بعدّة حالات أكسدة (وهي 0 و +1 و +2 و +3 و+4) في مركّباته الكيميائية؛ وأكثرُها شيوعاً هما حالَتا الأكسدة +1 و +2؛ أمّا الأكثر استقراراً في المحاليل المائية فهي حالة الأكسدة +2؛ من جهةٍ أخرى، فإنّ حالة الأكسدة +4 نادرةٌ جدّاً، ولا تصادَف إلّا في البعض القليل من المركّبات الكيميائية، مثلما هو الحال في سداسي فلوريد النحاس والسيزيوم Cs2CuF6. قياساً على عناصر أخرى تدعى أحياناً المركّبات الحاوية على النحاس في حالة الأكسدة +1 باسم مركّبات النحاسوز [ط 137]، أمّا المركّبات الحاوية على النحاس في حالة الأكسدة +2 فتدعى باسم مركّبات النحاسيك [ط 138]. النحاس قادرٌ أيضاً على تشكيل معقّدات تناسقية [ط 139] وكذلك مركّبات عضوية فلزّية [ط 140]، والتي توجد لها تطبيقات عملية وحيوية مهمّة.[39]

اللاعضوية
- الأكاسيد والهيدروكسيد
للنحاس أكسيدان معروفان، وهما أكسيد النحاس الأحادي (أكسيد النحاسوز) وأكسيد النحاس الثنائي (أكسيد النحاسيك)، ولهما العديد من التطبيقات المعروفة. يوجد أكسيد النحاس الأحادي Cu2O على هيئة صلبٍ أحمر ذي نظام بلّوري مكعّب؛[40] بالمقابل، فإنّ أكسيد النحاس الثنائي CuO هو مسحوقٌ أسود يوجد في بعض الأحيان على هيئة مادّة لابلّورية [ط 141]، وفي أحيان أخرى على هيئة صلبٍ وفق نظام بلّوري أحادي الميل [ط 142].[40]
أمّا هيدروكسيد النحاس الثنائي Cu(OH)2، فهو صلب ذو لون أخضر مزرقّ، ويُستخدَم في تطبيقاتٍ عديدةٍ مثل الخُضُب وفي صباغة الخشب [ط 143] وفي تحضير مبيدات الفطريات.[2]
- الهاليدات
تعدّ هاليدات النحاس الأحادي والثنائي من المركّبات المعروفة، سواءٌ منها للنحاس الأحادي (من الفلوريد CuF، والكلوريد CuCl، والبروميد CuBr ويوديد النحاس الأحادي CuI) أو النحاس الثنائي (من الفلوريد CuF2 والكلوريد CuCl2 والبروميد CuBr2)، ما عدا يوديد النحاس الثنائي، إذ تؤدّي المحاولات لتحضير هذا المركّب إلى الحصول على يوديد النحاس الأحادي CuI وعنصر اليود:

يختلف لون هاليدات النحاس بوجود ماء التبلور في البنية البلّورية؛ فعلى سبيل المثال، يوجد مركّب كلوريد النحاس الثنائي CuCl2 في الحالة النقيّة على هيئة مسحوق بلّوري بنّي، أمّا المركّب ثنائي الهيدرات CuCl2.2H2O فيوجد على هيئة بلّورات ذات لون أخضر مزرقّ. أمّا العيّنات النقية من مركّب كلوريد النحاس الأحادي CuCl فهي على هيئة صلب بلّوري عديم اللون، في حين أنّه في الشروط العادية تكون مشابةً بكلوريد النحاس الثنائي نتيجة أثر الأكسدة، ولذلك تبدو على هيئة مسحوق أخضر اللون.[40]
- أملاح أخرى
يعدّ مركّب كبريتات النحاس الثنائي CuSO4 من المركّبات الكيميائية المعروفة، ويوجد في العادة بالشكل المائي خماسي هيدرات CuSO4.5H2O على هيئة بلّورات زرقاء داكنة، وهو يدعى في كتب التاريخ الكيميائية العربية باسم «الزاج الأزرق». يوجد هذا المركّب في الطبيعة في معدَنَي الكلكنتيت [ط 144] والبوثيت [ط 145]. لكبريتات النحاس عددٌ واسع من التطبيقات العملية.[2]
يوجد عددٌ من المركّبات اللاعضوية الأخرى للنحاس، من ضمنها كبريتيد النحاس الأحادي Cu2S والثنائي CuS؛ وكذلك أملاح النترات Cu(NO3)2 والفوسفات Cu3(PO4)2، بالإضافة إلى أملاح السيانيد CuCN والهيدريد CuH.
- حالات الأكسدة غير الشائعة
تعدّ حالتا الأكسدة +3 و+4 نادرَتين بالنسبة لهذا العنصر الكيميائي. تصادَف حالة الأكسدة الثلاثية للنحاس غالباً في الأكاسيد، ومن أبسط الأمثلة عليها أملاح النحاسات (كوبرات [ط 146] مثل نحاسات البوتاسيوم KCuO2، وهو مركّب صلبٌ ذو لون أزرق مسودّ.[41] تحوي مركّبات أكسيد النحاس والباريوم والإتريوم [ط 147] YBa2Cu3O7 على مراكز من النحاس الثنائي والثلاثي، وهي من المواد المتميّزة بأنّها ذات توصيل فائق عند درجات حرارة مرتفعة [ط 148].[42] كما هو الحال مع الأكاسيد، فإنّ مركّبات الفلوريد قادرةٌ على تثبيت الأيونات في حالات الأكسدة المرتفعة، مثلما هو الحال في النحاس الثلاثي في مركّب سداسي فلورو نحاسات البوتاسيوم [ط 149] K3CuF6 وفي النحاس الرباعي في مركّب سداسي فلورو نحاسات السيزيوم [ط 150].
تستطيع بعض البروتينات النحاسية أن تشكّل معقّدات أوكسو [ط 151]، والتي تحوي على النحاس الثلاثي فيها؛[43] من جهةٍ أخرى، يعود استقرار معقّدات النحاس الثلاثي بواسطة رباعيات الببتيد [ط 152] إلى التآثر مع الربيطات الأميدية منزوعة البروتونات [ط 153].[44]
المعقدات التناسقية
إنّ النحاس قادرٌ مثلَهُ مثلَ باقي الفلزّات الانتقالية على تشكيل معقّدات تناسقية مع رُبَيطات [ط 155] متنوّعة. في المحاليل المائية يوجد النحاس الثنائي على هيئة أيون سداسي الهيدرات 2+[Cu(H2O)6]، ويبدي هذا المعقّد أسرع معدّل استبدال للربيطات لأيّ معقّد مائي [ط 156] من بين الفلزّات الانتقالية.
تؤدّي إضافة أنيونات الهيدروكسيد إلى الوسط إلى ترسّب [ط 157] صلبٍ أزرق من هيدروكسيد النحاس الثنائي

وذلك الأمر يحدث بدايةً عند إضافة هيدروكسيد الأمونيوم، إلّا أنّ إضافةَ كمّيّات فائضةٍ منه إلى الوسط يؤدّي إلى انحلال الراسب مشكّلاً معقّداً أمينياً [ط 158] من هيدروكسيد رباعي أمين ثنائي ماءات النحاس الثنائي 2(OH) [Cu(NH3)4(H2O)2]، والمعروف باسم «كاشف شفايتزر» [ط 159]. تشكّل العديد من الأنيونات الأكسجينية [ط 160] الأخرى معقّدات مائية، وتلك تتضمّن أسيتات النحاس الثنائي Cu(CH3COO)2 ونترات النحاس الثنائي Cu(NO3)2 وكربونات النحاس الثنائي CuCO3. أما كبريتات النحاس الثنائي CuSO4 فيوجد على شكل مائي خماسي الهيدرات، ويكثر استخدامه مبيداً للفطريات [ط 161] ضمن مزيج بوردو [ط 162].
تستطيع مركّبات البوليول [ط 163] الحاوية على مجموعات متعدّدة من مجموعات الكحول الوظيفية أن تتآثر مع أملاح النحاس الثنائي، وتستخدَم لذلك الغرض من أجل اختبار السكّريات المُختَزِلة [ط 164]، إذ يعتمدُ كاشف بندكت [ط 165] ومحلول فهلنغ [ط 166] على وجود أيونات النحاس الثنائي الزرقاء التي تتعرّض إلى تحوّل لوني نتيجة حدوث تفاعل اختزال إلى أكسيد النحاس الأحادي الأحمر. يستطيع كاشف شفايتزر والمعقّدات التناسقية المتعلّقة مع ثنائي أمين الإيثيلين [ط 167] والأمينات الأخرى أن تذيب السليولوز.[45] تستطيع الأحماض الأمينية أن تشكّل معقّدات مُتَمَخْلِبة [ط 168] شديدة الاستقرار مع النحاس الثنائي.[46][47][48]
المركبات العضوية
تُعرّف المركّبات الحاوية على رابطة كيميائية بين النحاس والكربون باسم مركّبات النحاس العضوية؛ وتُصطَنع من مفاعلة مركّبات النحاس الأحادي إمّا مع كاشف غرينيار [ط 169] أو الألكاينات الطرفية [ط 170] أو مركّبات الليثيوم العضوية؛ وفقاً للتفاعل الأخير المذكور يمكن الحصول على كاشف جلمان [ط 171]. يمكن لمركّبات النحاس العضوية أن تخضع إلى تفاعل استبدال [ط 172] مع هاليدات الألكيل لتشكّل نواتج تفاعل ازدواج، وتلك خطوةٌ مهمّةٌ في مجال الاصطناع العضوي. رغم ارتفاع الحساسية للصدمة، ولكن يُستعَان بمركّب أسيتيليد النحاس الأحادي في تفاعلات كيمياء النحاس العضوية، مثل ازدواج كاديوت-خودكيفيتش [ط 173]؛[49] وازدواج سونوغاشيرا [ط 174].[50] تساهم مركّبات النحاس العضوية أيضاً في إنجاز تفاعلات إضافة مترافقة محبّة للنوى [ط 175] إلى مركّبات كربونيل ألفا وبيتّا غير المُشبَعة [ط 176] (إينونات [ط 177])؛[51] وفي إنجاز تفاعلات إضافة الكربون الفلزّية [ط 178] للنحاس [ط 179] إلى الألكاينات.[52] يستطيع النحاس الأحادي أن يشكّل العديدَ من المعقّدات الضعيفة مع الألكينات وأحادي أكسيد الكربون، خاصّةً عند وجود الرُّبَيطات الأمينية.[53]

التحليل الكيميائي
يعطي اختبار اللهب التقليدي للكشف عن أيونات النحاس لوناً بين الأزرق إلى الأزرق المخضرّ، وذلك في مجال اللهب المؤكسِد، أمّا في مجال اللهب المختَزِِل فلا يعطي الاختبار نتيجةً واضحةً وذلك لأنّ اللون الناتج الأحمر أو الأحمر البنّي قريب من لون اللهب. وفق التحليل النوعي بالوسائل التحليليّة التقليديّة فإنّ النحاس يندرج ضمن قائمة الكاتيونات التي يمكن فصلها عن الوسط باستخدام كبريتيد الهيدروجين H2S على هيئة كبريتيد النحاس، ويُكشَف عن النحاس بواسطة تشكيل معقّد رباعي أمين النحاس (كاشف شفايتزر). من جهةٍ أخرى، يستطيع محلول فرّوسيانيد البوتاسيوم أن يرسّب أيونات النحاس الثنائي على شكل سداسي سيانوفرّات النحاس الثنائي Cu2[Fe(CN)6]، وهذا التفاعل حسّاسٌ بالقدر الكافي للكشف عن كمّيّات ضئيلةٍ من أيونات النحاس.
بالنسبة للتحليل الكمّي للنحاس فذاك يُنجَز وفق أسلوب التحليل الوزني الكهربائي [ط 180] باستخدام أقطاب كهربائية من لبلاتين في محلولٍ من أيونات النحاس الثنائي المُحَمَّضة بحمض الكبريتيك. كما يمكن إجراء معايرة يودية [ط 181] أو معايرة تشكّل المعقّدات [ط 182] باستخدام الموركسيد [ط 183] مؤشّراً كيميائيّاً لونيّاً. للكشف عن آثار نزرةٍ من النحاس تُستخدَم تقنيّات التحليل الآلي مثل قياس الاستقطابية [ط 184] أو المطيافية الذرّية [ط 185] أو مطيافية كتلة مزوّدة ببلازما مقترنة بالحثّ [ط 186]؛ أو باستخدام تقنية القياس الفولتي [ط 187].[ألم 4]
الدور الحيوي
للنحاس دورٌ حيويٌّ مهمٌّ لعددٍ معتبرٍ من الكائنات الحيّة؛ وهو يعدّ بالنسبة للإنسان من العناصر المهمّ وجودها في الغذاء، وهو يتركّز في الكبد والعضلات والعظام؛[وب-إنج 18] بحيث أنّ جسم الإنسان يحوي وسطياً على كمّيّة تتراوح بين 1.4 إلى 2.1 ميليغرام لكل كيلوغرام من وزن الجسم.[وب-إنج 19]
الكيمياء الحيوية

بدأت الأهميّة الحيوية للنحاس مع ظهور الأكسجين في غلاف الأرض الجوّي؛[54] فالنحاس أساسيٌّ وضروريٌّ في عمليّات التنفّس الخلويّ لدى جميع حقيقيّات النوى [ط 189]؛ إذ يوجد في الميتوكندريون (متقدّرات) [ط 190] في إنزيم سيتوكروم سي أكسيداز [ط 191]، والذي يمثّل البروتين الأخير في حلقة الفسفرة التأكسدية [ط 192]. يريط الإنزيم المذكور جزيء أكسجين بين ذرّتي نحاس وحديد، وينقل البروتين ثمانية إلكترونات إلى جزيء الأكسجين، فيحدث تفاعل أكسدة واختزال وينتج جزيئان من الماء. تقوم البروتينات النحاسيّة [ط 193] بدورٍ مهمٍّ في عمليّات انتقال الإلكترون الحيوية، وذلك عبر ضبط وتنسيق عمليّات سلسلة نقل الإلكترون الحيوية؛ وفي عمليّات نقل الأكسجين، وتلك عمليّات تستغلّ تغيّر حالة الأكسدة السهل نسبياً بين النحاس الأحادي والثنائي.[55]
يوجد النحاس أيضاً في العديد من إنزيمات سوبر أكسيد ديسميوتاز [ط 194]، وهي بروتينات تحفّز تفكّك وتحلّل مركّبات فوق الأكاسيد [ط 195] بتحويلها وفق تفاعل عدم تناسب [ط 196] إلى أكسجين وبيروكسيد الهيدروجين؛ كما يوجد في إنزيم مختزلة أكسيد النتروز [ط 197].[56]
يحمل بروتين هيموسيانين [ط 198] الأكسجين في بعض الكائنات الحيّة، وتتضمّن أغلب الرخويات وبعض مفصليات الأرجل مثل سرطان حدوة الحصان. نظراً لكون الهيموسيانين ذا لون أزرق، فإنّ لتلك الكائنات الحيّة دماً أزرق اللون، على العكس من أغلب الكائنات الأخرى ذات لون الدمّ الأحمر، التي ينقل فيها بروتين هيموغلوبين المعتمد على الحديد الأكسجين في الدم. ترتبط إنزيمات اللاكاز [ط 199] والتايروسيناز [ط 200] بنيوياً بالهيموسيانين؛ ولكنها تقوم عوضاً عن الارتباط العكوس بالأكسجين بإجراء عمليّة إضافة هيدروكسيل (هدرلة [ط 201]) للركيزة، ويتمثّل ذلك الدور في تشكّل طلاء اللك الطبيعي.
الدور المضاد للميكروبات
يعدّ النحاس ذا تأثير سمّيٍّ بالنسبة لبعض الكائنات الحيّة الدقيقة من الجراثيم والميكروبات، حتّى بتراكيز ضئيلة.[57] ووجدت دراسة أنّ الأسطح المصنوعة من النحاس تقضي على 63% من جراثيم المكوّرة العنقودية الذهبية [ط 202]؛ ممّا دفع بعض العيادات والمشافي إلى تجربة صناعة مقابض الأبواب من النحاس وسبائكه.[وب-ألم 4] بيّنت التجارب أنّ التماس المباشر بين النحاس والميكروبات يؤدّي إلى الإضرار بغلافها الخلوي، ممّا يضعّفها تجاه العوامل المطهّرة الأخرى؛ إذ أنّ أيونات النحاس ذات إلفة كبيرة إلى مجموعات الثيول الطرفية الموجودة في البروتينات الغشائية للميكروبات فترتبط معها وتعطّل عملها، كما تقوم أيونات النحاس أيضاً بأكسدة الليبيدات في الغشاء الخلوي، ممّا يؤدّي إلى إطلاق جذور كيميائية حرّة تساهم في تخريب جزيئات الحمض النووي الريبوزي منقوص الأكسجين لتلك الميكروبات.[58]
التغذية والصحة

من الضروري أن يحوي غذاء الإنسان على النحاس، حتّى بتراكيز ضئيلة، لذا فهو من المغذّيات الضرورية؛ ويحتاج الإنسان وسطياً إلى ما يقارب 2 ميليغرام من النحاس لكل كيلوغرام من وزن الجسم.[وب-إنج 20] يُعثَر على النحاس في أصنافٍ مختلفة من الغذاء مثل الحبوب واللحوم والخضراوات الجذرية، والبقول والمكسّرات.[وب-ألم 5]
الامتصاص
يُمتصّ النحاس في جسم الإنسان في الأمعاء، ثم يُنقَل إلى الكبد مرتبطاً مع الألبومين [ط 203].[59] ومن الكبد يتوزّع النحاس إلى الأنسجة الأخرى في مرحلةٍ لاحقةٍ، والتي يقوم فيها بروتين السيرولوبلازمين [ط 204] بحمل ذرّات النحاس في بلازما الدم.[60][61] يخضع النحاس في الجسم عادةً إلى دورة معوية كبدية [ط 205]، ويكون الجسم قادراً على طرح الفائض منه، وأحياناً عبر العصارة الصفراوية.[62][63]
التوصيات الغذائية
حدَّثت الأكاديمية الوطنية للطبّ [ط 206] في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) [ط 207] معدّل الحاجة التقريبي [ط 208] والكمّيّات المُوصى بتناولها [ط 209] من النحاس في سنة 2001.[64] وفي حال عدم توفّر بيانات كافية من أجل تحديد الكمّيّات المذكورة عمدت الأكاديمية إلى وضع قيم المدخول الكافي [ط 210] عوضاً عن ذلك، وذلك على الشكل التالي: مقدار 200 ميكروغرام من النحاس للأطفال من عمر 0-6 أشهر بالنسبة للذكور والإناث؛ وبمقدار 220 ميكروغرام من النحاس للأطفال من عمر 7-12 شهر بالنسبة للذكور والإناث.[64] بالنسبة لكلا الجنسين كانت الكمّيّات المُوصى بتناولها من النحاس على الشكل: مقدار 340 ميكروغرام للأطفال بين عمر 1-3 سنة؛ وبمقدار 440 ميكروغرام للأطفال بين عمر 4-8 سنة؛ وبمقدار 700 ميكروغرام للأطفال بين عمر 9-13 سنة؛ وبمقدار 890 ميكروغرام للناشئة بين عمر 14–18 سنة؛ وبمقدار 900 ميكروغرام للبالغين؛ وبمقدار 1000 ميكروغرام بالنسبة للحوامل، وبمقدار 1300 ميكروغرام للمرضعات.[وب-إنج 21] ومن أجل السلامة حُدِّدَ المستوى الأقصى المقبول [ط 211] بالنسبة للنحاس بمقدار 10 ميليغرام في اليوم.[64]
وضعت الهيئة الأوروبية لسلامة الأغذية [ط 212] مقادير ضابطة مقاربة، ولكنها أعلى نسبياً لما هو متّبع في الولايات المتّحدة. فبالنسبة للبالغين حُدِّدَت قيم المدخول الكافي بمقدار 1.3 و1.6 ميليغرام في اليوم بالنسبة للنساء والرجال على الترتيب؛ في حين أنّها بالنسبة للحوامل والمرضعات بمقدار 1.5 ميليغرام في اليوم؛ أمّا بالنسبة للأطفال والناشئة من عمر 1-17 سنة فتزداد القيم بشكل تدريجي من 0.7 إلى 1.3 ميليغرام في اليوم.[وب-إنج 22]
النقص
يؤدّي عدم حصول الجسم على المدخولات الكافية من النحاس إلى حدوث حالة نقص النحاس [ط 213]، ولكنّها حالة نادرة الحدوث، وقد تظهر بسبب مرض مينكيس [ط 214]؛[65][66] وكذلك عند حدوث حالات إسهال شديدة مطوّلة، أو عند الأطفال الخُدَّج، أو في حالات سوء التغذية والجوع الشديد أو بسبب سوء الامتصاص المرافق لحالات مرضيّة أخرى، مثل الداء البطني أو داء كرون [ط 215] أو التليّف الكيسي [ط 216].[67] ونظراً لتداخل النحاس في دور امتصاص الحديد، فقد يكون لنقص النحاس أعراضاً مشابهةً لفقر الدم؛ بالإضافة إلى أعراض أخرى تتضمّن قلّة الخلايا المتعادلة [ط 217] واضطرابات في النموّ وتشوّهات في نموّ العظام، ونقص التصبّغ [ط 218]، وهشاشة العظام [ط 219] وفرط الدرقية [ط 220] بالإضافة إلى حدوث اضطرابات في استقلاب الغلوكوز والكوليسترول. قد يساعد تحليل الدم في بعض الأحيان في الكشف عن حالات نقص النحاس الشديدة، إلّا أنّه لا توجد معايير ضابطة معتمدة لذلك.[68]

الفرط والسمية
يؤدّي تجمّع النحاس في أنسجة الجسم إلى حدوث داء ويلسون [ط 222]؛ وهو يحدث بسبب اضطراب جيني وتتركّز أعراضه في الدماغ والكبد.[وب-إنج 23] من جهةٍ أخرى، وُجِدَ أنّ هناك ارتباطٌ بين ارتفاع مستويات النحاس وبين تدهور حالات مرض آلزهايمر.[69]
أمّا التراكيز المرتفعة من هذا العنصر فتؤدّي إلى حدوث حالة التسمّم بالنحاس [ط 223]، وقد يكون السبب في ذلك هو توليد أنواع كيميائية أكسجينية نشيطة كيميائياً [ط 224] قادرة على تحطيم الحمض النووي الريبوزي منقوص الأكسجين [ط 225].[70][71] إلّا أنّ تلك الحالة نادرة الحدوث عند البشر،[وب-إنج 20] بالمقابل فإنّ ارتفاع نسبة النحاس في الحيوانات بنسبة أكبر من 30 ميليغرام/الكيلوغرام يؤدّي غالباً إلى حالات تسمّم.[وب-إنج 24]
المخاطر
حَدّدت إدارة السلامة والصحّة المهنية [ط 226] في الولايات المتّحدة الأمريكية حدّ التعرّض المسموح [ط 227] به من غبار النحاس وأبخرته في مكان العمل في متوسّط زمني مُثَقّل [ط 228] بمقدار 1 مغ/م3؛[وب-إنج 25] أمّا المعهد الوطني للسلامة والصحّة المهنية [ط 229] فوُضِعَ حدّ التعرّض الموصى به [ط 230] من النحاس بمقدار 1 مغ/م3 أيضاً؛ أمّا المقدار الذي يسبّب خطورةً فوريةً للحياة أو الصحّة [ط 231] فيبلغ 100 مغ/م3.[وب-إنج 26]
يعدّ النحاس مكوّنَاً من مكوّنات دخان التبغ؛[وب-إنج 27][72] إذ يمتصّ نبات التبغ الفلزّات الثقيلة عموماً، ومن ضمنها النحاس، من التربة ويركّمها في الأوراق؛ ممّا يؤدّي إلى دخولها الجسم عند التدخين.[73][74]
الأهمية الاقتصادية

للنحاس دورٌ اقتصاديٌّ مهمٌّ، فهو خامةٌ أساسيّةٌ في الصناعة، وهو أحد فلزّات النقود، إذ تُسَكُّ منه النقود المعدنية في عددٍ من الدول. لا يزال النحاس مستخدمَاً في جوانب الحياة اليومية للبشر منذ لا يقل عن عشرة آلاف سنة؛ إلّا أنّ أكثر من 95% من عمليّات استخراج النحاس وصهره لحدّ الآن كانت منذ بداية القرن العشرين.[وب-إنج 10] يُقدّر الاحتياطي من النحاس في القشرة الأرضية بعمق كيلومتر واحد قرابة 1014 طن؛ إلّا أنّ نسبةً ضئيلةً نسبياً من تلك الاحتياطات يمكن الاستفادة منها اقتصادياً بالنظر إلى السعر الحالي وإلى التقنيّات المتوفّرة للاستخراج. تشير بعض التقديرات إلى أنّه بالنظر إلى معدّلات الاستهلاك ومعدّلات النموّ الحالية فإنّ احتياطات النحاس قابلةٌ للنضوب وقد تكفي إلى فترة تتراوح بين 25 إلى 60 سنة.[25] وهو ما يشار إليه باسم ذروة النحاس؛ لذلك أصبح مفهوم إعادة تدوير النحاس ذا أهميّة كبيرةٍ في العصر الحديث.[وب-إنج 10]
سعر النحاس غيرُ مستقرٍّ على مرّ التاريخ؛[75] إذ شهد تأرجحاتٍ وتقلّبات مختلفة، فقد ازداد سعره منذ يونيو 1999 بعد أخفض قيمة له مسجلّة منذ ستين سنة حينها (1.32 دولار أمريكي/الكيلوغرام) إلى قيمة مقدارها 8.27 دولار أمريكي/الكيلوغرام في مايو 2006. بعد ذلك انخفض إلى 5.29 دولار أمريكي/الكيلوغرام في فبراير 2007؛ ثم ارتدّ إلى 7.71 دولار أمريكي/الكيلوغرام في أبريل 2007؛ ثمّ لم يلبث أن انخفض سعره بسبب الأزمة المالية إلى أدنى مستوى له منذ عشر سنين يمقدار 2.8 دولار أمريكي/الكيلوغرام في ديسمبر 2008؛ ثم في فبراير 2009 ارتفع بشكلٍ طفيف إلى 3.32 دولار أمريكي/الكيلوغرام.[وب-إنج 28] كان سعر النحاس في الربع الأخير من سنة 2022 قريباً من 7.5 دولار أمريكي للكيلوغرام؛ وتعدّ بورصة لندن للمعادن [ط 232] من البورصات المعروفة في تعاملات النحاس.[وب-إنج 29]
الاستخدامات

يدخل النحاس بشكلٍ كبير ومهمٍّ في عددٍ من تطبيقات الحياة اليومية المعاصرة، وذلك يعود إلى خواصه المميّزة من حيث الموصلية الكهربائية والناقلية الحرارية بالإضافة إلى سهولة المعالجة الميكانيكية ومقاومته للتآكل. تنقسم تلك التطبيقات وفقاً إلى نسبة الاستهلاك عموماً إلى ثلاث فئات رئيسية: استخدامه في مجال التوصيل الكهربائي (60%)؛ ومجال العمارة والبناء (20%)؛ وفي مجال صناعة الآليات (15%). أمّا النسبة المتبقية (5%) فهي لمتفرّقات تتضمّن صناعة السبائك مثل النحاس الأصفر (الصُّفْر) والبرونز.[19] كان للنحاس في الماضي استخدام واسع في مجال صناعة الأواني والقدور. من جهةٍ أخرى، لمركّبات النحاس الكيميائية أيضاً تطبيقات واسعة ومختلفة.[وب-إنج 30]
التطبيقات الكهربائية
- التوصيل الكهربائي

نظراً لخواصّه الممتازة بالنسبة للتوصيل الكهربائي يدخل النحاس في تركيب الأسلاك في أغلب التطبيقات المتعلّقة بهذا المجال، باستثناء مجال نقل الكهرباء إذ يُفضَّل الألومنيوم عليه؛[76] أمّا بالنسبة للتوصيل في الأجهزة والمنشآت فإنّ السلك النحاسي هو الخيار الأول في مجال توليد الكهرباء وتوزيعها؛ وفي مجال الاتصالات عن بعد والإلكترونيات، بالإضافة إلى تصنيع الأجهزة الكهربائية؛[77] وكذلك في مجال التمديد الكهربائي.[وب-إنج 31]
- الأجهزة الإلكترونية

يدخل النحاس بشكلٍ متزايدٍ في تصميم وبناء الدارات المتكاملة [ط 233] ولوحات الدارات المطبوعة [ط 234]؛ كما يدخل في بناء المغانط الكهربائية والصمّامات المُفَرّغة [ط 235] وأنبوب الأشعّة المهبَطية [ط 236] والأنابيب المغناطيسية الإلكترونية [ط 237]؛ بالإضافة إلى بناء أجهزة الدليل الموجي [ط 238].
- المحرّكات الكهربائية
يزيد استخدام النحاس في التوصيل داخل المحرّكات الكهربائية من كفاءتها؛[وب-إنج 32] وذلك عاملٌ مهمٌّ، إذ أن المحرّكات الكهربائية والأنظمة القائمة عليها تستهلك ما بين 43%-46% من الاستهلاك العالمي للكهرباء، وقرابة 69% من الكهرباء المستهلَكة في الصناعة. تعمل المحرّكات الحثّيّة التي يدخل النحاس في تركيبها على توفير استهلاك الطاقة توفيراً كبيراً.[وب-إنج 33]
- الطاقة المتجدّدة
للنحاس دور مهمٍّ في أنظمة الطاقة المتجدّدة؛[وب-إنج 34] ويزداد استخدام هذا الفلزّ بشكلٍ مطّردٍ في بنائها وتجهيزها،[وب-إنج 35] خاصّةً أنّ نسبة إعادة تدوير النحاس هي الأعلى من بين الفلزّات الأخرى المستخدَمة في الصناعة.[وب-إنج 34]
البناء والعمارة

شاع منذ القدم استخدام النحاس في العمارة وضمن مواد البناء، وذلك نظراً لمقاومته للتآكل وللعوامل الجوّية.[وب-إنج 36] إذ استُخدِمَ النحاس في تشييد السقوف الداخلية، وفي عزل السقوف وبناء المزاريب والميازيب، وكذلك في بناء القبب وذروات الأبراج والقناطر والأبواب. وعلى الخصوص كان استخدام النحاس في صنع سقوف الأبنية، إذ كان تشكّل صدأ النحاس [ط 239] ذو بعدٍ جماليٍّ في تصميم المدن عند المهندسين، بالإضافة إلى أن طبقة الصدأ تلك كانت تحمي وتقي مكوّنات البناء من التآكل.[وب-إنج 37] يمكن أن تتكوّن الطبقة من مركّبات كربونات وكبريتات النحاس بنسبٍ وكمّيّاتٍ مختلفة، وذلك حسب الظروف الجوّية المحيطة.[78][وب-إنج 38]
يمكن معالجة صفائح النحاس عن طريق اللحام بالمونة [ط 240] أو اللحام بالقصدير [ط 241]، بالإضافة إلى إمكانية إجراء عمليّات لحام عليه، وأفضل النتائج يمكن استحصالها عن طريق اللحام القوسي بالمعدن والغاز [ط 242].[79]
متفرّقات
وُجدَ أنّ النحاس يمتلك طبيعياً خواصّاً مضادّةً للميكروبات؛[80][وب-إنج 39] لذلك اقتُرحَ استخدامه ضمن مواد البناء في المرافق العامة مثل المشافي ومحطّات المواصلات العامّة.[81] كما يُستخدَم النحاس وسبائكه في تجهيز معدّات تربية الأحياء المائية [ط 243] بسبب خواصّه المضادّة للميكروبات [ط 244] والمقاومة للحَشْف الحيوي [ط 245].
في الحياة والثقافة العامة

في اللغة
- اللغة العربية
يُسمّى النحاس في أيضاً في اللغة العربية باسم «القِطـْر»؛ وهو النحاس الذائب، وقد أورد ابن منظور تعريفه في معجم لسان العرب: «القِطْرُ: النُّحاسُ والآني الذي قد انتهى حَرُّه».[عر 1] وقد ورد لفظه على هذا الشكل في القرآن الكريم في قصّة ذي القرنين في سورة الكهف:[عر 2] ﴿آتُونِي زُبَرَ الْحَدِيدِ حَتَّى إِذَا سَاوَى بَيْنَ الصَّدَفَيْنِ قَالَ انْفُخُوا حَتَّى إِذَا جَعَلَهُ نَارًا قَالَ آتُونِي أُفْرِغْ عَلَيْهِ قِطْرًا ٩٦﴾ [الكهف:96]؛ وورد في سورة سبأ أيضًا:[عر 3] ﴿وَلِسُلَيْمَانَ الرِّيحَ غُدُوُّهَا شَهْرٌ وَرَوَاحُهَا شَهْرٌ وَأَسَلْنَا لَهُ عَيْنَ الْقِطْرِ وَمِنَ الْجِنِّ مَنْ يَعْمَلُ بَيْنَ يَدَيْهِ بِإِذْنِ رَبِّهِ وَمَنْ يَزِغْ مِنْهُمْ عَنْ أَمْرِنَا نُذِقْهُ مِنْ عَذَابِ السَّعِيرِ ١٢﴾ [سبأ:12] أمّا لفظ نحاس في آية ﴿يُرْسَلُ عَلَيْكُمَا شُوَاظٌ مِنْ نَارٍ وَنُحَاسٌ فَلَا تَنْتَصِرَانِ ٣٥﴾ [الرحمن:35] فاختُلف فيه، فقيل إن المقصود به الدخان،[عر 4] وقيل إن المقصود به هو الصُّفر،[عر 5] وهو النحاس الأصفر.
- اللغات الأجنبية
يُشتقّ اسم النحاس في أغلب اللغات الأوروبية من الكلمة اللاتينية cuprum؛ والتي تعود أصلها إلى aes cyprium، والتي تعني الفلزّ المستحصَل من قبرص، إذ كانت جزيرة قبرص مصدراً مهمّاً لخامات النحاس منذ عهد روما القديمة؛ ويعود أقدم استخدام للفظ الإنجليزي القديم Coper إلى قرابة سنة 1530، والتي أصبحت لاحقاً على الشكل copper.[82]
في الثقافة العامة

اقترن النحاس في أوروبا بالآلهة أفروديت [ط 246] (فينوس [ط 247] في روما القديمة)، بسبب جمالية النحاس ولمعانه، ولاستخدامه في إنتاج المرايا قديماً. كما ارتبطت الكواكب السبعة المعروفة قديماً بالفلزّات النفيسة المتوفّرة في تلك العصور، وبالنسبة للنحاس كان الاقتران مع كوكب الزهرة؛[83] لذا كان رمز فينوس مستخدماً على هيئة رمز خيميائي في المخطوطات للإشارة إلى هذا العنصر؛ وكان يظنّ أنّ النحاس ناتجٌ عن تفاعل الزئبق والكبريت.[ألم 5]
في الحياة العامة
في الطبّ الشعبيّ يُعتقَد أنّ الأساور المصنوعة من النحاس تخفّف من أعراض التهاب المفاصل [ط 248]؛[84] لكن لا توجد شواهد ودلائل علميّة تدعم هذا الادعاء.[85][86] من جهةٍ أخرى، يُستخدَم النحاس وسبائكه بشكلٍ شائعٍ في صناعة الحليّ والمجوهرات، وكذلك في صناعة القدور والأواني من أجل الاستخدام اليومي وفي الفنون الزخرفيّة. تعدّ مهنة النحّاس من المهن الحرفية التقليدية في المنطقة العربية؛ وتوجد أسواق خاصّة لهذه المهنة في عددٍ من عواصم الدول العربية، مثل سوق النحاس في مدينة تونس، بالإضافة إلى سوق النحاسين في دمشق؛[وب-عر 1] والقاهرة على سبيل المثال.[وب-عر 2]
طالع أيضاً
| نحاس في المشاريع الشقيقة: | |
- نحاس أصفر
- تبييض النحاس
- استخراج النحاس
- قائمة الدول حسب إنتاج النحاس
- قائمة الدول حسب إنتاج النحاس المصهور
الهوامش
- مصطلحات
- ^ Zakros
- ^ Cold working
- ^ أو التخمير Annealing
- ^ Smelting
- ^ Lost-wax casting
- ^ Neolithic
- ^ Bronze Age
- ^ Chalcolithic
- ^ Investment casting
- ^ Ötzi
- ^ Bloomery
- ^ Arsenical bronze
- ^ Vinča culture
- ^ Iron Age
- ^ χαλκός
- ^ Augustus
- ^ Hispania
- ^ Corinthian bronze
- ^ Isle Royale National Park
- ^ Tumbaga
- ^ Falun Mine
- ^ plate money (plåtmynt)
- ^ Chalcography
- ^ Daguerreotype
- ^ Copper plating
- ^ Copper sheathing
- ^ Norddeutsche Affinerie
- ^ Aurubis
- ^ electroplating
- ^ Outokumpu
- ^ Flash smelting
- ^ Intergovernmental Council of Countries Exporters of Copper (CIPEC)
- ^ parts per million (ppm)
- ^ Nuggets
- ^ Dendrite
- ^ Single crystal
- ^ Pseudomorph
- ^ Aragonite
- ^ Sulfide mineral
- ^ Chalcopyrite
- ^ Bornite
- ^ Digenite
- ^ Covellite
- ^ Chalcocite
- ^ Sulfosalt mineral
- ^ Tetrahedrite
- ^ Tennantite
- ^ Enargite
- ^ Arsenate mineral
- ^ Cornwallite
- ^ Clinoclase
- ^ Azurite
- ^ Malachite
- ^ Cuprite
- ^ Tenorite
- ^ Atacamite
- ^ Algodonite
- ^ Paramelaconite
- ^ Surface mining
- ^ Porphyry copper deposit
- ^ Chuquicamata
- ^ Bingham Canyon Mine
- ^ Chino mine
- ^ British Geological Survey (BGS)
- ^ in-situ leach
- ^ Deep sea mining
- ^ polymetallic nodules
- ^ sulphuric leaching
- ^ International Copper Study Group (ICSG)
- ^ United States Geological Survey (USGS)
- ^ Peak copper
- ^ Recycling
- ^ froth flotation
- ^ Bioleaching
- ^ Reverberatory furnace
- ^ Roasting
- ^ Silica
- ^ Slag
- ^ Silicate
- ^ copper matte
- ^ Aluminothermic reaction
- ^ Flux
- ^ Cementation
- ^ Electrorefining
- ^ Anode
- ^ Anode
- ^ Electrolyte
- ^ anode mud
- ^ International Resource Panel
- ^ Metallurgical furnace
- ^ billets
- ^ ingots
- ^ Spin
- ^ half-life
- ^ nuclear isomer
- ^ metastable
- ^ beta decay β−
- ^ positron emission β+
- ^ radioactive tracer
- ^ Positron Emission Tomography (PET)
- ^ Streak
- ^ Coinage metals
- ^ Electron configuration
- ^ interatomic interactions
- ^ Continuous casting
- ^ etched
- ^ crystallite
- ^ scattering
- ^ thermal vibrations
- ^ Current density
- ^ Galvanic corrosion
- ^ Face-centered cubic crystal system
- ^ Close-packing
- ^ Space group
- ^ Lattice constant
- ^ Formula unit
- ^ Unit cell
- ^ Mohs scale of mineral hardness
- ^ Vickers hardness test
- ^ Work hardening
- ^ Crystallographic defect
- ^ crystal lattice
- ^ grain boundaries
- ^ monocrystalline forms
- ^ Dime
- ^ Brass
- ^ Shakudō
- ^ Nordic Gold
- ^ cupronickel
- ^ Nickel silver
- ^ Royal Observatory, Edinburgh
- ^ passivation
- ^ Verdigris
- ^ Patina
- ^ Statue of Liberty
- ^ Hydrogen embrittlement
- ^ cuprous
- ^ cupric
- ^ Coordination complex
- ^ Organocopper compound
- ^ amorphous
- ^ Monoclinic crystal system
- ^ Wood stain
- ^ Chalcanthite
- ^ Boothite
- ^ cuprate
- ^ Yttrium barium copper oxide (YBCO)
- ^ High-temperature superconductivity
- ^ Potassium hexafluorocuprate(III)
- ^ Caesium hexafluorocuprate(IV)
- ^ oxo complexes
- ^ tetrapeptides
- ^ deprotonated amide ligands
- ^ Pourbaix diagram
- ^ ligands
- ^ Metal aquo complex
- ^ Precipitation
- ^ Metal ammine complex
- ^ Schweizer's reagent
- ^ oxyanions
- ^ fungicide
- ^ Bordeaux mixture
- ^ Polyols
- ^ reducing sugars
- ^ Benedict's reagent
- ^ Fehling's solution
- ^ ethylenediamine
- ^ chelate complexes
- ^ Grignard reagents
- ^ terminal alkynes
- ^ Gilman reagent
- ^ substitution reaction
- ^ Cadiot–Chodkiewicz coupling
- ^ Sonogashira coupling
- ^ Nucleophilic conjugate addition
- ^ α,β-Unsaturated carbonyl compound
- ^ enones
- ^ carbometalation
- ^ carbocupration
- ^ Electrogravimetry
- ^ Iodometry
- ^ Complexometric titration
- ^ Murexide
- ^ Polarography
- ^ Atomic spectroscopy
- ^ Inductively coupled plasma mass spectrometry (ICP-MS)
- ^ Voltammetry
- ^ plastocyanin
- ^ eukaryotes
- ^ mitochondria
- ^ cytochrome c oxidase
- ^ oxidative phosphorylation
- ^ Copper proteins
- ^ superoxide dismutase
- ^ superoxides
- ^ disproportionation
- ^ nitrous-oxide reductase
- ^ hemocyanin
- ^ laccase
- ^ tyrosinase
- ^ Hydroxylation
- ^ Staphylococcus aureus
- ^ Serum albumin
- ^ Ceruloplasmin
- ^ enterohepatic circulation
- ^ National Academy of Medicine
- ^ Institute of Medicine (IoM)
- ^ Estimated Average Requirements (EARs)
- ^ Recommended Dietary Allowances (RDAs)
- ^ Adequate Intakes (AIs)
- ^ Tolerable upper intake levels (ULs)
- ^ European Food Safety Authority (EFSA)
- ^ copper deficiency
- ^ Menkes disease
- ^ Crohn's disease
- ^ Cystic fibrosis
- ^ Neutropenia
- ^ Hypopigmentation
- ^ osteoporosis
- ^ hyperthyroidism
- ^ Kayser–Fleischer ring
- ^ Wilson's disease
- ^ Copper toxicity
- ^ reactive oxygen species
- ^ DNA
- ^ Occupational Safety and Health Administration (OSHA)
- ^ permissible exposure limit (PEL)
- ^ time-weighted average (TWA)
- ^ National Institute for Occupational Safety and Health (NIOSH)
- ^ recommended exposure limit (REL)
- ^ IDLH
- ^ London Metal Exchange (LME)
- ^ Integrated circuits
- ^ printed circuit boards
- ^ Vacuum tube
- ^ Cathode-ray tube
- ^ Cavity magnetron
- ^ Waveguide
- ^ Patina
- ^ Brazing
- ^ Soldering
- ^ Gas metal arc welding
- ^ Aquaculture
- ^ antimicrobial
- ^ Biofouling
- ^ Aphrodite
- ^ Venus
- ^ Arthritis
المراجع
فهرس المراجع
المنشورات
- بالعربية
- ^ ابن منظور (1993)، ج. 5، ص. 105.
- ^ القرطبي (1935)، ج. 11، ص. 62.
- ^ القرطبي (1935)، ج. 14، ص. 270.
- ^ الرازي (1872)، ج. 8، ص. 23.
- ^ الطبري (1994)، ج. 7، ص. 187-188.
- بالألمانية
- ^ Strunz (2001), p. 34 .
- ^ Römpp (1985), p. 2773 .
- ^ Meyers (1888), p. 305 .
- ^ Neeb (1969), p. 185–188 .
- ^ Hassenstein (1941), p. 104 .
- بالإنكليزية
- ^ Hesse (2007), p. 56 .
- ^ أ ب ت ث ج Pearce (2019), p. 229–250 .
- ^ Klimscha (2011), p. 177–210 .
- ^ أ ب Radivojević (2013), p. 1030–1045 .
- ^ Thornton (2002), p. 1451–1460 .
- ^ Lechtman (1999), p. 497–526 .
- ^ Encyclopaedia Britannica (1992), vol. 3, p. 612 .
- ^ McNeil (2002), p. 13, 48–66 .
- ^ Muhly (1980), p. 262-264 .
- ^ Hong (1996), p. 246–249 .
- ^ Callataÿ (2005), p. 361–372 .
- ^ Jacobson (2000), p. 60–66 .
- ^ Fester (1962), p. 21-31 .
- ^ Lynch (2002), p. 60 .
- ^ Stelter (2004), p. 558–562 .
- ^ Honig (2014), p. 257 .
- ^ Mingst (1976), p. 263–287 .
- ^ Romano (2007), p. L59–L63 .
- ^ أ ب ت ث ج Emsley (2003), p. 121-125 .
- ^ Rickwood (1981), p. 885 .
- ^ Rieuwerts (2015), p. 207 .
- ^ Gordon (2006), p. 1209–1214 .
- ^ أ ب Greenwood (1997), p. 1174–1175 .
- ^ Su (2020), p. 360 .
- ^ أ ب Brown (2006), p. 109 .
- ^ Watling (2006), p. 81–108 .
- ^ Lung (1986), p. 113–129 .
- ^ Bahadir (2009), p. 249 .
- ^ أ ب Audi (2003), p. 3–128 .
- ^ Okazawa (1994), p. 1910–1915 .
- ^ Chambers (1884), p. 312 .
- ^ أ ب Trigg (1992), p. 267–272 .
- ^ Deffenbaugh (2003), p. 12-18 .
- ^ Smith (2003).
- ^ Öguchi (1983), p. 125-132 .
- ^ Deane (1968), p. 175-182 .
- ^ Baboian (2005), p. 368 .
- ^ Rickett (1995), p. 3723–3728 .
- ^ Trammell (2019), p. 2954–3031 .
- ^ أ ب ت Baudler (1978), p. 973-979 .
- ^ Brauer (1963), p. 1015 .
- ^ Wu (1987), p. 908–910 .
- ^ Lewis (2004), p. 1047–1076 .
- ^ McDonald (1997), p. 3119–3124 .
- ^ Saalwächter (2000), p. 4094–4107 .
- ^ Deodhar (2014), p. 1 .
- ^ Kelly (2015), p. e52901 .
- ^ Karan (2018), p. 844 .
- ^ Berná (2008), p. 4464–4468 .
- ^ Chinchilla (2007), p. 874–922 .
- ^ Iyer (1986), p. 1 .
- ^ Kharasch (1941), p. 2308–2316 .
- ^ Imai (1998), p. 3066–3070 .
- ^ Decker (2000), p. 1777–1782 .
- ^ Vest (2012), p. 451–478 .
- ^ Schneider (2014), p. 177–210 .
- ^ Warnes (2013), p. e75017 .
- ^ Mathews (2013), p. 2605-2611 .
- ^ Adelsteinl (1961), p. 892–897 .
- ^ Hellman (2002), p. 439–458 .
- ^ Linder (1998), p. 965S–971S .
- ^ Frieden (1976), p. 187–236 .
- ^ Percival (1990), p. C140–C146 .
- ^ أ ب ت National Academies (2001), p. 224–257 .
- ^ Mercer (1998), p. 1022S–1028S .
- ^ Lutsenko (2007), p. 1011–1046 .
- ^ Halfdanarson (2008), p. 523–531 .
- ^ Bonham (2002), p. 393–403 .
- ^ Brewer (2012), p. 107–113 .
- ^ Li (1994), p. 1421–1427 .
- ^ Starkebaum (1986), p. 1370–1376 .
- ^ Talhout (2011), p. 613–628 .
- ^ Pourkhabbaz (2012), p. 636–644 .
- ^ Bernhard (2008), p. 805–809 .
- ^ Schmitz (1986), p. 392–410 .
- ^ Pops (2008), p. 58–66 .
- ^ Günter (1999), p. 141–192, 331–375 .
- ^ Fitzgerald (1998), p. 2029-2050 .
- ^ Davis (2001), p. 3–6, 266 .
- ^ Montero (2019), p. 1-10 .
- ^ Biurrun (1999), p. 426–428 .
- ^ Simpson (1989), vol. 3, p. 907 .
- ^ Rickard (1932), p. 281–290 .
- ^ Walker (1976), p. 454–459 .
- ^ Richmond (2013), p. e71529 .
- ^ Richmond (2009), p. 249–256 .
وب
- بالعربية
- ^ حبيب شحادة (01–07–2020). "سوق النحّاسين الدمشقي.. شاهِد على تَضَعْضُع مهنة عريقة". شبكة الميادين الإعلامية. مؤرشف من الأصل في 06–11–2022. اطلع عليه بتاريخ 12–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ محمد سامي الكميلي (09–04–2022). "سوق النحاسين.. آخر معاقل الحرف اليدوية في القاهرة التاريخية". الوطن. مؤرشف من الأصل في 06–11–2022. اطلع عليه بتاريخ 12–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link)
- بالألمانية
- ^ "Kupfer-Legierungen". Kupferverband e.V. (بDeutsch). Archived from the original on 21–03–2023. Retrieved 03–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "4.4.24.1 Reaktion von Metallen mit Salzsäure". Universität Siegen (بDeutsch). Archived from the original on 04–03–2016.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "4.4.24.2 Reaktion von Metallen mit Salpetersäure". Universität Siegen (بDeutsch). Archived from the original on 04–03–2016.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Jens Oliver Bonnet Konzernbereich (16–06–2009). "Kupfer gegen Keime: Erwartungen wurden übertroffen" (بDeutsch). Archived from the original on 03–07–2022. Retrieved 05–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Denise herzog (01-2010). "Die Bedeutung von Kupfer im menschlichen Körper: eine kurze Übersicht" (PDF). rosenfluh.ch (بDeutsch). Archived from the original (PDF) on 12-10-2023. Retrieved 12-10-2023.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help)
- بالإنكليزية
- ^ "Copper Timeline". Copper Development Association Inc. (بEnglish). Archived from the original on 13–10–2022. Retrieved 26–09–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Peter van der Krogt. "Copper". Elements.vanderkrogt.net (بEnglish). Archived from the original on 08–11–2022. Retrieved 26–09–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ أ ب ت ث Marianne Stanczak (05-2005). "A Brief History of Copper". Proquest (بEnglish). Archived from the original on 03-02-2015. Retrieved 12-09-2008.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help) - ^ Hermann Aubin; Jacques Barzun; Timothy C. Champion; Judith Eleanor Herrin; Michael Frassetto; et al. (28–07–1999). "History of Europe – The Iron Age". Encyclopedia Britannica (بEnglish). Archived from the original on 2022-10-11. Retrieved 30–09–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Monetary episodes from history". Galmarley.com (بEnglish). Archived from the original on 15–10–2022. Retrieved 30–09–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper and Brass in Ships". Copper Development Association Inc. (بEnglish). Archived from the original on 08–04–2022. Retrieved 30–09–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ David Barthelmy. "Mineral Species containing Copper (Cu )". Mineralogy Database (بEnglish). Archived from the original on 03–11–2022. Retrieved 02–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Polymetallic Nodules" (PDF). International Seabed Authority (بEnglish). Archived from the original (PDF) on 19–10–2022. Retrieved 08–02–2021.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "The World Copper Factbook 2021" (PDF). International Copper Study Group (ICSG) (بEnglish). 2021. Archived from the original (PDF) on 27–04–2022.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ أ ب ت ث Leonard, Andrew (03–03–2006). "Peak copper?". Salon (بEnglish). Archived from the original on 08–11–2022. Retrieved 03–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Recycling: Copper - The World's Most Reusable Resource". Copper Association (بEnglish). Archived from the original on 05–03–2012.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Overview of Recycled Copper: Copper Applications in Health & Environment". Copper Development Association Inc. (بEnglish). 06-1998. Archived from the original on 22-10-2022. Retrieved 03-10-2023.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help) - ^ "Chart of Nuclides". National Nuclear Data Center (بEnglish). Archived from the original on 25–08–2013.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Pierre R. Roberge. "Galvanic Corrosion". Corrosion Doctors (بEnglish). Archived from the original on 08–11–2022. Retrieved 03–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Gold Jewellery Alloys". World Gold Council (بEnglish). Archived from the original on 14–04–2009.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "What is 90% Silver?". American Precious Metals Exchange (بEnglish). 24–05–2023. Archived from the original on 10–06–2023. Retrieved 06–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Reclothing the First Lady of Metals - Repair Concerns". Copper Development Association Inc. (بEnglish). Archived from the original on 22–10–2022. Retrieved 06–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Larry E. Johnson. "Copper". Merck Sharp & Dohme Corp., a subsidiary of Merck & Co., Inc. (بEnglish). Archived from the original on 07–03–2016. Retrieved 01–04–2013.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper in human health". Copper Development Association Inc. (بEnglish). Archived from the original on 27–10–2022. Retrieved 02–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ أ ب "Amount of copper in the normal human body, and other nutritional copper facts". Copper Development Association Inc. (بEnglish). Archived from the original on 10–04–2009. Retrieved 03–04–2009.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Dietary Reference Intakes: RDA and AI for Vitamins and Elements" (PDF). National Academy of Sciences (بEnglish). Archived from the original (PDF) on 13–11–2018. Retrieved 18–04–2018.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). European Food Safety Authority (بEnglish). 09-2017. Archived from the original (PDF) on 11-11-2022. Retrieved 11-10-2023.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help) - ^ "Wilson Disease". The National Institute of Diabetes and Digestive and Kidney Diseases (بEnglish). Archived from the original on 04–10–2016. Retrieved 06–11–2016.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper Sulfate". Cornell University (بEnglish). 05-1994. Archived from the original on 29-04-2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help) - ^ "NIOSH Pocket Guide to Chemical Hazards: Copper fume (as Cu)". Centers for Disease Control and Prevention (بEnglish). Archived from the original on 04–03–2023. Retrieved 07–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "NIOSH Pocket Guide to Chemical Hazards: Copper (dusts and mists, as Cu)". Centers for Disease Control and Prevention (بEnglish). Archived from the original on 04–03–2023. Retrieved 07–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper". Office of Environmental Health Hazard Assessment (بEnglish). Archived from the original on 02–07–2022. Retrieved 10–07–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Ackerman, R. (02–04–2009). "A Bottom in Sight For Copper". Forbes (بEnglish). Archived from the original on 08–12–2012.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "LME Copper". London Metal Exchange (بEnglish). Archived from the original on 15–08–2021. Retrieved 07–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper". American Elements (بEnglish). Archived from the original on 08–06–2008. Retrieved 12–07–2008.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper, Chemical Element – Overview, Discovery and naming, Physical properties, Chemical properties, Occurrence in nature, Isotopes". Advameg, Inc. (بEnglish). Archived from the original on 30–10–2022. Retrieved 09–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Paul Boughton (21–02–2013). "IE3 energy-saving motors". Setform Limited (بEnglish). Archived from the original on 30–10–2012. Retrieved 04–10–2023.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Copper Motor Rotor Project". Copper Development Association Inc. (بEnglish). Archived from the original on 13–03–2012. Retrieved 07–11–2012.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ أ ب Zolaikha Strong (15–01–2016). "Will the Transition to Renewable Energy Be Paved in Copper?". Renewable Energy World (بEnglish). Archived from the original on 22–06–2018.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ Zolaikha strong. "The Rise Of Solar: A Unique Opportunity For Copper". Zackin Publications Inc. (بEnglish). Archived from the original on 30–10–2022.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Architecture". European Copper Institute (بEnglish). Archived from the original on 09–10–2012.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "1.3. Architectural Considerations: Weathering, Corrosion, Staining, Substrate, Solder, Sealants". Copper Development Association Inc. (بEnglish). Archived from the original on 21–04–2020.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "Glossary of copper terms". Copper Development Association (بEnglish). Archived from the original on 20–08–2012. Retrieved 14–09–2012.
{{استشهاد ويب}}: صيانة الاستشهاد: تنسيق التاريخ (link) - ^ "EPA registers copper-containing alloy products". United States Environmental Protection Agency (بEnglish). 05-2008. Archived from the original on 29-09-2015.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(help)
معلومات المنشورات كاملةً
- الكتب
- العربية
- Q120472033، QID:Q120472033
- Q115683910، QID:Q115683910
- Q116176016، QID:Q116176016
- Q114878607، QID:Q114878607
- Q117409613، QID:Q117409613
- Q113378673، QID:Q113378673
- الألمانية
- Q123006490، QID:Q123006490
- Q123004847، QID:Q123004847
- Q122971860، QID:Q122971860
- Q122964848، QID:Q122964848
- Q13417527، QID:Q13417527
- الإنكليزية
- Q122949309، QID:Q122949309
- Q122966716، QID:Q122966716
- Q60431630، QID:Q60431630
- Q120829013، QID:Q120829013
- Q34302169، QID:Q34302169
- Q122881796، QID:Q122881796
- Q122949364، QID:Q122949364
- Q122923121، QID:Q122923121
- Q34098779، QID:Q34098779
- Q123019478، QID:Q123019478
- Q123015107، QID:Q123015107
- Q123012159، QID:Q123012159
- Q122898208، QID:Q122898208
- Q122884213، QID:Q122884213
- Q122949837، QID:Q122949837
- Q122916105، QID:Q122916105
- Q122956326، QID:Q122956326
- Q122982930، QID:Q122982930
- Q122924984، QID:Q122924984
- Q122841467، QID:Q122841467
- Q122926482، QID:Q122926482
- Q35014732، QID:Q35014732
- Q34996896، QID:Q34996896
- Q122900672، QID:Q122900672
- Q121438681، QID:Q121438681
- الدوريات
- Q56115915، QID:Q56115915
- Q55924221، QID:Q55924221
- Q56115918، QID:Q56115918
- Q122889685، QID:Q122889685
- Q122966662، QID:Q122966662
- Q34311363، QID:Q34311363
- Q56115917، QID:Q56115917
- Q34470669، QID:Q34470669
- Q60202616، QID:Q60202616
- Q122916151، QID:Q122916151
- Q55924220، QID:Q55924220
- Q56115913، QID:Q56115913
- Q56687646، QID:Q56687646
- Q56115910، QID:Q56115910
- Q24563588، QID:Q24563588
- Q27450348، QID:Q27450348
- Q34330333، QID:Q34330333
- Q34327549، QID:Q34327549
- Q56115908، QID:Q56115908
- Q55878088، QID:Q55878088
- Q55924222، QID:Q55924222
- Q56115914، QID:Q56115914
- Q34468093، QID:Q34468093
- Q54138512، QID:Q54138512
- Q33867104، QID:Q33867104
- Q56850684، QID:Q56850684
- Q33902667، QID:Q33902667
- Q56115911، QID:Q56115911
- Q34132626، QID:Q34132626
- Q29012244، QID:Q29012244
- Q34128372، QID:Q34128372
- Q56039212، QID:Q56039212
- Q54014170، QID:Q54014170
- Q34296936، QID:Q34296936
- Q54283179، QID:Q54283179
- Q55079514، QID:Q55079514
- Q24537444، QID:Q24537444
- Q55887634، QID:Q55887634
- Q34575735، QID:Q34575735
- Q36872228، QID:Q36872228
- Q56115909، QID:Q56115909
- Q57384184، QID:Q57384184
- Q36360742، QID:Q36360742
- Q37088540، QID:Q37088540
- Q123019113، QID:Q123019113
- Q122850214، QID:Q122850214
- Q28237162، QID:Q28237162
- Q22252920، QID:Q22252920
- Q36652534، QID:Q36652534
- Q43465605، QID:Q43465605
- Q34581820، QID:Q34581820
- Q56039561، QID:Q56039561
- Q34990499، QID:Q34990499
- Q122987073، QID:Q122987073
- Q38270458، QID:Q38270458
- Q42577448، QID:Q42577448
- Q52564167، QID:Q52564167
- Q122842267، QID:Q122842267
- Q60920285، QID:Q60920285
- Q91278128، QID:Q91278128
- Q122919932، QID:Q122919932
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
- الاستشهاد بمصادر باللغة Deutsch (de)
- محتوى أرابيكا المتميز منذ 2024
- محتوى أرابيكا المتميز منذ يناير 2024
- مقالات مختارة منذ 2024
- مقالات مختارة منذ يناير 2024
- نحاس
- خصائص دوائية وأحيائية للعناصر الكيميائية
- رموز أريزونا
- عناصر كيميائية
- فلزات انتقالية
- مركبات النحاس
- معادن عناصر طبيعية
- معادن غذائية
- معادن مكعبية
- ملوثات هواء خطرة
- موصلات كهربائية



![تشكّل زائف [ط 37] للنحاس على هيئة أراغونيت [ط 38]](https://upload.wikimedia.org/wikipedia/commons/thumb/8/85/Copper-263181.jpg/235px-Copper-263181.jpg)






