|
تضامنًا مع حق الشعب الفلسطيني |
بروتين
بروتين |
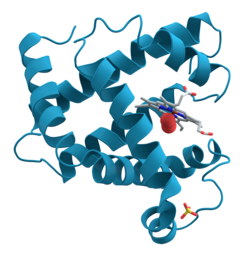
البروتينات[1] هي جزيئات حيوية ضخمة تتكون من سلسلة أو أكثر من الأحماض الأمينية.تتركب كيميائياً من الكربون،الهيدروجين والنتروجين كمكونات أساسية بينما الفسفور والكبريت كمكونات ثانوية .تقوم البروتينات بوظائف كثيرة ومتنوعة داخل أجسام الكائنات منها: تحفيز التفاعلات الأيضية، تضاعف الدنا، الاستجابة للمنبهات، توفير بنية للخلايا والكائنات، ونقل الجزيئات من مكان لآخر. تختلف البروتينات عن بعضها أساسا حسب تسلسل أحماضها الأمينية الذي يحدده تسلسل نوكليوتيدات الجينات المشفرة لها، تسلسل الأحماض الأمينية هذا يحدد تطوي البروتين إلى بنية خاصة ثلاثية الأبعاد تحدد نشاط هذا البروتين.
ترتبط الأحماض الأمينية الفردية مع بعضها البعض بواسطة روابط ببتيدية لتشكل سلسلة خطية من الأحماض الأمينية تسمى عديد الببتيد، يحتوي البروتين على الأقل على جزيء عديد ببتيد واحد طويل. عديدات الببتيد القصيرة التي تحوي أقل من 20-30 حمضا أمينيا نادرا ما تُعتبر بروتينات ويطلق عليها في الغالب اسم البيبتيدات وأحيانا قليلات الببتيد. تحدد الشيفرة الجينية 20 حمضا أمينيا مولدا للبروتين لكن يمكن أن تشمل الشيفرة الجينية لبعض الكائنات على السيلينوسيستئين وفي بعض العتائق على بيروليسين. أثناء التخليق الحيوي للبروتين أو بعده بوقت قصير يتم تعديل الأحماض الأمينية المكونة له كيميائيا عبر تعديلات ما بعد الترجمة، والتي تغير الخصائص الفيزيائية والكيميائية، تطوي، استقرار، نشاط، وأخيرا وظيفة هذه البروتينات. يكون للبروتينات في بعض الأحيان مجموعات غير ببتيدية مرتبطة بها، والتي يمكن أن تسمى مجموعات ضميمية أو عوامل مرافقة. يمكن لعدة جزيئات بروتينية أن تعمل معا لتحقيق وظيفة معينة، وغالبا ما تترابط معا لتشكيل مركبات بروتينية مستقرة.
لا يمكن للبروتينات البقاء بعد أن يتم تخليقها سوى لفترة محددة ثم يتم تحليلها وإعادة تدويرها بواسطة آلية الخلية عبر عملية تعرف بدورة البروتين. يُقاس عمر البروتينات حسب عمرها النصفي ويشمل مجالا واسعا، حيث يمكنها التواجد لدقائق فقط أو لسنوات عديدة، متوسط عمر البروتينات هو 1-2 يوم في خلايا الثدييات، تتحلل البروتينات المضطربة أو المتطوية بشكل خاطئ بصفة أسرع بسبب استهدافها لتدميرها أو لكونها غير مستقرة.
البروتينات جزيئات مهمة -مثل الجزيئات الضخمة الأخرى كعديدات السكاريد والأحماض النووية- للكائنات وتساهم تقريبا في جميع العمليات داخل الخلايا. العديد من البروتينات هي إنزيمات تحفز التفاعلات الكيميائية الحيوية وهي أساسية لعملية الأيض. للبروتينات وظائف بنائية أو حركية مثل الأكتين والميوسين في العضلات والبروتينات في الهيكل الخلوي، والتي تشكل نظام سقالة يحافظ على شكل الخلية، بعض البروتينات الأخرى مهمة في نقل واستقبال إشارات الخلايا، الاستجابات المناعية، التصاق الخلايا، ودورة الخلية. من الضروري وجود البروتينات في غذاء الحيوانات والإنسان لتوفير الأحماض الأمينية الأساسية التي لا يمكن تخليقها. تفك عملية الهضم البروتينات لاستخدامها في الأيض إن دعت الحاجة.
يمكن تنقية البروتينات من المكونات الخلوية الأخرى باستخدام تقنيات عديدة مثل: الطرد المركزي التبايني، الترسيب، الرحلان الكهربائي، والاستشراب. تَقدُّم الهندسة الوراثية جعل تنقية البروتينات أسهل عبر استخدام طرق ذات صلة. من الطرق الشائعة الاستخدام في دراسة بنية البروتين: الكيمياء النسيجية المناعية، التطفر نوعي الموقع، علم البلورات السيني، الرنين المغناطيسي النووي، ومطيافية الكتلة.
الكيمياء الحيوية

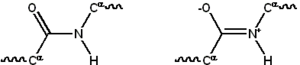
تتكون معظم البروتينات من مكاثير خطية متكونة من سلسلة قد تصل حتى 20 L-α حمضا أمينيا مختلفا. تمتلك جميع الأحماض الأمينية المولدة للبروتين ميزات بنيوية مشتركة، منها كربون-α الذي ترتبط به مجموعة أمينية، مجموعة كربوكسيلية وسلسلة جانبية متغيرة. لا يختلف عن هذه البنية الأساسية سوى البرولين حيث يحتوي حلقة غير اعتيادية في النهاية الأمينية والتي تجبر جزء الأميد CO–NH على اتخاذ بنية ثابتة.[2] السلاسل الجانبية للأحماض الأمينية القياسية -المفصلة في قائمة الأحماض الأمينية القياسية- تملك تنوعا كبيرا في البنى الكيميائية والخصائص. وتوليفة تأثير هذه السلاسل الجانبية لجميع الأحماض الأمينية في البروتين هي من يحدد في النهاية بنيته الثالثية وتفاعله الكيميائي.[3] ترتبط الأحماض الأمينية في عديد الببتيد بواسطة روابط ببتيدية، وحين ترتبط في سلسلة البروتين يسمى الحمض الأميني الواحد وحدة بناء وتعرف سلاسل ذرات الكربون والنيتروجين والأكسجين المرتبطة بالسلسلة الأساسية أو العمود الفقري للبروتين.[4]
للرابطة الببتيدية بنيتا رنين تساهمان ببعض خصائص الرابطة المضاعفة وتمنعان الدوران حول محورها، وتكون فيهما الذرات المرتبطة بكربون ألفا على نفس المستوى تقريبا. تحدد الزاويتان الزوجيتان الأخرتان في الرابطة الببتيدية الشكل المحلي المتخذ من قبل العمود الفقري للبروتين.[5] تُعرف النهاية التي تحتوي على مجموعة أمينية حرة بالنهاية الأمينية أو النهاية N، في حين تسمى نهاية البروتين التي تحتوي على مجموعة كربوكسيلية حرة بالنهاية الكربوكسيلية أو النهاية C (يُكتب تسلسل البروتين من النهاية الأمينية إلى النهاية الكربوكسيلية، من اليسار إلى اليمين).
الكلمات: بروتين، عديد الببتيد وببتيد مبهمة قليلا ويمكن أن تتداخل في معناها. تُستخدم كلمة البروتين عادة للإشارة إلى جزيء بيولوجي مكتمل له بنية مستقرة، في حين أن كلمة ببتيد تُستخدم في الغالب مع الأحماض الأمينية قليلة الوحدات التي لا تملك في الغالب بنية مستقرة ثلاثية الأبعاد. الحدود بين هاتين الكلمتين غير معرفة بدقة وتكون في الغالب بين 20-30 وحدة.[6] يمكن أن يشار بكلمة عديد الببتيد لأي سلسلة خطية فردية من الأحماض الأمينية بغض النظر عن طولها، لكن في العادة استخدام عديد الببتيد يوحي بغياب بنية محددة لتلك السلسلة الخطية.
تآثرات
يمكن أن تتآثر البروتينات مع العديد من أنواع الجزيئات، بما في ذلك مع بروتينات أخرى، مع لبيدات، مع السكريات ومع الدنا.[7][8][9][10]
الوفرة في الخلايا
تم تقدير أن البكتيريا المتوسطة الحجم تحتوي على حوالي مليوني بروتين في كل خلية (مثال: الإشريكية القولونية والمكورة العنقودية الذهبية)، أما البكتيريا الصغيرة مثل المفطورة أو الملتوية فتحتوي عددا أقل يتراوح بين 50 ألف إلى مليون بروتين. في المقابل، خلايا حقيقيات النوى أكبر حجما وتحتوي على بروتينات أكثر، على سبيل المثال قُدّر أن خلايا الخميرة تحوي حوالي 50 مليون بروتين وأن خلايا الإنسان تحوي من مليار إلى ثلاثة مليارات بروتين.[11] تركيز نسخ البروتينات الفردية يتراوح بين عدة جزيئات لكل خلية إلى 20 مليون.[12] لا يتم التعبير عن كل الجينات المشفِّرة للبروتين في معظم الخلايا وعدد البروتينات يعتمد على نوع الخلية والمحفز الخارجي، على سبيل المثال من بين الـ20 ألف بروتينا المشفر بواسطة الجينوم البشري لا يتواجد سوى 6 آلاف منها في الأرومة اللمفاوية.[13] علاوة على ذلك، عدد البروتينات التي يشفرها الجينوم يتناسب مع تعقيد الكائن. حقيقيات النوى، البكتيريا، العتائق والفيروسات تمكك في المتوسط 15145، 3200، 2358 و42 بروتينا على التوالي مشفرة في جينوماتها.[14]
التخليق

التخليق الحيوي
يتم تركيب البروتينات من أحماض أمينية باستخدام المعلومة المشفرة في الجينات، لدى كل بروتين تسلسلٌ خاص به من الأحماض الأمينية والذي يُحدَّد بواسطة تسلسل نوكليوتيدات الجين المشفر لذلك البروتين. الشيفرة الجينية عبارة عن مجموعات من ثلاث نوكليوتيدات تسمى كودونات، وتوليفة كل ثلاث نوكليوتيدات ترمز لحمض أميني فمثلا AUG (أدينين، يوراسيل، غوانين) هو رمز الميثيونين. نظرا لاحتواء الدنا على أربع نوكليوتيدات فإن عدد الكودونات المحتملة الكلي هو 64 كودونا، وهذا العدد يفوق عدد الأحماض الأمينية لذا يتم الرمز لبعض الأحماض الأمينية بأكثر من كودون.[15] تُنسخ الجينات المشفرة في الدنا إلى رنا قبل رسول بواسطة بروتينات مثل بوليميراز الرنا، وتقوم معظم الكائنات بمعالجة الرنا قبل رسول (والذي يعرف كذلك بالنسخة الأولية) بالقيام بمختلف تعديلات ما بعد الاستنساخ لتشكيل رنا رسول ناضج، والذي يُستخدم بعدها كقالب لتخليق البروتين بواسطة الريبوسوم. لدى بدائيات النوى يمكن أن يستخدم الرنا الرسول بعد إنتاجه مباشرة أو بعد الارتباط بالريبوسوم والابتعاد عن النوواني. وفي المقابل تُنتج حقيقيات النوى الرنا الرسول في نواة الخلية وبعدها ينتقل عبر الغشاء النووي إلى السيتوبلازم أين تتم عملية تخليق البروتين. معدل تخليق البروتين مرتفع لدى بدائيات النوى أكثر منه لدى حقيقيات النوى ويمكن أن يصل حتى عشرين حمضا أمينيا في الثانية.[16]
تُعرف عملية تخليق البروتين من الرنا الرسول بالترجمة، ويتم خلالها ارتباط الرنا الرسول بالريبوسوم حيث تُقرأ منه ثلاث نوكليوتيدات كل مرة وتتم مطابقة كل كودون بضد الكودون المقابل له والموجود في جزيء الرنا الناقل الذي يحمل معه الحمض الأميني الموافق للكودون الذي يتعرف عليه، يقوم الإنزيم مخلقة أمينوسيل الرنا الناقل «بتحميل» الرنا الناقل بالأحماض الأمينية الصحيحة.السلسلة الببتيدية النامية تسمى غالبا السلسلة الوليدة أو الناشئة. تُخلّق البروتينات دائما من النهاية-N نحو النهاية-C.[15]
يمكن قياس طول البروتين المخلّق بعدد الأحماض الأمينية التي يتكون منها وبكتلته المولية الكلية والتي تقاس عادة بالدالتون (وحدة الكتل الذرية) أو إحدى مضاعفتها مثل الكيلودلتون (كدا). يزداد الطول المتوسط للبروتين من العتائق إلى الكتيريا إلى حقيقيات النوى (283، 311، 438 وحدة و31، 34، 49 كدا على التوالي) وذلك بسبب عدد أكبر من النطاقات البروتينية المكونة للبروتينات لدى الكائنات المعقدة.[14] على سبيل المثال، الطول المتوسط لبروتينات الخميرة يبلغ 466 حمضا أمينيا وكتلتها 53 (كدا).[6] أطول البروتينات المعروفة هي التيتينات وهي من مكونات القسيم العضلي وتبلغ كتلتها المولية حوالي 3 آلاف (كدا) وطولها يبلغ تقريبا 27 ألف حمض أميني.[17]
التخليق الكيميائي
يمكن تخليق البروتينات القصيرة كيميائيا بواسطة مجموعة من الطرق تعرف باسم تخليق الببتيد، والتي تعتمد على تقنيات التخليق العضوي مثل الربط الكيميائي للإنتاج بشكل كبير.[18] يسمح التخليق الكيميائي بإدراج أحماض أمينية غير طبيعية إلى سلاسل عديد الببتيد ومن الأمثلة على ذلك ربط المسابير الفلورية بالسلاسل الجانبية للأحماض الأمينية.[19] هذه الطرق مفيدة في الكيمياء الحيوية المخبرية وعلم الأحياء الخلوي، لكن ليس للكتبيقات التجارية. التخليق الكيميائي غير ناجع بالنسبة لعديدات الببتيد التي تزيد عن 300 حمض أميني، والبروتينات المخلقة قد لا تتخذ بسهولة بنيتها الثالثية الطبيعية. تبدأ معظم طرق التخليق الكيميائي من النهاية C نحو النهاية N وذلك عكس التفاعل اليولوجي الطبيعي.[20]
البنية

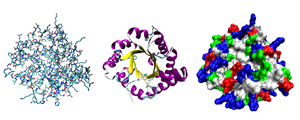

تنطوي معظم البروتينات إلى بنيات فريدة ثلاثية الأبعاد، ويُعرف الشكل الذي ينطوي إليه البروتين طبيعيا بالحالة الواطنة.[21] العديد من البروتينات يمكنها التطوي من دون مساعدة وذلك بفضل الخصائص الكيميائية لأحماضها الأمينية، لكن تحتاج بروتينات أخرى مساعدة شابرونات جزيئية للانطواء إلى حالاتها الطبيعية.[22]، توجد أربع بنيات من البروتين وهي:[23]
- بنية أولية: وهي تسلسل خطي لأحماض أمينية مرتبطة بواسطة رابطة ببتيدية في عديد ببتيد.[24]
- بنية ثانوية: وهي بنيات محلية متكررة باتنظام، مستقرة بواسطة روابط هيدروجينية، أشهر الأمثلة هي: لولب ألفا، صحيفة بيتا واللفات. نظرا لكون البنيات الثانوية محلية؛ يمكن أن تتواجد مناطق عديدة ذات بنيات ثانوية مختلفة في نفس جزيء البروتين.
- بنية ثالثية: وهو الشكل العام الذي يتخذه جزيء بروتين واحد؛ العلاقة الفراغية بين البنيات الثانوية المكونة لهذا البروتين، تستقر البنيات الثالثية في العادة بواسطة تآثرات غير محلية ومن أشهر هذه التآثرات تأثير كره الماء وكذلك الجسر الملحي، الروابط الهيدروجينية، روابط ثنائي الكبريتيد وحتى تعديلات ما بعد الترجمة. غالبا ما يُستخدم المصطلح «بنية ثالثية» كمرادف لمصطلح التطوي، البنية الثالثية هي المسؤولة عن الوظيفة الأساسية للبروتين.
- بنية رابعية: وهي بنية مكونة من عدة جزيئات بروتينية، تسمى في هذا السياق وحدات فرعية، وتعمل كمركب بروتيني واحد.
البروتينات ليست جزيئات صلبة، لأنه بالإضافة إلى هذه الأنواع من البنيات التي تتخذها؛ يمكنها التحول بين عدة بنيات ذات صلة وذلك أثناء قيامها بوظائفها. تسمى هذه التغيرات في البُنى بسبب أداء الوظيفة سواء الثالثية أو الرابعية بـ«التشكلات»، ويسمى التحول بينها «تغيرات تشكلية». تحدث هذه التغييرات في الغالب بسبب ارتباط جزيء ركيزة بالموقع النشط لإنزيم، أو بمنطقة من البروتين تساهم في التحفيز الكيمائي. في المحاليل تخضع البروتينات لتحولات بنيوية كذلك بسب الذبذبات الحرارية والتصادم مع الجزيئات الأخرى.[25]
يمكن تقسيم البروتينات التي لها علاقة بالبنيات الثالثية القياسية -بشكل غير رسمي- إلى ثلاث أقسام رئيسية هي: بروتينات كروية، بروتينات صلبة، وبروتينات غشائية. إن معظم البروتينات الكروية قابلة للذوبان تقريبًا في المحاليل والعديد منها هو عبارة عن إنزيمات. إنّ البروتينات الصلبة غالبًا ما تكون هيكلية مثل الكولاجين وهو أحد المكونات الرئيسية للنسيج الضام والكيراتين وهو البروتين الذي يدخل في تركيب الشعر والأظافر. تعمل البروتينات الغشائية كمستقبلات أو على توفير قنوات لمرور الجزيئات القطبية أو المشحونة عبر الغشاء الخلوي.[26]
توجد حالة خاصة من الروابط الهيدروجينية داخل الجزيء في البروتينات، وهي محمية من الماء بشكل ضعيف وهذا يعني أنها عرضة للتجفاف الذاتي وتسمى ديهايدرونات.[27]
نطاقات البروتين
العديد من البروتينات مكونة من عدة نطاقات بروتينية، وهي أجزاء من البروتين تتَطَوَّى إلى وحدات بنيوية مميزة. لدى النطاقات في العادة مهام محددة مثل النشاطات الإنزيمية (كمثال الكيناز) أو تعمل كوحدات ارتباط (مثال نطاق SH3 يرتبط بالتسلسللات الغنية بالبرولين في البروتينات الأخرى).
أنماط تسلسل
تعمل تسلسلات الأحماض الأمينية القصيرة داخل البروتين في الغالب كمواقع تعرف بالنسبة لبروتينات أخرى.[28] على سبيل المثال: يرتبط النطاق SH3 بالأنماط القصيرة PxxP (جزيئتا برولين [P] مفصولتان بأحماض أمينية غير محددة [x]، حيث تحدد الأحماض الأمينية المحيطة تسلسل الربط بالضبط). عدد كبير من أنماط التسلسل هذه تم التعرف عليها وجمعها في قاعدة بيانات أنماط حقيقيات النوى الخطية (ELM).
وظائف خلوية
البروتينات هي الجزيئات الرئيسية الوظيفية داخل الخلية، فهي تقوم بعمليات محددة بواسطة المعلومة المشفرة في الجينات. باستثناء بعض أنواع الرنا فإن معظم أنواع الجزيئات البيولوجية الأخرى تعتبر عناصر خاملة مقارنة بعمل البروتينات، تشكل البروتينات نصف الوزن الجاف من خلية الإشريكية القولونية في حين أن الجزيئات الضحمة الأخرى مثل الدنا والرنا يشكلان فقط 3% و20% على التوالي.[29] تُعرف مجموعة البروتينات المعبر عنها في خلية محددة أو نوع من الخلايا باسم بروتيوم.

الخاصية الرئيسية للبروتينات التي تسمح بتعدد وظائفها وتنوعها هي قدرتها على الارتباط بالجزيئات الأخرى بإحكام ودقة. تُعرف منطقة البروتين المسؤولة عن الارتباط بجزيء آخر بموقع الارتباط وهي في الغالب انخفاضٌ أو «جيبٌ» على سطح الجزيء. تساهم بنية البروتين الثالثية في القدرة على الارتباط، وهذا يحدد جيب موقع الرتباط وتساهم فيها كذلك الخصائص الكيميائية للسلاسل الجانبية للأحماض الأمينية المحيطة. يمكن أن يكون الارتباط البروتيني محكما ومحددا بشكل كبير، على سبيل المثال يرتبط بروتين مثبط الريبونوكلياز بمولد الأوعية البشري ذي ثابت انحلال الأقل من فيمتومولر (<10−15 M) لكن لا يرتبط على الإطلاق بنظيره البرمائي رانبيرناز (>1 M). أصغر التغيرات الكيميائية مثل إضافة مجموعة ميثيل واحدة إلى جزيء يرتبط به البروتين، يمكن أن يكون كافيا لعدم حدوث الارتباط، فمثلا: مخلقة أمينوسيل الرنا الناقل الخاصة بالحمض الأميني فالين قادرة على التفريق بين سلسلته الجانبية وبين السلسلة الجانبية المماثلة جدا الخاصة بالحمض الأميني إيزوليوسين.[30]
يمكن للبروتينات الارتباط ببروتينات أخرى وكذلك بركائز جزيئية صغيرة. حين ترتبط البروتينات بشكل محدد مع نسخ أخرى من نفس الجزيء، يمكنها الاتحاد لتشكيل لييفات، وتظهر هذه العملية في الغالب لدى البروتينات البنيوية التي تتكون من موحودات كروية ترتبط ذاتيا لتشكل أليافا صلبة. تآثرات البروتين-بروتين تنظم النشاط الإنزيمي، تتحكم في التقدم في دورة الخلية وتسمح بتجميع مركبات البروتين الكبيرة التي تقوم بالعديد من التفاعلات ذات الصلة والتي لها وظيفة بيولوجية مشتركة. يمكن للبروتينات أن ترتبط بالغشاء الخلوي وحتى الاندماج به. قدرة الجزيئات المرتبَط بها على إحداث تغيرات شكلية في البروتين يسمح بببناء شبكات تأشير معقدة للغاية.[31] لأن التآثرات بين البروتينات قابلة للعكس وتعتمد بشكل كبير على توفر مجموعات مختلفة من البروتينات المرتبَط بها لتشكيل معقدات قادرة على القيام بمجموعة مميزة من الوظائف. دراسة التآثرات بين بروتينات محددة هو مفتاحٌ لفهم المظاهر المهم للوظيفة الخلوية، وبشكل نهائي فهم الخصائص التي تميز أنواع خلايا محدة.[32][33]
الإنزيمات
الدور الأكثر شهرة للبروتينات في الخلية هو عملها كإنزيمات، حيث تقوم بتحفيز التفاعلات الكيميائية. عادة الإنزيمات لها أعمال محددة ولا تحفز سوى واحدا أو بضعة تفاعلات كيميائية. تحفز الإنزيمات معظم التفاعلات الخاصة بالأيض وكذلك التفاعلات المتعلقة بالدنا في عمليات مثل تضاعف الدنا، ترميم الدنا والنسخ. تعمل بعض الإنزيمات على بروتينات أخرى فتقوم بإضافة أو إزالة مجموعات كيميائية في عملية تعرف بتعديلات ما بعد الترجمة. حوالي 4آلاف تفاعل معروف بأن الإنزيمات تقوم بتحفيزها.[34] معدل التسارع الذي تمنحه الإنزيمات المحفزة يكون كبيرا جدا، ويصل إلى 1017 مرة من معدل العمليات غير المحفزة كما هو الحال لدى نازعة كربوكسيل 5'-فسفات الأوروتيدين (78 مليون سنة من دون الإنزيم، 18 ميلي ثانية مع الإنزيم).[35]
تسمى الجزيئات التي ترتبط وتعمل عليها الإنزيمات بالركائز، ورغم أن الإنزيمات يمكن أن تتكون من المئات من الأحماض الأمينية؛ لايقوم بالتآثر مع الركيزة سوى عدد صغير من الوحدات، وعدد أصغر من تلك الوحدات -ثلاث أو أربع وحدات في المتوسط- هو من يقوم بالتحفيز بشكل مباشر.[36] تُعرف منطقة الإنزيم التي ترتبط بالركيزة وتتحوي على الوحدات المحفزة باسم الموقع النشط. البروتينات الموجهة هي قسم من البروتينات تحدد الكيمياء الفراغية للمركبات المخلقة بواسطة إنزيمات أخرى.[37]
إشارات الخلية والارتباط بالربائط

لدى العديد من البروتينات وظائف مرتبطة بعملية تأشير الخلية ونقل الإشارة. بعض البروتينات كالأنسولين هي بروتينات خارج خلوية تنقل إشارة من الخلية التي خُلّقت فيها إلى خلايا أخرى في أنسجة بعيدة. تعمل البروتينات الغشائية كمستقبلات وظيفتها الأساسية الارتباط بجزيء إشارة وإحداث استجابة بيوكيميائية في الخلية، العديد من المستقبلات لديها موقع ارتباط مكشوف على سطح الخلية ونطاق مؤثِّر داخل الخلية والذي يمكن أن يكون لديه نشاط إنزيمي أو يحدث له تغيُّرٌ في البنية تكشفه بروتينات أخرى داخل الخلية.[38]
الأجسام المضادة هي مكونات بروتينية لجهاز مناعي تكيفي مهمتها الأساسية الارتباط بمولدات الضد أو الجزيئات الأجنبية في الجسم واستهدافها من أجل تدميرها. يمكن إفراز الأجسام المضادة إلى محيطٍ خارج خلوي أو تثبيتها في الأغشية ذات الخلايا البائية المتخصصة والمعروفة بالخلايا البلازمية. أُلفة الإنزيمات في الارتباط بركائزها محدودة بضرورة تحفيز تفاعلاتها فقط في حين أن الأجسام المضادة لا توجد لديها مثل هذه المحدودية، فألفة ارتباط الجسم المضاد بهدفه عالية جدا.[39]
ترتبط العديد من البروتينات الناقلة للربائط بجزيئات حيوية صغيرة محددة وتنقلها إلى جهات أخرى في جسم كائن متعدد الخلايا، يجب أن يكون لهذه البروتينات ألفة ترابط عالية حين تتواجد ربائطها بتراكيز عالية، ويجب كذلك أن تحرر الربيطة حين تكون في تراكيز منخفظة بالنسيج المستهدف. المثال الشائع عن البروتين المرتبط بربيطة هو الهيموغلوبين الذي ينقل الأكسجين من الرئتين إلى أعضاء وأنسجة أخرى في جميع الفقاريات ولديه نظير مقارب له في جميع الممالك البيولوجية.[40] الليكتينات وهي بروتينات ترتبط بالسكريات ذات تخصص عال بالنسبة لأجزائها السكرية، وتلعب دورا في ظاهرة التعرف الجزيئي البيولوجي المتعلقة بالخلايا والبروتينات.[41] المستقبلات والهرمونات هي بروتينات مرتبطة عالية التخصص.
يمكن للبروتينات عبر الغشائية أن تعمل كبروتينات ناقلة للربائط حيث تقوم بتغيير نفاذية الغشاء الخلوي لتسمح فقط بنفاذ الجزيئات الصغيرة والآيونات. لدى الغشاء الخلوي مفردا جسم كاره للماء لا يمكن أن تنتشر من خلاله الجزيئات القطبية أو المشحونة. تحتوي البروتينات الغشائية على قنوات داخلية تسمح لتلك الجزيئات بالدخول والخروج من الخلية. العديد من البروتينات ذات القنوات الأيونية مخصصة لاختيار أيونات محددة فقط، على سبيل المثال قنوات البوتاسيوم والصوديوم لا يمكنها غالبا سوى التعرف على هاتين الآيونتين.[42]
البروتينات البنائية
تمنح البروتينات البنائية صلابة ومتانة لمكونات بيولوجية -كانت لتكون سائلة من دون هذه البروتينات. معظم البروتينات البنائية هي بروتينات ليفية، على سبيل المثال: الكولاجين والإيلاستين هما مكونان أساسيان للنسيج الضام مثل الغضروف، ويتواجد الكيراتين في البُنى الصلبة أو الشُعيرية مثل الشعر، الأظافر، الريش، الحوافر وبعض صدفات الحيوانات.[43] بعض البروتينات الكروية يمكن أن تلعب أدوارا بنائية فمثلا الأكتين والتوبولين هما بروتينان كرويان قابلان للذوبان في الماء كموحودات لكنهما يتمكثران ليشكلا أليافا طويلة متينة والتي يتكون منها الهيكل الخلوي، وهذا يسمح للخلية بالمحافظة على شكلها وحجمها.
البروتينات الأخرى التي تقوم بوظائف بنائية هي البروتينات المحركة مثل الميوسين، الكينيسين والداينين، وهي قادرة على توليد قوى ميكانيكية. هذه البروتينات أساسية لقابيلة الخلية للحركة سواء لخلايا الكائنات وحيدة الخلية أو نطاف الكائنات متعددة الخلايا والتي تتكاثر جنسيا. كما أنها تولد القوى التي تنتج عند تقلص العضلات [44] وتلعب دورا أساسيا في النقل داخل الخلوي.
طرق الدراسة
يمكن دراسة نشاطات وبنيات البروتينات مخبريا وحيويا وحاسوبيا. الدراسات المخبرية عن البروتينات المنقاة في محيطات مُتحكَّمٍ فيها مفيدة في معرفة طريقة قيام البروتين بوظيفته، على سبيل المثال: تسبر دراسات حركيات الإنزيم الآلية الكيميائية للنشاط التحفيزي للإنزيم وألفته النسبية لمختلف الركائز الجزيئية المحتملة. في المقابل، يمكن أن تقدم الاختبارات الحيوية معلومات حول الدور الفيسيولوجي لبروتينٍ في سياق الخلية أو حتى الكائن كاملا. أما الدراسات الحاسوبية فتستخدم طرقا حسابية وطرق محاكاة لدراسة البروتينات.
تنقية البروتين
للقيام بدراسات مخبرية، يجب أن تتم تنقية البروتين عن باقي مكونات الخلية. تبدأ هذه العملية عادة بتحلل الخلية، حيث يتمزق الغشاء الخلوي وتنسكب مكوناتها في محلول يُعرف بمحلول الانحلال الخام. يمكن تنقية الخليط الناتج باستخدام الطرد المركزي الفائق والذي يُجزأ مكونات الخلية إلى أجزاء تحوي بروتينات قابلة للذوبان، لبيدات وبروتينات غشائية، عضيات خلوية وأحماض نووية، ويمكن للترسيب بواسطة طريقة تُعرف بالفصل بالتمليح أن يركز البروتينات من هذا الخليط الخام. بعدها تُستخدم مختلف طرق الاستشراب لعزل البروتين أو البروتينات المستهدفة بناء على خصائصٍ مثل الوزن الجزيئي، الشحنة الصافية وألفة الترابط.[45] يمكن مراقبة مستوى التنقية باستخدام مختلف أنواع الرحلان الهلامي إن كان الوزن الجزيئي للبروتين المرغوب فيه ونقطة تساوي الكهربائية الخاصة به معروفين، وبواسطة المطيافية إن كان للبروتين خصائص طيفية مميزة، أو بواسطة المقايسة الأنزيمية إن كان للبروتين نشاط إنزيمي. فضلا عن ذلك، يمكن عزل البروتينات تبعا لشحناتها باستخدام البأر متساوي التكهرب.[46]
بالنسبة للبروتينات الطبيعية، قد تكون هنالك ضرورة لسلسلة من خطوات التنقية للحصول على بروتين منقى بشكل كافٍ للاستخدامات المخبرية. لتبسيط هذه العملية غالبا ما تُستخدم الهندسة الوراثية لإضافة ميزات كيميائية إضافية للبروتينات تجعلها أسهل للتنقية من دون التأثير على بنيتها أو نشاطها. يتكون «الوسم» من تسلسل أحماض أمينية محددة، في الغالب وحدات هستيدين (واسم هستيدين)، يتم ربطه بإحدى نهايات البروتين، وكنتيجة لذلك حين يمر المحلول الخام بشريط استشراب يحتوي على النيكل فإن وحدات الهستيدين ترتبط بالنيكل وتلتصق بالشريط، في حين أن المكونات غير الموسومة من المحلول الخام تمر من دون عوائق. تم تطوير العديد من الواسمات لمساعدة الباحثين على تنقية بروتينات محددة من خلائط معقدة.[47]
التحديد داخل الخلية
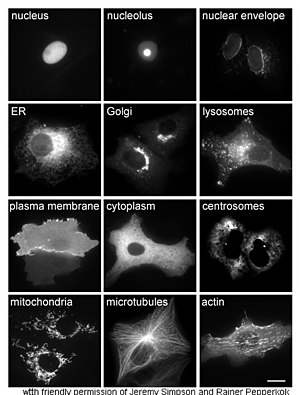
تهتم دراسة البروتينات في الكائنات الحية بطريقة تخليق البروتينات وتحديد أماكن نشاطها داخل الخلية. رغم أنه يتم تخليق العديد من البروتينات داخل الخلوية في السيتوبلازم ويتم تخليق البروتينات المرتبط بالغشاء أو المفرزة في الشبكة الإندوبلازمية إلا أن تفاصيل كيفية توجيه هذه البروتينات إلى عضيات وبنى خلوية محددة يبقى غير واضح في أحيان كثيرة. تستخدم إحدى تقنيات تقييم التحديد الخلوي للبروتينات الهندسة الوراثية للتعبير عن بروتين اندماجي أو مهجن في الخلية والذي يتكون من البروتين المستهدف بالإضافة إلى ربطه بـ«مخبر» مثل البروتين الفلوري الأخضر (GFP).[48] يمكن مراقبة مكان البروتين المهجن داخل الخلية بوضوح وكفاءة باستخدام المجهرية [49] كما هو مبين بالشكل المقابل.
من الطرق الأخرى المستخدمة في توضيح المكان الخلوي للبروتينات هي الواسمات الحيزية لمناطق مثل: الشبكة الإندوبلازمية، جهاز غولجي، الجسيمات الحالة أو الفجوات العصارية، الغشاء البلازمي. باستخدام مختلف الواسمات المؤشرَة بالفلورية أو أجسام مضادة ذات واسمات معروفة، أصبح تحديد مكان البروتين المستهدف أكثر سهولة. على سبيل المثال: سيسمح التألق المناعي اللامباشر بالتوضع التشاركي الفلوري وإثبات المكان. تستخدم الصباغ الفلورية لوسم الأحياز الخلوية لهدف مماثل.[50]
هنالك إمكانيات أخرى للتحديد الخلوي وعلى سبيل المثال: تستخدم الكيمياء النسيجية المناعية جسما مضادا لبروتين أو عدة بروتينات مستهدفة، وهذه البروتينات ترافق إنزيمات تُظهر إشارات إما ضوئية أو استشرابية يمكن مقارنة عيناتها، وهذا يتيح معلومات عن التحديد الخلوي. تقنية أخرى قابلة للتطبيق هي التجزئة المشتركة في مدروج السكروز (أو مركبات أخرى) باستخدام الطرد المركزي التبايني.[51] في حين أن هذه التقنية لا تثبت التوضع التشاركي لحيز معروف الكثافة وكذلك لبروتين مستهدف، إلا أنها تزيد من احتماليته، وهي مطاوعة أكثر في الدراسات الكبيرة.
أخيرا، طريقة الذهب المعيارية في التحديد الخلوي هي استجهار إلكتروني مناعي، تستخدم هذه التقنية كذلك جسما مضادا للبروتين المستهدف جنبا إلى جنب مع تقنيات المجهرية الإلكترونية الكلاسيكية. تُحضّر العينة لفحصٍ عادي بالمجهر الإلكتروني وبعد ذلك تعالج بالجسم المضاد للبروتين المستهدف والذي يرافق مادة شديدة الكثافة الإلكترونية وتكون في الغالب الذهب. هذا يسمح بتحديد كل من البروتين المستهدف وكذلك تفاصيل البنية المستدقة.[52]
يوجد تطبيق هندسة وراثية آخر يعرف بالتطفر نوعي الموقع، يقوم فيه الباحثون بتغيير تسلسل البروتين وبذلك تتغير كذلك: بنيته، موقعه الخلوي وقابليته للتعديل. تسمح هذه التقنية بإدراج أحماض أمينية غير طبيعية في البروتينات باستخدام جزيئات رنا ناقل معدلة،[53] وقد تسمح بالتصميم المنطقي لبروتينات جديدة بخصائص مستحدثة.[54]
بروتيوميات

مجموع البروتينات الموجودة في وقت معين في خلية أو نوع خلية يُعرف بالبروتيوم، والدراسة التي تخص هذه البروتينات والبيانات الكبيرة الناتجة عنها تسمى بروتيوميات أو علم البروتين. من التقنيات الأساسية في علم البروتين نجد: الرحلان الهلامي ثنائي الأبعاد والتي تسمح بفصل عدد كبير من البروتينات،[55] مطيافية الكتلة والتي تسمح بتحديد سريع وعالي الدقة للبروتينات ومعرفة تسلسل الببتيدات (في الغالب بعد الانهضام في الهلام)،[56] مصفوفات البروتين الدقيقة والتي تسمح بالكشف عن المستويات النسبية لأعداد كبيرة من البروتينات المتواجدة في الخلية، فحص التهجين الثنائي والذي يسمح بالاستكشاف المنهجي لتآثرات بروتين-بروتين.[57] يُعرف المجموع الكامل للتآثرات البيولوجية الممكنة في الخلية بين مختلف الجزيئات البيولوجية بالتآثروم.[58] تُعرف الدراسة المنهجية التي تحاول تحديد بنيات البروتينات بتمثيل كل تطو ممكن بعلم الجينوم البنيوي.[59]
المعلوماتية الحيوية
تم تطوير العديد من الطرق الحاسوبية لاختبار بُنى، وظائف، وتطور البروتينات. تطوير مثل هذه التقنيات تم بسبب كمية البيانات الكبيرة عن البروتينات والجينات من مختلف الكائنات، بما في ذلك الجينوم البشري. من المستحيل دراسة جميع البروتينات تجريبيا، إذ لا يتم سوى القيام بتجارب مخبرية على البعض منها فقط في حين تُستخدم الوسائل الحاسوبية للاستدلال على البروتينات المماثلة. يمكن تحديد مثل هذه البروتينات المتماثلة بكفاءة في الكائنات ذات الصلة البعيدة عبر التراصف التسلسلي. يمكن البحث في تسلسلات الجينات على خصائص محددة بواسطة وسائل مختلفة. يمكن لأدوات توصيف تسلسل إيجاد مواقع إنزيمات الاقتطاع، إطارات القراءة المفتوحة في التسلسللات النوكليوتيدية، والتنبؤ بالبنى الثانوية. يمكن إنشاء أشجار تطور السلالات وفرضيات التطور باستخدام برنامج خاص مثل كلوستال وذلك فيما يخص أسلاف الكائنات الحديثة والجينات التي يعبرون عنها. مجال المعلوماتية الحيوية الآن لا غنى عنه في دراسة الجينات والبروتينات.
تحديد البنية
اكتشاف البنية الثالثية لبروتينٍ أو البنية الرابعية لمركباته يمكن أن يقدم معلومات مهمة حول طريقة قيام هذا البروتين بوظيفته. من الطرق التجريبية الشائعة لتحديد البنية: دراسة البلورات بالأشعة السينية ومطيافية الرنين المغناطيسي النووي للبروتين، حيث يمكن لكلاهما توفير معلومات على المستوى الذري، بيد أنه يمكن لمطيافية الرنين المغناطيسي النووي أن توفر معلومات يمكن أن تُقدّر منها مجموعة جزئية من الأبعاد بين أزواج الذرات، ويتم تحديد التركيبة النهائية الممكنة للبروتين بحل مسألة البعد الهندسي. قياس التداخل ثنائي الاستقطاب هي طريقة كمية تحليلية لقياس بنية البروتين الإجمالية والتغيرات في شكلها بسبب التآثرات أو المنبهات الأخرى. ازدواج اللون الدائري هي تقنية مخبرية أخرى لتحديد صفائح بيتا ولوالب ألفا الداخلية المكونة للبروتينات. يُستخدم المجهر الإلكتروني البردي لإنتاج معلومات بنيوية ذات دقة منخفضة حول المركبات البروتينية الكبيرة جدا، بما في ذلك الفيروسات المجمعة،[60] متغيرة تعرف باسم علم البلورات الإلكتروني يمكن أن تُنتج معلومات عالية الدقة في بعض الحالات، خاصة بالنسبة لبلورات البروتينات الغشائية ثنائية الأبعاد.[61] يتم وضع البنى التي تم تحديدها في بنك بيانات البروتينات، وهو مصدر مجاني متوفر يمكن الحصول منه على المعلومات البنيوية لآلاف البروتينات على هيئة إحداثيات ديكارتية لكل ذرة في البروتين.[62]
عدد الجينات المعروفِ تسلسلها أكبر بكثير من بنى بروتيناتها. مجموعة البنى المكتشفة مبني على أساس البروتينات التي يمكن إخضاعها بسهولة للشروط المطلوبة في علم البلورات السيني وهي إحدى أكبر الطرق في تحديد البنى. بشكل خاص، البروتينات الكروية سهلة للبلورة تحضيرا للفحص بالأشعة السينية. في المقابل، البروتينات الغشائية صعبة التبلور وهي ناقصة في بنك بيانات البروتينات.[63] مبادرات علم الجينوم البنيوي حاولت علاج هذا القصور بالحل المنهجي للبنيات التمثيلية لأقسام الطيات الرئيسية. تحاول طرق التنبؤ ببنية البروتين توفير وسائل لتوليد بنية معقولة للبروتينات التي لم يتم تحديد بُناها تجريبيا.[64]
التنبؤ بالبنية ومحاكاتها

في تكاملٍ مع علم الجينوم البنيوي، يطور علم التنبؤ ببنية البروتين نماذج رياضية للتنبؤ حاسوبيا بالبنية الجزيئية (نظريا)، وذلك بدل تحديد البُنى بالملاحظات والتجارب المخبرية.[65] يعتمد أكثر أنواع التنبؤ بالبنية نجاحا - المعروف باسم محاكاة المجانسة - على وجود بنية «قالب» لها تسلسل مماثل للبروتين الذي تتم نمذجته، هدف علم الجينوم البنيوي هو توفير تمثيلات كافية للبنى التي تم تحديدها وذلك لنمذجة بنى البروتينات الباقية.[66] رغم صعوبة إنتاج نماذج دقيقة حين لا تتوفر سوى قوالب بنيوية ذات صلة بعيدة، فقد تمت الإشارة إلى أن التراصف التسلسلي هو عنق الزجاجة في هذه العملية، حيث يمكن إنتاج نماذج دقيقة للبروتينات إن عُرف تراصف تسلسل مثالي لها.[67] عملت العديد من طرق التنبؤ بالبنية كتمهيد لظهور مجال هندسة البروتين، والذي تم فيه تصميم طيات بروتينات جديدة.[68] توجد مسألة حاسوبية أكثر تعقيدا وهي التنبؤ بالتآثرات بين الجزيئية مثل الرسو الجزيئي، التنبؤ بتآثر بروتين-بروتين.[69]
النماذج الرياضية لمحاكاة عمليات حركية لتطوي البروتين وترابطه يُعنى بها علم الميكانيكا الجزيئية وبشكل خاص الديناميكا الجزيئية. تسهل تقنيات مونت كارلو الحسابات، وهي مبنية على طرق متقدمة في الحوسبة الموزعة والموازية (على سبيل المثال مشروع فولدنغ@هوم [70] الذي يقوم بنمذجة جزيئية على معالجات رسومية). تم الاكتشاف بالمحاكاة الحاسوبية تطوي نطاقات بروتينية صغيرة من نوع لولب ألفا كما هو الحال في الجزء العلوي للفيلين [71] والبروتين الملحق لفيروس العوز المناعي البشري.[72] طرق هجينة تجمع الديناميكا الجزيئية القياسية مع رياضيات ميكانيكا الكم تسبر الحالة الإلكترونية للرودوبسين.[73]
التنبؤ ببنية البروتين غير المنتظم والمضطرب
تملك العديد من البروتينات (33% لدى حقيقيات النوى) أجزاء غير منتظمة البنية لكن لها وظيفة بيولوجية، ويمكن تصنيف هذه البروتينات كبروتينات مضطربة ذاتيا.[74] التنبؤ باضطراب البروتين واختباره جزء مهم من تحديد خصائص بنية البروتين.[75]
التغذية
يمكن لمعظم الكائنات الدقيقة والنباتات أن تُخلّق حيويا جميع الأحماض الأمينية القياسية الـ20 ، في حين أن الحيوانات (بما في ذلك الإنسان) يجب أن يحصل على بعض الأحماض الأمينية من غذائه.[29] الأحماض الأمينية التي لا يمكن للكائن تخليقها بمفرده يشار إليها بالأحماض الأمينية الضرورية. الإنزيمات الأساسية المسؤولة عن تخليق بعض الأحماض الأمينية غير متواجدة لدى الحيونات كمثال كيناز الأسبارتات والذي يحفز الخطوة الأولى في تخليق الليسين والميثيونين والثريونين من الأسبارتات. إن كانت الأحماض الأمينية متواجدة في المحيط، فيمكن للكائنات الدقيقة الحفاظ على الطاقة بأخذ الأحماض الأمينية من محيطها وتخفيض مساراتها التخليقية الحيوية.
لدى الحيوانات، يتم الحصول على الأحماض الأمينية عبر استهلاك الأطعمة التي تحتوي على البروتين. وبعد ذلك تُحلّل البروتينات المستهلكة إلى أحماض أمينية عبر عملية الهضم والتي يتم فيها فك البروتين عبر تعريضه للحمض والحلمأة بواسطة إنزيمات تسمى بروتيازات. تُستخدم بعض الأحماض الأمينية المستهلكة في التخليق الحيوي للبروتين، في حين يتم تحويل أخرى إلى جلوكوز عبر عملية استحداث الجلوكوز، أو يتم إدراجها في دورة حمض الستريك. هذا الاستخدام للبروتين كوقود مهم جزئيا تحت شروط التضور جوعا لأنه يسمح باستخدام بروتينات الجسد الذاتية لدعم الحياة، وخاصة البروتينات الموجودة في العضلات.[76]
تحافظ البروتينات لدى حيوانات مثل الكلاب والقطط على صحة ونوعية الجلد بتعزيز نمو جريب الشعرة والتقرن، وبذلك تقليل احتمال إنتاج مشاكل الجلد للروائح الكريهة.[77] لدى البروتينات رديئة النوعية دور كذلك فيما يخص صحة الجهاز الهضمي، حيث تزيد إمكانية مركبات إطلاق الريح والمركبات ذي الرائحة الكريهة لدى الكلاب لأنه لدى وصول البروتينات إلى القولون وهي غير مهضومة يتم تخميرها وينتج من ذلك غاز كبريتيد الهيدروجين، الإندول والسكاتول.[78] تهضم الكلاب والقطط البروتينات الحيوانية بشكل أفضل من البروتينات النباتية لكن هضم المنتجات الحيوانية رديئة النوعية سيئ بما في ذلك الجلد، الريش والنسيج الضام.[78]
التاريخ والتأثيل
عُرفت البروتينات على أنها قسم مميز من الجزيئات البيولوجية في القرن الثامن عشر بواسطة أنطوان فرانسوا فوركروي وآخرين، تم تميزها بواسطة قدرة جزيئاتها على التجلط أو التندّف عند معالجتها بالحرارة أو الأحماض.[79] من الأمثلة الملاحظة في ذلك الوقت: الألبومين من بياض البيض، ألبومين مصل الدم، الفايبرين وغلوتين القمح.
وُصفت البروتينات أول مرة بواسطة بواسطة الكيميائي الهولندي جيراردوس يوهانس مولدر وسماها الكيميائي السويدي يونس ياكوب بيرسيليوس سنة 1838.[80][81] قام مولدر بالاختبارات الأولية على لبروتينات الشائعة ووجد أن لدى معظم البروتينات تقريبا نفس الصيغة المجملة C400H620N100O120P1S1.[82] وخلص إلى خلاصة خاطئة مفادها أن البروتينات يمكن أن تكون مكونة من نوع واحد (طويل جدا) من الجزيئات. اقتُرح المصطلح «بروتين» لوصف هذه الجزيئات من قبل مساعد مولدر يونس بيرسيليوس، البروتين مشتق من الكلمة الإغريقية πρώτειος (بروتيوس) بمعنى «أولى»،[83] «في الصدارة» أو «الوقوف في الطليعة»، [84] بالإضافة إلى اللاحقة (in، ين) والتي تلحق نهاية مختلف المركبات الكيميائية. قام مولدر بتحديد نواتج تحليل البروتين كمثال: الحمض الأميني لوسين الذي عثر له على وزن جزيئي - صحيح تقريبا- يبلغ 131 دا.[82] قبل استعمال مصطلح البروتين، استُخدمت أسماء أخرى مثل «ألبومين» أو «مواد ألبومينية» و (Eiweisskörper في ألمانيا).[85]
اعتقد علماء التغذية الأولون مثل كارل فون فويت أن البروتينات هي الغذاء الأكثر أهمية للحفاظ على بنية الجسد، لأنه كان يُعتقد بشكل عام أن «اللحم يصنع اللحم».[86] وسّع كارل هاينريش ريتهاوزن أشكال البروتينات المعروفة بتحديد حمض الجلوتاميك. وفي مركز كونيتيكت للتجربة الزراعية، تم تجميع مراجعة حول البروتينات النباتية بواسطة توماس بور أوزبورن، الذي عمل مع لافاييت مندل على تطبيق قانون القلة لليبج في إطعام الجرذان المخبرية وتحديد الأحماض الأمينية الأساسية في التغذية، وتواصل العمل في المركز بتنسيق من وليام كومينغ روز. فهمُ البروتينات على أنها عديدات ببتيد كان بفضل عمل فرانز هوفمايستر وهيرمان إميل فيشر سنة 1902.[87][88] الدور الأساسي للبروتينات كأنزيمات لم يتم إدراكه جيدا حتى عام 1926 حين أظهر جيمس سومنر أن إنزيم اليورياز هو في الحقيقة بروتين.[89]
صعوبة تنقية البروتينات بكميات كبيرة جعل دراستها صعبة على علماء الكيمياء الحيوية الأولين المتخصصين في البروتين، وعليه ركزت الدراسات الأولى على البروتينات التي يمكن تنقيتها بكميات كبيرة مثل: بروتينات الدم، بياض البيض، مختلف الذيفانات وإنزيمات الهضم والأيض المتحصل عليها من المسالخ. أثناء العقد 1950 قامت شركة أرمور أند كومباني بتنقية 1 كلغ من الريبونوكلياز البنكرياسي البقري الخالص وجعلته متوفرا مجانا للعلماء، هذه المبادرة ساهمت في جعل الريبونوكلياز البنكرياسي ليصبح هدفا كبيرا في الدراسة الكيميائية الحيوية لعدة عقود تالية.[82]

يعود الفضل إلى لينوس باولنغ في صحة التنبؤ ببنيات بروتين ثانوية نظامية بناء على الترابط الهيدروجيني، وهي فكرة طرحها وليام أستبري أولا سنة 1933.[90] أسهم عمل لاحق لولتر كوزمان في التمسخ [91][92] مبني جزئيا على دراسات سابقة لكاج أولرك لندرستروم-لانغ [93] في فهمٍ لتطوي البروتين والبنية المتوسَطَة بتآثرات كارهة للماء.
أول بروتين تم تحديد تسلسله هو الأنسولين بواسطة فردريك سانغر سنة 1949، حيث حدد سانغر بشكل صحيح تسلسل الأحماض الأمينية للأنسولين، وبذلك أثبت بشكل قاطع أن البروتينات تتكون من مكثورات خطية من الأحماض الأمينية، بدل سلاسل متفرعة (فرضية السيكول)،[94] وفاز بجائزة نوبل على هذا الإنجاز سنة 1958.[95]
أول بنية بروتين تم حلها (تحديدها) كانت بنيتا الهيموغلوبين والميوغلوبين بواسطة ماكس بيروتس وجون كندرو على التوالي سنة 1958.[96][97] اعتبارا من سنة 2017، يحتوي بنك بيانات البروتينات على 126060 بنية بروتينية ذرية الدقة.[98] حاليا المجهرية الإلكترونية الباردة لتجمعات الجزيئات الكبيرة [99] والتنبؤ الحاسوبي بالبنية البروتينية لنطاقات بروتينية صغيرة [100] طريقتان تقتربان من الدقة الذرية.
انظر أيضًا
- أيض البروتينات
- قيمة بيولوجية
- بي دي بي سام
- بريون
- بروتينويد
- ريبوزوم
- علم الجينوم البنيوي
- قائمة البروتينات
- البروتيدات
- تنقية البروتين
- مناعة داخلية
- مركزات بروتين الأوراق
- بروتينات حركية
- عائلة السوماتوستاتين
- صميم البروتين الشحمي
- جودة البروتين
- أطلس البروتين البشري
- أطلس جينوم السرطان
- سرتوين
- بروتين الريبوسوم
- بروتين شبيه بالدينامين 120 كيلو دالتون
المراجع
- ^ Q115858366، ص. 827، QID:Q115858366
- ^ Nelson DL، Cox MM (2005). Lehninger's Principles of Biochemistry (ط. 4th). New York, New York: W. H. Freeman and Company.
- ^ Gutteridge A، Thornton JM (نوفمبر 2005). "Understanding nature's catalytic toolkit". Trends in Biochemical Sciences. ج. 30 ع. 11: 622–9. DOI:10.1016/j.tibs.2005.09.006. PMID:16214343.
- ^ Murray et al., p. 19.
- ^ Murray et al., p. 31.
- ^ أ ب Lodish H، Berk A، Matsudaira P، Kaiser CA، Krieger M، Scott MP، Zipurksy SL، Darnell J (2004). Molecular Cell Biology (ط. 5th). New York, New York: WH Freeman and Company.
- ^ Ardejani، Maziar S.؛ Powers، Evan T.؛ Kelly، Jeffery W. (2017). "Using Cooperatively Folded Peptides To Measure Interaction Energies and Conformational Propensities". Accounts of Chemical Research. ج. 50 ع. 8: 1875–1882. DOI:10.1021/acs.accounts.7b00195. ISSN:0001-4842. PMC:5584629. PMID:28723063.
- ^ Branden C، Tooze J (1999). Introduction to Protein Structure. New York: Garland Pub. ISBN:978-0-8153-2305-1.
- ^ Murray RF، Harper HW، Granner DK، Mayes PA، Rodwell VW (2006). Harper's Illustrated Biochemistry. New York: Lange Medical Books/McGraw-Hill. ISBN:978-0-07-146197-9.
- ^ Van Holde KE، Mathews CK (1996). Biochemistry. Menlo Park, California: Benjamin/Cummings Pub. Co., Inc. ISBN:978-0-8053-3931-4. مؤرشف من الأصل في 2022-06-15.
- ^ Milo R (ديسمبر 2013). "What is the total number of protein molecules per cell volume? A call to rethink some published values". BioEssays. ج. 35 ع. 12: 1050–5. DOI:10.1002/bies.201300066. PMC:3910158. PMID:24114984.
- ^ Beck M، Schmidt A، Malmstroem J، Claassen M، Ori A، Szymborska A، Herzog F، Rinner O، Ellenberg J، Aebersold R (نوفمبر 2011). "The quantitative proteome of a human cell line". Molecular Systems Biology. ج. 7: 549. DOI:10.1038/msb.2011.82. PMC:3261713. PMID:22068332.
- ^ Wu L، Candille SI، Choi Y، Xie D، Jiang L، Li-Pook-Than J، Tang H، Snyder M (يوليو 2013). "Variation and genetic control of protein abundance in humans". Nature. ج. 499 ع. 7456: 79–82. Bibcode:2013Natur.499...79W. DOI:10.1038/nature12223. PMC:3789121. PMID:23676674.
- ^ أ ب Kozlowski LP (يناير 2017). "Proteome-pI: proteome isoelectric point database". Nucleic Acids Research. ج. 45 ع. D1: D1112–D1116. DOI:10.1093/nar/gkw978. PMC:5210655. PMID:27789699.
- ^ أ ب van Holde and Mathews, pp. 1002–42.
- ^ Dobson CM (2000). "The nature and significance of protein folding". Mechanisms of Protein Folding. Oxford, Oxfordshire: Oxford University Press. ص. 1–28. ISBN:978-0-19-963789-8.
- ^ Fulton AB، Isaacs WB (أبريل 1991). "Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis". BioEssays. ج. 13 ع. 4: 157–61. DOI:10.1002/bies.950130403. PMID:1859393.
- ^ Bruckdorfer T، Marder O، Albericio F (فبراير 2004). "From production of peptides in milligram amounts for research to multi-tons quantities for drugs of the future". Current Pharmaceutical Biotechnology. ج. 5 ع. 1: 29–43. DOI:10.2174/1389201043489620. PMID:14965208.
- ^ Schwarzer D، Cole PA (ديسمبر 2005). "Protein semisynthesis and expressed protein ligation: chasing a protein's tail". Current Opinion in Chemical Biology. ج. 9 ع. 6: 561–9. DOI:10.1016/j.cbpa.2005.09.018. PMID:16226484.
- ^ Kent SB (فبراير 2009). "Total chemical synthesis of proteins". Chemical Society Reviews. ج. 38 ع. 2: 338–51. DOI:10.1039/b700141j. PMID:19169452.
- ^ Murray et al., p. 36.
- ^ Murray et al., p. 37.
- ^ Murray et al., pp. 30–34.
- ^ SANGER F (1952). "The arrangement of amino acids in proteins". Adv. Protein Chem. ج. 7: 1–67. DOI:10.1016/S0065-3233(08)60017-0. PMID:14933251. مؤرشف من الأصل في 2020-03-08.
- ^ van Holde and Mathews, pp. 368–75.
- ^ van Holde and Mathews, pp. 165–85.
- ^ Fernández A، Scott R (سبتمبر 2003). "Dehydron: a structurally encoded signal for protein interaction". Biophysical Journal. ج. 85 ع. 3: 1914–28. Bibcode:2003BpJ....85.1914F. DOI:10.1016/S0006-3495(03)74619-0. PMC:1303363. PMID:12944304. مؤرشف من الأصل في 2019-06-09.
- ^ Davey NE، Van Roey K، Weatheritt RJ، Toedt G، Uyar B، Altenberg B، Budd A، Diella F، Dinkel H، Gibson TJ (يناير 2012). "Attributes of short linear motifs". Molecular BioSystems. ج. 8 ع. 1: 268–81. DOI:10.1039/c1mb05231d. PMID:21909575.
- ^ أ ب Voet D, Voet JG. (2004). Biochemistry Vol 1 3rd ed. Wiley: Hoboken, NJ.
- ^ Sankaranarayanan R، Moras D (2001). "The fidelity of the translation of the genetic code". Acta Biochimica Polonica. ج. 48 ع. 2: 323–35. PMID:11732604.
- ^ van Holde and Mathews, pp. 830–49.
- ^ Copland JA، Sheffield-Moore M، Koldzic-Zivanovic N، Gentry S، Lamprou G، Tzortzatou-Stathopoulou F، Zoumpourlis V، Urban RJ، Vlahopoulos SA (يونيو 2009). "Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible?". BioEssays. ج. 31 ع. 6: 629–41. DOI:10.1002/bies.200800138. PMID:19382224.
- ^ Samarin S، Nusrat A (يناير 2009). "Regulation of epithelial apical junctional complex by Rho family GTPases". Frontiers in Bioscience. ج. 14 ع. 14: 1129–42. DOI:10.2741/3298. PMID:19273120.
- ^ Bairoch A (يناير 2000). "The ENZYME database in 2000" (PDF). Nucleic Acids Research. ج. 28 ع. 1: 304–5. DOI:10.1093/nar/28.1.304. PMC:102465. PMID:10592255. مؤرشف من الأصل (PDF) في 2011-06-01. اطلع عليه بتاريخ 2018-12-09.
- ^ Radzicka A، Wolfenden R (يناير 1995). "A proficient enzyme". Science. ج. 267 ع. 5194: 90–3. Bibcode:1995Sci...267...90R. DOI:10.1126/science.7809611. PMID:7809611.
- ^ EBI External Services (20 يناير 2010). "The Catalytic Site Atlas at The European Bioinformatics Institute". Ebi.ac.uk. مؤرشف من الأصل في 2018-09-27. اطلع عليه بتاريخ 2011-01-16.
- ^ Pickel B، Schaller A (أكتوبر 2013). "Dirigent proteins: molecular characteristics and potential biotechnological applications". Applied Microbiology and Biotechnology. ج. 97 ع. 19: 8427–38. DOI:10.1007/s00253-013-5167-4. PMID:23989917.
- ^ Branden and Tooze, pp. 251–81.
- ^ van Holde and Mathews, pp. 247–50.
- ^ van Holde and Mathews, pp. 220–29.
- ^ Rüdiger H، Siebert HC، Solís D، Jiménez-Barbero J، Romero A، von der Lieth CW، Diaz-Mariño T، Gabius HJ (أبريل 2000). "Medicinal chemistry based on the sugar code: fundamentals of lectinology and experimental strategies with lectins as targets". Current Medicinal Chemistry. ج. 7 ع. 4: 389–416. DOI:10.2174/0929867003375164. PMID:10702616.
- ^ Branden and Tooze, pp. 232–34.
- ^ van Holde and Mathews, pp. 178–81.
- ^ van Holde and Mathews, pp. 258–64; 272.
- ^ Murray et al., pp. 21–24.
- ^ Hey J، Posch A، Cohen A، Liu N، Harbers A (2008). Fractionation of complex protein mixtures by liquid-phase isoelectric focusing. ص. 225–39. DOI:10.1007/978-1-60327-064-9_19. ISBN:978-1-58829-722-8. PMID:18369866. مؤرشف من الأصل في 2020-01-11.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ Terpe K (يناير 2003). "Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems". Applied Microbiology and Biotechnology. ج. 60 ع. 5: 523–33. DOI:10.1007/s00253-002-1158-6. PMID:12536251.
- ^ Stepanenko OV، Verkhusha VV، Kuznetsova IM، Uversky VN، Turoverov KK (أغسطس 2008). "Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes". Current Protein & Peptide Science. ج. 9 ع. 4: 338–69. DOI:10.2174/138920308785132668. PMC:2904242. PMID:18691124.
- ^ Yuste R (ديسمبر 2005). "Fluorescence microscopy today". Nature Methods. ج. 2 ع. 12: 902–4. DOI:10.1038/nmeth1205-902. PMID:16299474.
- ^ Margolin W (يناير 2000). "Green fluorescent protein as a reporter for macromolecular localization in bacterial cells". Methods. ج. 20 ع. 1: 62–72. DOI:10.1006/meth.1999.0906. PMID:10610805. مؤرشف من الأصل في 2019-06-09.
- ^ Walker JH، Wilson K (2000). Principles and Techniques of Practical Biochemistry. Cambridge, UK: Cambridge University Press. ص. 287–89. ISBN:978-0-521-65873-7.
- ^ Mayhew TM، Lucocq JM (أغسطس 2008). "Developments in cell biology for quantitative immunoelectron microscopy based on thin sections: a review". Histochemistry and Cell Biology. ج. 130 ع. 2: 299–313. DOI:10.1007/s00418-008-0451-6. PMC:2491712. PMID:18553098.
- ^ Hohsaka T، Sisido M (ديسمبر 2002). "Incorporation of non-natural amino acids into proteins". Current Opinion in Chemical Biology. ج. 6 ع. 6: 809–15. DOI:10.1016/S1367-5931(02)00376-9. PMID:12470735.
- ^ Cedrone F، Ménez A، Quéméneur E (أغسطس 2000). "Tailoring new enzyme functions by rational redesign". Current Opinion in Structural Biology. ج. 10 ع. 4: 405–10. DOI:10.1016/S0959-440X(00)00106-8. PMID:10981626.
- ^ Görg A، Weiss W، Dunn MJ (ديسمبر 2004). "Current two-dimensional electrophoresis technology for proteomics". Proteomics. ج. 4 ع. 12: 3665–85. DOI:10.1002/pmic.200401031. PMID:15543535.
- ^ Conrotto P، Souchelnytskyi S (سبتمبر 2008). "Proteomic approaches in biological and medical sciences: principles and applications". Experimental Oncology. ج. 30 ع. 3: 171–80. PMID:18806738.
- ^ Koegl M، Uetz P (ديسمبر 2007). "Improving yeast two-hybrid screening systems". Briefings in Functional Genomics & Proteomics. ج. 6 ع. 4: 302–12. DOI:10.1093/bfgp/elm035. PMID:18218650. مؤرشف من الأصل في 2017-09-11.
- ^ Plewczyński D، Ginalski K (2009). "The interactome: predicting the protein-protein interactions in cells". Cellular & Molecular Biology Letters. ج. 14 ع. 1: 1–22. DOI:10.2478/s11658-008-0024-7. PMID:18839074.
- ^ Zhang C، Kim SH (فبراير 2003). "Overview of structural genomics: from structure to function". Current Opinion in Chemical Biology. ج. 7 ع. 1: 28–32. DOI:10.1016/S1367-5931(02)00015-7. PMID:12547423.
- ^ Branden and Tooze, pp. 340–41.
- ^ Gonen T، Cheng Y، Sliz P، Hiroaki Y، Fujiyoshi Y، Harrison SC، Walz T (ديسمبر 2005). "Lipid-protein interactions in double-layered two-dimensional AQP0 crystals". Nature. ج. 438 ع. 7068: 633–8. Bibcode:2005Natur.438..633G. DOI:10.1038/nature04321. PMC:1350984. PMID:16319884.
- ^ Standley DM، Kinjo AR، Kinoshita K، Nakamura H (يوليو 2008). "Protein structure databases with new web services for structural biology and biomedical research". Briefings in Bioinformatics. ج. 9 ع. 4: 276–85. DOI:10.1093/bib/bbn015. PMID:18430752. مؤرشف من الأصل في 2020-03-12.
- ^ Walian P، Cross TA، Jap BK (2004). "Structural genomics of membrane proteins". Genome Biology. ج. 5 ع. 4: 215. DOI:10.1186/gb-2004-5-4-215. PMC:395774. PMID:15059248. مؤرشف من الأصل في 2016-01-02.
- ^ Sleator RD (2012). Prediction of protein functions. Methods in Molecular Biology. ج. 815. ص. 15–24. DOI:10.1007/978-1-61779-424-7_2. ISBN:978-1-61779-423-0. PMID:22130980.
- ^ Zhang Y (يونيو 2008). "Progress and challenges in protein structure prediction". Current Opinion in Structural Biology. ج. 18 ع. 3: 342–8. DOI:10.1016/j.sbi.2008.02.004. PMC:2680823. PMID:18436442.
- ^ Xiang Z (يونيو 2006). "Advances in homology protein structure modeling". Current Protein & Peptide Science. ج. 7 ع. 3: 217–27. DOI:10.2174/138920306777452312. PMC:1839925. PMID:16787261.
- ^ Zhang Y، Skolnick J (يناير 2005). "The protein structure prediction problem could be solved using the current PDB library". Proceedings of the National Academy of Sciences of the United States of America. ج. 102 ع. 4: 1029–34. Bibcode:2005PNAS..102.1029Z. DOI:10.1073/pnas.0407152101. PMC:545829. PMID:15653774. مؤرشف من الأصل في 2020-03-08.
- ^ Kuhlman B، Dantas G، Ireton GC، Varani G، Stoddard BL، Baker D (نوفمبر 2003). "Design of a novel globular protein fold with atomic-level accuracy". Science. ج. 302 ع. 5649: 1364–8. Bibcode:2003Sci...302.1364K. DOI:10.1126/science.1089427. PMID:14631033. مؤرشف من الأصل في 2020-03-08.
- ^ Ritchie DW (فبراير 2008). "Recent progress and future directions in protein-protein docking". Current Protein & Peptide Science. ج. 9 ع. 1: 1–15. CiteSeerX:10.1.1.211.4946. DOI:10.2174/138920308783565741. PMID:18336319.
- ^ Scheraga HA، Khalili M، Liwo A (2007). "Protein-folding dynamics: overview of molecular simulation techniques". Annual Review of Physical Chemistry. ج. 58: 57–83. Bibcode:2007ARPC...58...57S. DOI:10.1146/annurev.physchem.58.032806.104614. PMID:17034338.
- ^ Zagrovic B، Snow CD، Shirts MR، Pande VS (نوفمبر 2002). "Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing". Journal of Molecular Biology. ج. 323 ع. 5: 927–37. CiteSeerX:10.1.1.142.8664. DOI:10.1016/S0022-2836(02)00997-X. PMID:12417204.
- ^ Herges T، Wenzel W (يناير 2005). "In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field". Physical Review Letters. ج. 94 ع. 1: 018101. arXiv:physics/0310146. Bibcode:2005PhRvL..94a8101H. DOI:10.1103/PhysRevLett.94.018101. PMID:15698135.
- ^ Hoffmann M، Wanko M، Strodel P، König PH، Frauenheim T، Schulten K، Thiel W، Tajkhorshid E، Elstner M (أغسطس 2006). "Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II". Journal of the American Chemical Society. ج. 128 ع. 33: 10808–18. DOI:10.1021/ja062082i. PMID:16910676.
- ^ Ward JJ، Sodhi JS، McGuffin LJ، Buxton BF، Jones DT (مارس 2004). "Prediction and functional analysis of native disorder in proteins from the three kingdoms of life". Journal of Molecular Biology. ج. 337 ع. 3: 635–45. CiteSeerX:10.1.1.120.5605. DOI:10.1016/j.jmb.2004.02.002. PMID:15019783.
- ^ Tompa، Peter؛ Fersht، Alan (18 نوفمبر 2009). Structure and Function of Intrinsically Disordered Proteins. CRC Press. ISBN:978-1-4200-7893-0. مؤرشف من الأصل في 2019-06-09.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Brosnan JT (يونيو 2003). "Interorgan amino acid transport and its regulation". The Journal of Nutrition. ج. 133 ع. 6 Suppl 1: 2068S–2072S. DOI:10.1093/jn/133.6.2068S. PMID:12771367. مؤرشف من الأصل في 2009-04-14.
- ^ Watson TD (1998). "Diet and skin disease in dogs and cats". The Journal of Nutrition. ج. 128 ع. 12 Suppl: 2783S–2789S. DOI:10.1093/jn/128.12.2783S. PMID:9868266. مؤرشف من الأصل في 2017-11-11.
- ^ أ ب Case LP، Daristotle L، Hayek MG، Raasch MF (2010). Canine and Feline Nutrition-E-Book: A Resource for Companion Animal Professionals. Elsevier Health Sciences.
- ^ Thomas Burr Osborne (1909): The Vegetable Proteins, History pp 1 to 6, from أرشيف الإنترنت "نسخة مؤرشفة". مؤرشف من الأصل في 2016-08-29. اطلع عليه بتاريخ 2018-12-09.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Mulder GJ (1838). "Sur la composition de quelques substances animales". Bulletin des Sciences Physiques et Naturelles en Néerlande: 104. مؤرشف من الأصل في 2020-01-11.
- ^ Harold، Hartley (1951). "Origin of the Word 'Protein.'". Nature. ج. 168 ع. 4267: 244. Bibcode:1951Natur.168..244H. DOI:10.1038/168244a0.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ أ ب ت Perrett D (أغسطس 2007). "From 'protein' to the beginnings of clinical proteomics". Proteomics: Clinical Applications. ج. 1 ع. 8: 720–38. DOI:10.1002/prca.200700525. PMID:21136729.
- ^ New Oxford Dictionary of English
- ^ Reynolds JA، Tanford C (2003). Nature's Robots: A History of Proteins (Oxford Paperbacks). New York, New York: Oxford University Press. ص. 15. ISBN:978-0-19-860694-9.
- ^ Reynolds and Tanford (2003).
- ^ Bischoff TL, Voit C (1860). Die Gesetze der Ernaehrung des Pflanzenfressers durch neue Untersuchungen festgestellt (بالألمانية). Leipzig, Heidelberg.
{{استشهاد بكتاب}}: صيانة الاستشهاد: مكان بدون ناشر (link) - ^ "Hofmeister, Franz". encyclopedia.com. مؤرشف من الأصل في 2019-03-30. اطلع عليه بتاريخ 2017-04-04.
- ^ "Protein, section: Classification of protein". britannica.com. مؤرشف من الأصل في 2019-04-12. اطلع عليه بتاريخ 2017-04-04.
- ^ Sumner JB (1926). "The isolation and crystallization of the enzyme urease. Preliminary paper". Journal of Biological Chemistry. ج. 69 ع. 2: 435–41. مؤرشف من الأصل (PDF) في 2020-03-12.
- ^ Pauling L، Corey RB (مايو 1951). "Atomic coordinates and structure factors for two helical configurations of polypeptide chains" (PDF). Proceedings of the National Academy of Sciences of the United States of America. ج. 37 ع. 5: 235–40. Bibcode:1951PNAS...37..235P. DOI:10.1073/pnas.37.5.235. PMC:1063348. PMID:14834145. مؤرشف من الأصل (PDF) في 2015-09-24. اطلع عليه بتاريخ 2020-09-23.
- ^ Kauzmann W (مايو 1956). "Structural factors in protein denaturation". Journal of Cellular Physiology. ج. 47 ع. Suppl 1: 113–31. DOI:10.1002/jcp.1030470410. PMID:13332017.
- ^ Kauzmann W (1959). Some factors in the interpretation of protein denaturation. Advances in Protein Chemistry. ج. 14. ص. 1–63. DOI:10.1016/S0065-3233(08)60608-7. ISBN:978-0-12-034214-3. PMID:14404936.
- ^ Kalman SM، Linderstrøm-Lang K، Ottesen M، Richards FM (فبراير 1955). "Degradation of ribonuclease by subtilisin". Biochimica et Biophysica Acta. ج. 16 ع. 2: 297–9. DOI:10.1016/0006-3002(55)90224-9. PMID:14363272.
- ^ Sanger F (1949). "The terminal peptides of insulin". The Biochemical Journal. ج. 45 ع. 5: 563–74. PMC:1275055. PMID:15396627.
- ^ Sanger F. (1958)، Nobel lecture: The chemistry of insulin (PDF)، Nobelprize.org، مؤرشف من الأصل (PDF) في 10 أغسطس 2017، اطلع عليه بتاريخ أكتوبر 2020
{{استشهاد}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Muirhead H، Perutz MF (أغسطس 1963). "Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 Å resolution". Nature. ج. 199 ع. 4894: 633–8. Bibcode:1963Natur.199..633M. DOI:10.1038/199633a0. PMID:14074546.
- ^ Kendrew JC، Bodo G، Dintzis HM، Parrish RG، Wyckoff H، Phillips DC (مارس 1958). "A three-dimensional model of the myoglobin molecule obtained by x-ray analysis". Nature. ج. 181 ع. 4610: 662–6. Bibcode:1958Natur.181..662K. DOI:10.1038/181662a0. PMID:13517261.
- ^ "RCSB Protein Data Bank". مؤرشف من الأصل في 2015-04-18. اطلع عليه بتاريخ 2017-01-19.
- ^ Zhou ZH (أبريل 2008). "Towards atomic resolution structural determination by single-particle cryo-electron microscopy". Current Opinion in Structural Biology. ج. 18 ع. 2: 218–28. DOI:10.1016/j.sbi.2008.03.004. PMC:2714865. PMID:18403197.
- ^ Keskin O، Tuncbag N، Gursoy A (أبريل 2008). "Characterization and prediction of protein interfaces to infer protein-protein interaction networks". Current Pharmaceutical Biotechnology. ج. 9 ع. 2: 67–76. DOI:10.2174/138920108783955191. PMID:18393863.
وصلات خارجية
- Proteins (the journal), also called "Proteins: Structure, Function, and Bioinformatics" and previously "Proteins: Structure, Function, and Genetics" (1986-1995).
مشاريع وقواعد بيانات
- بنك بيانات البروتينات
- UniProt مصدر معلومات البروتينات العالمي
- أطلس البروتينات البشرية
- iHOP - روابط معلومات حول البروتينات
- البروتينات: من التشكيل الحيوي إلى التفكك - المكتبة الافتراضية للكيمياء الحيوية والبيولوجيا الجزيئية
- MIT's Laboratory for Protein Molecular Self-Assembly
- Numerous publications on synthetic biomimetic protein-based biomaterials
- Amino acid metabolism
- صور البروتنيات
- برنامج لرؤية ملفات PDB على النت مباشرة
مواقع تعليمية
- Proteins: Biogenesis to Degradation - The Virtual Library of Biochemistry and Cell Biology
- Amino acid metabolism
- Data Book of Molecules - Home Page for Learning Environmental Chemistry
| في كومنز صور وملفات عن: بروتين |
- بوابة أيض
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة تقانة
- بوابة زراعة
- بوابة سمك
- بوابة صيدلة
- بوابة طب
- بوابة طبيعة
- بوابة علم الأحياء
- بوابة علم الأحياء التطوري
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم البيئة
- بوابة علم الحيوان
- بوابة علم الفيروسات
- بوابة علوم
- بوابة قروش
- بوابة مجتمع
- بوابة مطاعم وطعام