|
تضامنًا مع حق الشعب الفلسطيني |
أيض الحموض الدهنية
أيض الحموض الدهنية يتكون من عمليات هدمية أثناء الهضم بغرض توليد الطاقة في الخلية الحية و/ أو تخزينها في هيئة ATP , وعمليات بنائية تكوّن جزيئات حيوية مهمة، مثل ثلاثي الغليسريدات، والليبيدات المفسفرة، والرسول الثاني (بالإنجليزية: second messenger), والهرمونات الموضعية والأجسام الكيتونية).[1]

الأحماض الدهنية هي عائلة من الجزيئات المصنفة ضمن فئة المغذيات الكبيرة (الدهون، الكربوهيدرات والبروتينات). أحد ادوارالأحماض الدهنية في التمثيل الغذائي للحيوان هو إنتاج الطاقة لضمان حركة الإنسان، وتخزين الطاقة الزائدة عن استهلاك الجسم في الخلايا على شكل أدينوسين ثلاثي الفوسفات. عند مقارنتها بمواد المغذيات الكبيرة الأخرى (الكربوهيدرات والبروتينات)، تعطي الأحماض الدهنية معظم أدينوسين ثلاثي الفوسفات (ينتج حمض دهني مثل حمض البالمتيك 148 جزيء ATP بالجلوكوز فهو ينتج 38 ATP فقط.)، عندما يتأكسد تماما في متقدرات الخلية إلى ثاني اكسيد الكربون والماء بمساعدة دورة حمض الستريك ثم سلسلة التنفس.[2]
عن طريق هضم الدهون (أيض الدهون المأكولة) يختزن الجسم جزءا من طاقتها في هيئة جزيئات ATP في جميع الخلايا لأنها تعتبر «بطارية الخلية الحية» وما يزيد عن ذلك من الدهون يختزنها الجسم في شكل ثلاثي الغليسريد ويختزنها لوقت احتياجها عند الحركة في خلايا متخصصة وهي الخلايا الدهنية. ثلاثي الغليسريد هو الشكل الأول لتخزين الوقود في معظم الحيوانات، وبدرجة أقل في النباتات.
بالإضافة إلى إنتاج الطاقة وتخزينها في الجسم لكي يستطيع الحركة وعمل الدماغ فإن للأحماض الدهنية وظائف هامة أخرى، مثل بناء الجزيئات الدهنية الفوسفورية التي تشكل جدران الخلايا وجدران المتقدرات في طبقات ثنائية فوسفورية، والأغشية التي تكسو جميع العضيات داخل الخلايا (مثل نواة الخلية، والمتقدرات، وشبكية إندوبلازمية، وجهاز جولجي). ويمكن أن تتحد أنواع من الاحماض الدهنية بمكونات بروتينية لتشكيل هرمونات أو تستقر في غشاء الخلية لتشكيل رسل ثان داخل الخلية، والهرمونات المحلية في المنطقة المجاورة مباشرة للخلية. البروستاغلاندينات المكوّنة من حمض الأراكيدونيك المختزنة في غشاء الخلية، هي المجموعة الأكثر شهرة من هذه الهرمونات المحلية.
تكسير الأحماض الدهنية
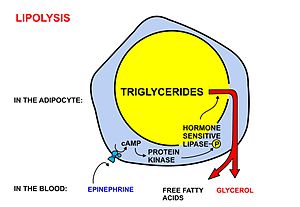

بين الوجبات الغذائية، يتم افراز الأحماض الدهنية المختزنة في الخلايا الدهنية في هيئة ثلاثي الغليسريد على النحو التالي:
- تحلل الدهون، وإزالة سلاسل الأحماض الدهنية من الجلسرين التي تكون مخزونة في الخلية الدهنية في شكل ثلاثي الغليسرين بواسطة ليباسيس. يتم تنشيط هذه الليباز عن طريق ارتفاع مستويات الإبينفرين والجلوكاجون في الدم أو إفراز بافراز الجهاز العصبي الودي في الأنسجة الدهنية، والناجمة عن انخفاض مستويات السكر في الدم بعد الوجبات، مما يقلل في وقت واحد مستوى الانسولين في الدم.[1]
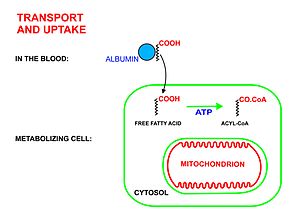
- بمجرد تحريرها من الجلسرين، الأحماض الدهنية الحرة تدخل الدم، الذي ينقلهم الدم بتحميلهم على جزيئات ألبومين البلازما إلى جميع أنحاء الجسم.[3]
- سلسلة طويلة من الأحماض الدهنية الحرة تدخل خلايا التمثيل الغذائي (أي معظم الخلايا الحية في الجسم باستثناء خلايا الدم الحمراء والخلايا العصبية في الجهاز العصبي المركزي) من خلال بروتينات النقل محددة، مثل عائلة SLC27 لنقل الأحماض الدهنية البروتينية.[4][5] لا تحتوي خلايا الدم الحمراء على متقدرات (ميتوكوندريا) وبالتالي فهي غير قادرة على استقلاب الأحماض الدهنية. أنسجة الجهاز العصبي المركزي لا يمكنه استخدام الأحماض الدهنية للحصول على الطاقة، على الرغم من احتوائه على الميتوكوندريا، وذلك بسبب أن الأحماض الدهنية هذه عبارة عن سلاسل طويلة (وليست من الأحماض الدهنية ذات سلسلة متوسطة [6][7]) لا يمكن عبور حاجز الدم في الدماغ [8] إلى السوائل الخلالية التي تستحم هذه الخلايا.
- عندما تصبح داخل الخلية، السلسلة طويلة من الأحماض الدهنية- CoA ligase يحفز التفاعل بين جزيء الحمض الدهني مع ATP (الذي يتم تقسيمه إلى أدينوسين أحادي الفوسفات AMP وفوسفات غير العضوي) لإعطاء الدهنية أسيل-أدينيلات، والذي يتفاعل بعد ذلك مع مرافق الأنزيم-أ لإعطاء جزيء Acyl-CoA الدهنية.
- ليدخل الAcyl-CoA الميتوكوندريون يستخدم المكوك الكارنيتين: [9][10][11] 1- يتم نقل Acyl CoA إلى مجموعة الهيدروكسيل من الكارنيتين بواسطة carnitine palmitoyltransferase I، وتقع على وجوه عصاري خلوي من الأغشية الميتوكوندريا الخارجية والداخلية. 2- يتم نقل Acyl carnitine في الداخل من قبل carnitine acylcarnitine translocase، كما يتم نقل الكارنيتين خارج. 3- يتم تحويل Acyl carnitine إلى Acyl CoA بواسطة carnitine palmitoyltransferase II، وتقع على الوجه الداخلي للغشاء الميتوكوندريا الداخلي. يتم نقل الكارنيتين المحرر مرة أخرى إلى العصارة الخلوية، كما يتم نقلها Acyl CoA في المصفوفة.
- ثم تقطع الأكسدة بيتا في مصفوفة الميتوكوندريا سلاسل الكربون الطويلة للأحماض الدهنية (في شكل جزيئات Acyl- CoA) في سلسلة من وحدات الكربون (أسيتات)، والتي، جنبا إلى جنب مع الإنزيم المشترك A، جزيئات Acetyl- CoA، التي تتكثف مع أوكسالو اسيتات لتشكيل سترات في «بداية» من دورة حمض الستريك. ومن المأمول التفكير في هذا التفاعل كعلامة على «نقطة الانطلاق» للدورة، وهذا هو عندما يتم إضافة الوقود - Acetyl-CoA - إلى الدورة، والتي سيتم تبديدها كما CO2 و H2O مع الإفراج عن كمية كبيرة من الطاقة التي تم التقاطها في شكل ATP، خلال كل دورة من دورة. باختصار، فإن الخطوات في أكسدة بيتا (انهيار الأولي من الأحماض الدهنية الحرة في Acetyl - CoA) هي كما يلي:[2] 1- نزع الهيدروجين بواسطة نازعة Acyl CoA، مما ينتج 1 FADH2 2- الترطيب بواسطة enoyl-CoA hydratase 3- إزالة الهيدروجين بواسطة نازعة الهيدروجين 3-hydroxyacyl-CoA dehydrogenase، مما يؤدي إلى ناد NADH + H+ 4-الانقسام بواسطة thiolase، مما أسفر عن 1 acetyl-CoA والأحماض الدهنية التي تم تقصيرها الآن من قبل 2 كربون (تشكيل جديد، تقصير Acyl-CoA) ويتكرر هذا التفاعل الأكسدة بيتا حتى تم تخفيض الأحماض الدهنية تماما إلى acetyl-CoA أو، في، حالة الأحماض الدهنية مع أعداد فردية من ذرات الكربون، أسيتيل-كوا و 1 جزيء من propionyl-CoA لكل جزيء من الأحماض الدهنية. كل قطعة أكسدة بيتا لجزيء Acyl CoA تعطي 5 جزيئات ATP.[12][13]
- Aceytl-CoA المنتجة من قبل أكسدة بيتا يدخل دورة حمض الستريك في الميتوكوندريون من خلال الجمع مع oxaloacetate لتشكيل سترات. ويؤدي ذلك إلى الاحتراق الكامل لAceytl-CoA إلى CO2 والماء. يتم التقاط الطاقة الصادرة في هذه العملية في شكل 1 GTP و 11 جزيئات ATP لكل Aceytl-CoA جزيء أكسدة.[2][14] هذا هو مصير Aceytl-CoA أينما أكسدة بيتا من الأحماض الدهنية يحدث، إلا في ظل ظروف معينة في الكبد.
- في أوكسالواسيتات الكبد يمكن تحويلها كليا أو جزئيا في مسار الجلوكونيوجين أثناء الصيام، المجاعة، اتباع نظام غذائي منخفض الكربوهيدرات، وممارسة التمارين الرياضية لفترات طويلة، وفي داء السكري من النوع 1 غير المنضبط. في ظل هذه الظروف يتم المهدرجة أوكسالواسيتات إلى مالات التي يتم إزالتها بعد ذلك من الميتوكوندريون لتحويلها إلى الجلوكوز في السيتوبلازم من خلايا الكبد، من حيث يتم إطلاقه في الدم. في الكبد، وبالتالي، أوكسالواسيتات غير متوفر للتكثيف مع Acetyl-CoA عندما تم تحفيز الغلوكونيوجينيس كبيرة من انخفاض (أو غائب) الأنسولين وارتفاع تركيزات الجلوكاجون في الدم. في ظل هذه الظروف يتم تحويل Acetyl-CoA لتشكيل أسيتوسيتات وبيتا هيدروكسي بوتيرات. أسيتوسيتات، بيتا هيدروكسي بوتيريت، ومنتج انهيار عفوية، الأسيتون، وكثيرا ما، ولكن مربكة، والمعروفة باسم الهيئات كيتون (لأنها ليست «الهيئات» على الإطلاق، ولكن المواد الكيميائية القابلة للذوبان في الماء). يتم تحرير الأجسام كيتون من قبل الكبد في الدم. يمكن لجميع الخلايا مع الميتوكوندريا أن تأخذ أجسام كيتون من الدم وتحويلها إلى Acetyl-CoA، والتي يمكن بعد ذلك أن تستخدم كوقود في دورات حامض الستريك، كما لا يمكن أن الأنسجة الأخرى تحويل أوكسالواسيتات في مسار الجلوكونيوجين في الطريقة التي يمكن أن يحدث في الكبد. وخلافا للأحماض الدهنية الحرة، يمكن لأجسام كيتون عبور حاجز الدم في الدماغ، وبالتالي فهي متاحة كوقود لخلايا الجهاز العصبي المركزي، تعمل كبديل للجلوكوز، والتي عادة ما تبقى على قيد الحياة هذه الخلايا. إن حدوث مستويات عالية من أجسام كيتون في الدم أثناء المجاعة، واتباع نظام غذائي منخفض الكربوهيدرات، وممارسة التمارين الثقيلة لفترات طويلة، وداء السكري من النوع 1 غير المنضبط يعرف باسم الكيتوسيس، وفي شكله المتطرف، في داء السكري من النوع الأول خارج نطاق السيطرة، كما الحماض الكيتوني.[14]
- الجلسرين الذي صدر عن عمل ليباز هو فوسفهوريلاتد عن طريق كيناز الجلسرين في الكبد (الأنسجة الوحيدة التي يمكن أن يحدث هذا التفاعل)، ويتجلى غليسيرول 3-فوسفات الناتجة إلى الفوسفات ديهيدروكسياسيتون. انزيم جلايكليوس تريوس الفوسفات إيزوميراز يحول هذا المركب إلى غليسيرالدهيد 3-فوسفات، والتي تتأكسد عن طريق التحلل، أو تحويلها إلى الجلوكوز عن طريق غلوكونيوجينيسيس.
وظائف واستخدامات أخرى للاحماض الدهنية
- الإشارات داخل الخلايا
- هرمونات باراكرين إيكوسانويد
المصادر الغذائية للأحماض الدهنية، وهضمها، وامتصاصها، والنقل في الدم والتخزين
يتم الحصول على نسبة كبيرة من الأحماض الدهنية في الجسم من النظام الغذائي، في شكل الدهون الثلاثية من أي حيوان أو الأصل النباتي. الأحماض الدهنية في الدهون التي تم الحصول عليها من الحيوانات البرية تميل إلى أن تكون مشبعة، في حين أن الأحماض الدهنية في الدهون الثلاثية من الأسماك والنباتات وغالبا ما تكون غير المشبعة ومن ثم تقديم الزيوت.
هذه الدهون الثلاثية، لا يمكن استيعابها من قبل الأمعاء. يتم تقسيمها إلى أحادية ودي-جليسريدس بالإضافة إلى الأحماض الدهنية الحرة (ولكن لا الجلسرين الحرة) من قبل ليباز البنكرياس، الذي يشكل مجمع 1: 1 مع بروتين يسمى كوليباس (أيضا مكون من عصير البنكرياس)، وهو أمر ضروري ل نشاطها. لا يمكن أن يعمل المجمع المنشط إلا على واجهة المياه الدهنية. ولذلك، فمن الضروري أن يتم استحلب الدهون أولا من الأملاح الصفراء للنشاط الأمثل لهذه الانزيمات. إن منتجات الهضم المكونة من خليط من ثلاثي ودي ومونوليسريد وأحماض دهنية حرة، والتي، جنبا إلى جنب مع غيرها من الدهون القابلة للذوبان محتويات النظام الغذائي (مثل الفيتامينات القابلة للذوبان في الدهون والكولسترول) والأملاح الصفراوية تشكل ميسيلس مختلطة، في محتويات الإثني عشر مائي.[15][16][17]
محتويات هذه ميسيلس (ولكن ليس الأملاح الصفراوية) دخول إنتيروسيتس (الخلايا الظهارية بطانة الأمعاء الدقيقة) حيث يتم إعادة توليفها في الدهون الثلاثية، وتعبئتها في تشيلوميكرونس التي يتم تحريرها في لاكتالز (الشعيرات الدموية من الجهاز الليمفاوي من الأمعاء).[18] هذه الثغرات استنزاف في القناة الصدرية التي تصب في الدم الوريدي عند تقاطع الأوردة الوداجية اليسرى واليسار تحت الترقوة اليسرى على الجانب الأيسر السفلي من الرقبة. وهذا يعني أن المنتجات القابلة للذوبان الدهون من الهضم يتم تفريغها مباشرة في الدورة الدموية العامة، دون المرور أولا من خلال الكبد، كما تفعل جميع منتجات الهضم الأخرى. والسبب في هذه الخصوصية غير معروف.[19]
و كيلوميكرونس تدور في جميع أنحاء الجسم، وإعطاء بلازما الدم حليبي، أو ظهور دسم بعد وجبة دهنية. البروتين الدهني ليباس على السطوح البطانية للشعيرات الدموية، وخاصة في الأنسجة الدهنية، ولكن إلى حد أقل أيضا في الأنسجة الأخرى، هضم جزئيا كيلومرونس في الأحماض الدهنية الحرة، الجلسرين والبقايا كيلوميكترون. يتم امتصاص الأحماض الدهنية من قبل الخلايا الشحمية، ولكن بقايا الجلسرين وكيلوميكترون تبقى في بلازما الدم، في نهاية المطاف إلى إزالتها من الدورة الدموية من قبل الكبد. يتم امتصاص الأحماض الدهنية الحرة الصادرة عن عملية الهضم من كيلوميرونس من قبل الخلايا الشحمية، حيث يتم ريسنثيزد إلى الدهون الثلاثية باستخدام الجلسرين المستمدة من الجلوكوز في مسار حويصل الدم. يتم تخزين هذه الدهون الثلاثية، حتى الحاجة لمتطلبات الوقود من الأنسجة الأخرى، في قطرة الدهون من خلية شحمية.
الكبد يمتص نسبة من الجلوكوز من الدم في الوريد البابي قادمة من الأمعاء. بعد أن قام الكبد بتجديد مخزونه من الجليكوجين (الذي يصل إلى حوالي 100 جم من الجليكوجين عند اكتماله) يتم تحويل جزء كبير من بقية الجلوكوز إلى أحماض دهنية كما هو موضح أدناه. يتم الجمع بين هذه الأحماض الدهنية مع الجلسرين لتشكيل الدهون الثلاثية التي يتم تعبئتها في قطرات مشابهة جدا ل كيلوميكرونس، ولكن المعروف باسم البروتينات الدهنية منخفضة الكثافة جدا (VLDL). يتم التعامل مع هذه قطرات فلدل في بالضبط نفس الطريقة كما تشيلومرونس، إلا أن بقايا فلدل يعرف باسم البروتين الدهني متوسط الكثافة (LDL)، والتي هي قادرة على الكسح الكولسترول من الدم. هذا يحول إدل إلى البروتين الدهني منخفض الكثافة (VLDL)، الذي يتم تناوله من قبل الخلايا التي تتطلب الكوليسترول لدمجها في أغشية الخلايا أو لأغراض الاصطناعية (على سبيل المثال تشكيل الهرمونات الستيرويدية). تتم إزالة ما تبقى من LDL's من الكبد. [15]
الأنسجة الدهنية والغدد الثديية المرضعات أيضا تناول الجلوكوز من الدم لتحويلها إلى الدهون الثلاثية. يحدث هذا في نفس الطريقة كما يفعل في الكبد، إلا أن هذه الأنسجة لا تطلق الدهون الثلاثية وبالتالي تنتج كما فلدل في الدم. خلايا الأنسجة الدهنية تخزين الدهون الثلاثية في قطرات الدهون، في نهاية المطاف لإطلاق سراحهم مرة أخرى كما الأحماض الدهنية الحرة والجلسرين في الدم (كما هو موضح أعلاه)، عندما يكون تركيز البلازما من الأنسولين منخفضة، وأن الجلوكاجون و / أو ادرينالين عالية.[20] الغدد الثديية تفريغ الدهون (كما قطرات الدهون كريم) في الحليب التي تنتجها تحت تأثير الغدة النخامية هرمون البرولاكتين الأمامي.
جميع الخلايا في الجسم تحتاج إلى تصنيع والحفاظ على الأغشية والأغشية من عضياتها. ما إذا كانوا يعتمدون على هذا تماما على الأحماض الدهنية الحرة استيعابها من الدم، أو قادرة على توليف الأحماض الدهنية الخاصة بهم من الجلوكوز في الدم، غير معروف. ومن المؤكد أن خلايا الجهاز العصبي المركزي لديها القدرة على تصنيع الأحماض الدهنية الخاصة بهم، حيث أن هذه الجزيئات لا يمكن الوصول إليها من خلال حاجز الدم في الدماغ، في حين، من ناحية أخرى، لا خلية في الجسم يمكن تصنيع الدهنية الأساسية المطلوبة والأحماض التي يجب الحصول عليها من النظام الغذائي وتسليمها إلى كل خلية عن طريق الدم.
انظر أيضا
مراجع
- ^ أ ب Stryer، Lubert (1995). "Fatty acid metabolism.". In: Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 603–628. ISBN:0 7167 2009 4.
- ^ أ ب ت "Oxidation of Fatty Acids - via Beta-Oxidation | Biochemistry Notes | PharmaXChange.info". PharmaXChange.info (بen-US). 11 Oct 2013. Archived from the original on 2018-01-08. Retrieved 2018-01-10.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ "Mobilization and Cellular Uptake of Stored Fats (Triacylglycerols) with Animation | Animations | PharmaXChange.info". PharmaXChange.info (بen-US). 1 Oct 2013. Archived from the original on 2017-12-21. Retrieved 2018-01-10.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ "SLC27 fatty acid transport proteins". Molecular Aspects of Medicine. ج. 34 ع. 2–3: 516–528. 1 أبريل 2013. DOI:10.1016/j.mam.2012.07.010. ISSN:0098-2997. مؤرشف من الأصل في 2018-11-18.
- ^ Stahl, Andreas (1 Feb 2004). "A current review of fatty acid transport proteins (SLC27)". Pflügers Archiv (بEnglish). 447 (5): 722–727. DOI:10.1007/s00424-003-1106-z. ISSN:0031-6768. Archived from the original on 2018-11-20.
- ^ Marin-Valencia، Isaac؛ Good، Levi B؛ Ma، Qian؛ Malloy، Craig R؛ Pascual، Juan M (2013-02). "Heptanoate as a neural fuel: energetic and neurotransmitter precursors in normal and glucose transporter I-deficient (G1D) brain". Journal of Cerebral Blood Flow & Metabolism. ج. 33 ع. 2: 175–182. DOI:10.1038/jcbfm.2012.151. ISSN:0271-678X. PMID:23072752. مؤرشف من الأصل في 16 ديسمبر 2019.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Ebert, Douglas; Haller, Ronald G.; Walton, Marlei E. (2 Jul 2003). "Energy Contribution of Octanoate to Intact Rat Brain Metabolism Measured by 13C Nuclear Magnetic Resonance Spectroscopy". Journal of Neuroscience (بEnglish). 23 (13): 5928–5935. ISSN:0270-6474. PMID:12843297. Archived from the original on 2019-06-07.
- ^ Stryer, Lubert (1995). "Fatty acid metabolism.". In: Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 770–771. ISBN 0 7167 2009 4.
- ^ Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 510–515, 581–613, 775–778. ISBN 0 7167 2009 4.
- ^ "Activation and Transportation of Fatty Acids to the Mitochondria via the Carnitine Shuttle with Animation | Animations | PharmaXChange.info". PharmaXChange.info (بen-US). 6 Oct 2013. Archived from the original on 2018-01-24. Retrieved 2018-01-11.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Vivo, Darryl C.; Bohan, Timothy P.; Coulter, David L.; Dreifuss, Fritz E.; Greenwood, Robert S.; Nordli, Douglas R.; Shields, W. Donald; Stafstrom, Carl E.; Tein, Ingrid (1998). "l-Carnitine Supplementation in Childhood Epilepsy: Current Perspectives". Epilepsia. 39 (11): 1216–1225. doi:10.1111/j.1528-1157.1998.tb01315.x. ISSN 0013-9580. نسخة محفوظة 29 يوليو 2009 على موقع واي باك مشين.
- ^ "Oxidation of Unsaturated Fatty Acids | Biochemistry Notes | PharmaXChange.info". PharmaXChange.info (بen-US). 11 Oct 2013. Archived from the original on 2017-12-30. Retrieved 2018-01-11.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ "Oxidation of Odd Carbon Chain Length Fatty Acids - Fate of Propionyl CoA | Biochemistry Notes | PharmaXChange.info". PharmaXChange.info (بen-US). 11 Oct 2013. Archived from the original on 2017-12-19. Retrieved 2018-01-11.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ أ ب Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 510–515, 581–613, 775–778. ISBN 0 7167 2009 4.
- ^ أ ب Lubert.، Stryer, (1995). Biochemistry (ط. 4th ed). New York: W.H. Freeman. ISBN:0716720094. OCLC:30893133. مؤرشف من الأصل في 2019-12-09.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Hofmann، A. F. (أكتوبر 1963). "The function of bile salts in fat absorption. The solvent properties of dilute micellar solutions of conjugated bile salts". Biochemical Journal. ج. 89 ع. 1: 57–68. ISSN:0264-6021. PMID:14097367. مؤرشف من الأصل في 2019-12-16.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Digestion of Fats (Triacylglycerols) | Biochemistry Notes | PharmaXChange.info". PharmaXChange.info (بen-US). 1 Oct 2013. Archived from the original on 2017-12-24. Retrieved 2018-01-11.
{{استشهاد بخبر}}: صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Stepnick.، Gropper, Sareen Annora (2013). Advanced nutrition and human metabolism (ط. 6th ed). Belmont, CA: Wadsworth/Cengage Learning. ISBN:1133104053. OCLC:768800804. مؤرشف من الأصل في 2019-12-09.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) و|طبعة=يحتوي على نص زائد (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ 1825-1861.، Gray, Henry, (1989). Gray's anatomy (ط. 37th ed). Edinburgh: C. Livingstone. ISBN:0443041776. OCLC:18350581. مؤرشف من الأصل في 2019-12-09.
{{استشهاد بكتاب}}:|طبعة=يحتوي على نص زائد (مساعدة)صيانة الاستشهاد: أسماء عددية: قائمة المؤلفين (link) صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Strålfors, Peter; Honnor, Rupert C. (1 Jun 1989). "Insulin-induced dephosphorylation of hormone-sensitive lipase". European Journal of Biochemistry (بEnglish). 182 (2): 379–385. DOI:10.1111/j.1432-1033.1989.tb14842.x. ISSN:1432-1033. Archived from the original on 2018-01-11.
| أيض الحموض الدهنية في المشاريع الشقيقة: | |

