|
تضامنًا مع حق الشعب الفلسطيني |
جسر ملحي

الجسر الملحي في الكيمياء هو توليفة تآثرين غير تساهميين: الترابط الهيدروجيني والترابط الأيوني (الشكل1). ويُلاحظ بشكل شائع إساهمه في استقرار بُنى البروتين المتطوية غير المفضلة إنتروبيا. رغم أن التآثرات غير التساهمية يعرف بأنها ضعيفة نسبيا، لكن يمكن لتآثرات الاستقرار الصغيرة أن تتراكم وتقوم بمساهمة مهمة في الاستقرار العام للبنية.[1] لا تتواجد الجسور الملحية في البروتينات وحسب، بل تتواجد كذلك في كيمياء الجزيئات الضخمة. تتم دراسة الديناميكية الحرارية لكل جسر ملحي عبر إجراءات تجريبية لتقييم وتقدير مساهمته بالطاقة الحرة بالنسبة للطاقة الحرة الإجمالية للجزيء في تلك البنية.
جسور ملحية موجودة في البروتين
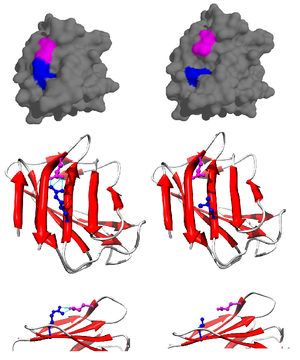
غالبا ما تنشأ الجسور الملحية من الكاربوكسيلات المتأنينة (RCOO−) لحمض الأسبارتيك أو الجلوتاميك ومن الأمونيوم الموجب (RNH3+) لليسين أو الغوانيدينيوم (RNHC(NH2)2+) الخاص بالأرجينين (شكل2).[1]، ورغم أن هذه هي الجسور الملحية الأكثر شيوعا؛ إلا أن بعض الأحماض الأمينية ذات السلاسل الجانبية القابلة للتأين مثل الهستدين والتيروسين والسيرين يمكنها كذلك المساهمة في تكوين الجسور الملحية وذلك حسب عوامل خارجية تسبب اضطرابا في الـpKa الخاص بها. المسافة بين الوحدات المشاركة في الجسر الملحي مهمة كذلك في تكوينه، فالمسافة المطلوبة هي أقل من 4 أنغستروم (400 بيكومتر). الأحماض الأمينية التي تفصلها مسافة أكبر من هذه لا يمكنها تكوين جسر ملحي.[3] نظرا لعديد الأحماض الأمينية ذات السلاسل الجانبية القابلة للتأين الموجودة في البروتين، فإن الأس الهيدروجيني(PH) الذي يتواجد فيه البروتين يلعب دورا أساسيا في استقراره.
طرق لقياس مقدار مساهمة الجسر الملحي في الاستقرار
مراجع
- ^ أ ب Dougherty، Dennis A. (2006). Modern Physical Organic Chemistry. Sausalito, CA: University Science Books. ISBN:1-891389-31-9.
- ^ Al-Haggar M؛ Madej-Pilarczyk A؛ Kozlowski L؛ Bujnicki JM؛ Yahia S؛ Abdel-Hadi D؛ Shams A؛ Ahmad N؛ Hamed S؛ Puzianowska-Kuznicka M (2012). "A novel homozygous p.Arg527Leu LMNA mutation in two unrelated Egyptian families causes overlapping mandibuloacral dysplasia and progeria syndrome". Eur J Hum Genet. ج. 20 ع. 11: 1134–40. DOI:10.1038/ejhg.2012.77. PMC:3476705. PMID:22549407. مؤرشف من الأصل في 2016-08-13.
- ^ Kumar, S.؛ Nussinov, R. (2002). "Close-Range Electrostatic Interactions in Proteins". ChemBioChem. ج. 3 ع. 7: 604–617. DOI:10.1002/1439-7633(20020703)3:7<604::AID-CBIC604>3.0.CO;2-X. PMID:12324994.