|
تضامنًا مع حق الشعب الفلسطيني |
طفرة (أحياء)

| جزء من سلسلة مقالات حول |
| التطور |
|---|
 |
| بوابة علم الأحياء التطوري |
الطفرة[1][2][3] في علم الأحياء هي أي تغير يحدث في المعلومات الجينية - المعلومات الوراثية الحيوية المشفرة في تسلسلات حمض نووي ريبوزي منقوص الأكسجين، والكروموسومات التي يحويها الدنا، أو في تسلسلات حمض نووي ريبوزي في حال بعض الفيروسات. الدنا DNA هو بمثابة سلسلة مزدوجة، والأجزاء المكونة لهذه السلسلة هي النوكليوتيدات (تُسمى أيضا بالقواعد النتروجينية). يمكن أن تُحدث الطفرة تغييرات في سلسلات الدنا أو الرنا بطرق مختلفة. فهي قد تغير من ترتيب تسلسل النوكليوتيدات أو من عددها عن طريق غرز قاعدة أو أكثر أو عن طريق حذف قاعدة نتروجينية أو أكثر أو عن طريق جين قافز.
الطفرات تنجم عن: فيروسات، أو جين قافز، الكيميائيات المطفرة، أو التعرض للأشعة، وكذلك من الأخطاء التي قد تحدث خلال تضاعف الدنا أو الانتصاف عند إنتاج الخلايا المشيجية. ويمكن أن يُحدثها الكائن الحي نفسه بواسطة عمليات خلوية مثل التطفر المفرط.[4][5][6]
في الكائنات الحية متعددة الخلايا هناك نوعان من الخلايا: جنسية وجسدية. الطفرات التي تحدث في الخلايا الجنسية (الحيوان المنوي أو البويضة) تسمى طفرات تناسلية Germline mutation ، وهي وروثية (تنتقل إلى النسل) إلا إن كانت مميتة، فيموت الجنين. الطفرات التي تحدث في الخلايا الجسدية تسمى طفرات جسدية، ولا يمكنها الانتقال إلى النسل عن طريق العمليات التكاثرية في الحيوانات. ولكن من الممكن الاحتفاظ بها عن طريق الاستنساخ. وتوريث الطفرات غير الجنسية ممكن في النباتات.
الطفرات والتنوع الجيني
الطفرات تمثل المواد الأولية للتنوع الجيني، أي تنوع الأجناس البشرية على سبيل المثال، كذلك هي المسؤولة عن التطور في الكائنات الحية بصفة عامة. وهي ضرورية كي يحدث التطور. تأثيرات الطفرات قد تكون ضارة أو نافعة، أو محايدة (لا تضر ولا تنفع الكائن في البيئة التي يعيش فيها). الطفرات الضارة تتم تصفيتها عن طريق الاصطفاء الطبيعي، إحدى آليات التطور، أما الطفرات المحايدة فقد تتراكم وتصبح شائعة بآلية تطور أخرى تسمى الانحراف الوراثي. التغيرات التي تنتج عن الطفرات قد لا يكون لها أي تأثير، أو قد تعدل من النواتج الجينية أو النسل، أو قد تمنع الجين عن العمل بشكل صحيح أو بشكل مطلق. الأغلبية العظمى من الطفرات تكون محادية ولا تؤدي إلى تغيرات ملحوظة. ولكن الطفرات التي تعدل من البروتينات الناتجة عن الجينات، تكون غالبا ضارة.
أجريت دراسات على ذباب الفاكهة، فوجد أن نسبة الطفرات ذات التأثيرات الضارة تصل إلى 70% ، بينما تأثيرات البقية كانت محادية أو نافعة بشكل طفيف.[7] وبسبب التأثيرات الضارة التي قد تنجم عن هذه الطفرات، هنالك آليات في الكائنات الحية تمنع حدوث الطفرات أو بقائها، مثل ترميم الدنا.[4]
الفرد الذي تحدث به طفرة معينة أو يكون حاملا لها يكون طافِرا، ويمكن إطلاق هذه التسمية على السمات والأعضاء الجسدية التي تتأثر بالطفرة أيضاً. عملية حدوث الطفرة يطلق عليها تَطَفُّر أو طُفور. وعندما تحدث طفرة في الدنا أو في فرد يقال عنه أنه طَفُر.
مسببات: التلقائية والإحداث
بشكل عام، يندر ظهور طفرات جديدة. ومعظم الطفرات التي تمت دراستها في البداية كانت تحدث من تلقاء نفسها. الطفرات من هذا الصنف تُدعى طفرات تلقائية. أما الطفرات التي يتم استحثاثها بالعوامل المُطَفِّرة التي تتعرض لها الكائنات الحية، فهي تدعى طفرات مُحدثة.
معدل حدوث الطفرات التلقائية يختلف بحسب حجم الجين. والجين الأكبر يمثل هدفاً أكبر ويميل لأن يَطفُر أكثر. بشكل عام، يصل معدل الطفور في حقيقيات النوى والبكتيريا أحادية الخلايا إلى حوالي 0.003 طفرة لكل جينوم في كل جيل.[8] أما المعدل لدى الإنسان يتراوح بين 1×10−6 إلى 1×10−5 طفرة لكل نوكليوتيد يتم نسخه (أنظر أسفله).
طفرة تلقائية
الطفرات التلقائية تحدث نتيجة لعمليات طبيعية تحدث في الخلايا. الطفور التلقائي على مستوى الجزيئات قد يحدث بسبب:
- الصنوانية Tautomerism: تغيير قاعدة عن طريق إعادة تموضع ذرة هيدروجين، وذلك بتعديل نمط ترابط الهيدروجين لتلك القاعدة، مما يؤدي لازدواج نوكليوتيدات خاطئ أثناء الترفيل (التضاعف).
- نزع البيورينات Depurination: فقدان قاعدة بورين لتشكيل موقع منزوع البورين.
- نزع الأمينات Deamination: الحلمهة تؤدي لتبدل قاعدة عادية لقاعدة شاذة.
- الازدواج المتضارب للشريط المنزلق [English] Slipped strand mispairing: تمسخ الشريط أثناء استنساخه، وإعادته إلى طبيعته في موقع آخر. وهذا قد يؤدي لحدوث غرز أو خبن.[9]
طفرة محدثة
الطفرات المحدثة تحدث نتيجة لتفاعل حمض نووي ريبوزي منقوص الأكسجين مع عوامل خارجية أو عوامل مطفرة، ألا وهي:
- الكيميائيات
- نظائر القواعد [English]: كيميائيات مشابهة للقواعد البورين والبيريميدين، وقد تأخذ مكان القواعد العادية في الدنا أثناء التضاعف.
- كيميائيات تغير من تركيب القواعد وخصائص ازدواجها: مثل حمض النيتروز.
- عوامل متداخلة.
- عوامل تغير من تركيب الدنا.
- أشعة
أنواع الطفرات
يمكن تصنيف الطفرات وفقاً لمسبباتها (تلقائية-محدثة)، من حيث قابلية توريثها (جسدية-جنسية)، أو حسب تأثيراتيها على الصلاحية (ضارة-نافعة-محايدة)، أو الوظيفة (فقدان-كسب وظيفة)، أو بأثرها على تسلسلات البروتينات، أو بآليات حدوثها في الدنا والكروموسومات.
أنواع الطفرات حسب تأثيرها على البنية
ثمة طرق مختلفة يمكن أن تتغير بها تسلسلات الجينات، الأمر الذي يفضي إلى أنواع مختلفة من الطفرات. الطفرات التي تحدث في الجينات تختلف تأثيراتها على الصحة. فالأمر يتعلق بحيثيات حدوث هذه الطفرات، وما إذا كانت تعدل من وظائف البروتينات الضرورية الناتجة عن الجينات. وتصنف الطفرات التي تحدث في بنيات الجينات إلى طفرات صغيرة (طفرات جينية)، وطفرات كبيرة (طفرات كروموسومية).

طفرات صغيرة
الطفرات الصغيرة أو الجينية هي الطفرات التي تحدث في تسلسل الدنا الذي يشكل جين معين. هذا النوع من الطفرات يؤثر فقط على نوكليوتيد واحد أو عدة نوكليوتيدات في الجين، وهو يتضمن:
- الطفرات النقطية أو طفرات «تبدل القواعد»: تنتج غالباً عن كيميائيات أو أخطاء تحدث أثناء تضاعف الدنا. وهي عبارة عن تبديل نوكليوتيد أحادي بواحد آخر.[10] وهو بمثابة تبديل «حرف» كيميائي بآخر في «الجملة»، مثل تبديل A ب-G. هنالك نوعان من الطفرات النقطية:
- الانتقال Transition: وهو الأكثر شيوعاً، يشير إلى استبدال بورين ببورين آخر، أو استبدال بريميدين ببريميدين آخر، مثل تبديل A ب-A أو G ب-G. الانتقال يمكن أن يحدث بسبب حمض النيتروز، تضارب ازدواج القواعد، أو نظائر القواعد المطفرة.
- التبدال Transversion: أما التبدال فهو أقل شيوعاً، وفيه يستبدل البورين ببريميدين، أو العكس.[11]
- الطفرات النقطية التي تحدث في مناطق تشفير البروتينات في الجين تصنف لثلاثة أنواع:
- طفرة صامتة Silent mutation: تستبدل الكودون بآخر يحدد شفرة جينية لنفس الحمض الأميني، ولا تتسبب في تغيير البروتين الناتج.
- طفرة مغلطة Missense mutation: تستبدل الكودون بآخر يرمز لحمض أميني مختلف. هذا قد يحدث تغيراً بسيطاً في البروتين الناتج. على سبيل المثال، فقر الدم المنجلي ينجم عن طفرة نقطية تحدث في جين الهيموغلوبين بيتا، والذي يؤدي لتغير أحد الأحماض الأمينية في البروتين الناتج.
- طفرة هرائية Nonsense mutation: تستبدل الكودون المشفر للأحماض الأمينية بكودون «توقف»، وتتسبب بإنتاج بروتين غير مكتمل. قد تكون تأثيرات هذه الطفرات جسيمة بما أن البروتين غير المكتمل على الأغلب لن يؤدي وظيفته.
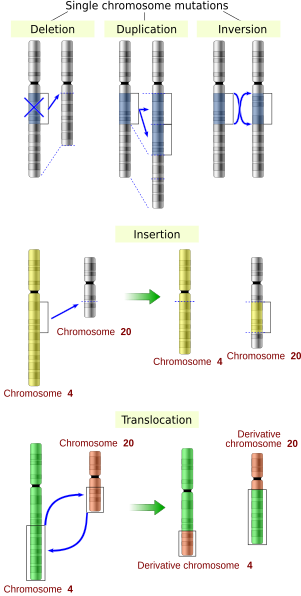
- الغرز: الغرز هي طفرة تدخل بها نوكليوتيدات زائدة إلى منطقة دنا مختلفة.
- الخبن: الخبن هي طفرة تٌحذف أو تُفقد فيها نوكليوتيدات من الدنا.
طفرات كبيرة
الطفرات الكبيرة أو الكروموسومية هي طفرات تحدث في أقسام من الكروموسوم، وتغير من بنيات الكروموسومات أو ترتيبها. وهي تتضمن:
- التضخيمات أو ترفيل (تضاعف) الجينات: تؤدي لإنتاج نسخ من مناطق كروموسومية، مما يجعل عدد الجينات المتموضعة فيها مفرطاً.
- طفرات الغرز: تؤدي لإدخال منطقة جديدة إلى الكروموسوم.
- طفرات الخبن: تؤدي لحذف مناطق كروموسومية، مما يؤدي لفقدان الجينات التي في هذه المناطق.
- الطفرات التي تؤدي لتجاور قطع دنا منفصلة، والتي قد تتسبب في ربط جينات منفصلة لتشكل جينات مندمجة [English] ذات وظيفة جديدة ومختلفة. وهذه الطفرات تتضمن:
- الإزفاء: تبادل القطع الوراثية بين كروموسومين غير متماثلين.
- الخبن الخلالي: خبن يحدث داخل الكروموسوم، وهو حذف قطعة دنا من الكروموسوم، بحيث يؤدي ذلك لتجاور جينات كانت متباعدة.
- انقلاب كروموسومي: عكس اتجاه جزء من الكروموسوم.
- فقدان التغاير الزيجوتي [English]: فقدان أليل واحد في كائن حي كان يملك أليلان مختلفان، وذلك إما عن طريق الخبن أو التأشيب.
أنواع الطفرات حسب تأثيرها على الوظيفة
- طفرات فقدان الوظيفة: هذه الطفرات تحدث عندما تصبح وظائف نواتج الجينات غير مكتملة أو معدومة. عندما يفقد الأليل وظيفته بالكامل (أليل عديم الوظيفة [English])، فإن الطفرة التي تسببت في ذلك غالباً يطلق عليها طفرة عديمة الشكل amorphic. وعادةً تكون الأنماط الظاهرية المرتبطة بهذه الطفرات متنحية.
- طفرات كسب الوظيفة: طفرات تغير النواتج الجينية بحيث تكسبها وظائف جديدة وشاذة. هذه الطفرات عادة تكون مرتبطة بأنماط ظاهرية سائدة. وهي غالباً تسمى طفرات جديدة الشكل أو جديدة البنية neomorphic.
- طفرات سالبة سائدة: تسمى أيضاً طفرات مضادة للشكل antimorphic، تؤدي لأن تعمل النواتج الجينية المعدلة بشكل مناهض للألائل برية النمط. هذه الطفرات عادة ما تنتج وظائف جزيئية معدلة (عادة تكون غير نشطة). والأنماط الظاهرية المقرونة بها تكون سائدة أو شبه سائدة.
- الطفرات المميتة: تؤدي لموت الكائن الحي الحامل لهذه الطفرة.
- الطفرات الرجعية: طفرات نقطية تسترجع التسلسلات الأصلية، ومن ثم النمط الظاهري الأصلي.[12]
أنواع الطفرات حسب تأثيرها على الصلاحية
في علم الوراثة التطبيقي وفي الوراثيات السكانية النظرية، من المعتاد تناول الطفرات باعتبارها إما ضارة (مؤذية) أو نافعة (مفيدة) أو محادية.
- الطفرة الضارة هي طفرة تأثيراتها على النمط الظاهري تكون سلبية، وبذلك تحط من صلاحية الكائن الحي.
- الطفرة النافعة هي طفرة تعزز صلاحية الكائن الحي، أو تدعم خلاته المرغوبة. وتأثيراتها على النمط الظاهري تكون إيجابية.
- الطفرة المحايدة تُعَرَّف على أنها طفرة لا يترتب عليها تأثيرات ضارة أو نافعة. هذه الطفرات تحدث بمعدل ثابت، وبذلك تشكل الساعة الجزيئية.
- الطفرة شبه المحايدة تُعَرَّف على أنها طفرة قد تكون مؤذية أو مفيدة بشكل طفيف، هذا ومع أنَّ معظم الطفرات شبه المحايدة تكون مؤذية قليلاً.
ولكن في واقع الأمر، تناول تأثيرات الطفرات على الصلاحية من خلال هذه الفئات يعد تبسيطاً. لقد أجريت محاولات للاستدلال على توزيع التأثيرات على الصلاحية، وذلك بواسطة تجارب التطفير والنماذج النظرية المطبقة على معلومات التسلسلات الجزيئية. توزيع آثار الصلاحية الذي يُستعمل لتحديد مدى الشيوع النسبي لكل نوع من الأنواع المختلفة من الطفرات (الضارة بشدة، شبه المحايدة أو النافعة)، يتعلق بالكثير من المسائل التطورية، مثل الحفاظ على التنوع الجيني،[13] معدل الاضمحلال الجينومي،[14] وتطور الجنس والتأشيب.[15] وباختصار، توزيع تأثيرات الصلاحية يلعب دوراً هاماً في توقع الديناميكا التطورية.[16][17] وقد استعملت الكثير من الطرق لدراسته، بما فيها الوسائل النظرية، التجريبية والتحليلة.
أنواع الطفرات حسب تأثيرها على تسلسل البروتين

يعتمد تأثير الطفرة على تسلسل البروتين جزئيا على مكان حدوثها في تسلسل الجينوم، وبشكل خاص، إن كانت في منطقة مشفرة للبروتين أو غير مشفرة. يمكن أن تغير الطفرات الواقعة في تسلسلات غير مشفرة تنظيمية مثل المحفزات والمحسنات والكاتمات مستويات التعبير الجيني، لكنها على الأرجح لن تغير تسلسل الروتين. الطفرات التي تحدث داخل الإنترونات والمناطق التي ليس لها وظيفة بيولوجية معروفة (مثل: الجينات الكاذبة والينقولات الراجعة) عادة ما تكون طفرات محايدة، ليس لها تأثير على النمط الظاهري، رغم أن الطفرات في الإنترونات يمكن أن تغير الناتج البروتيني إذا كان لها تأثير على وصل الرنا.
على الأرجح يمكن أن تُغيّر الطفرات التي تحدث في المناطق المشفرة من الجينوم من تسلسل البروتين الناتج، ويمكن تصنيفها حسب تأثسرها على تسلسل الأحماض الأمينية إلى:
- طفرة انزياح الإطار: وتحدث بسبب غرز أو حذف لتسلسل دنا من النوكليوتيدات لا يقبل القسمة على ثلاثة. بسبب الطبيعة الثلاثية للكودونات التي يُعبر بها عن الجينات: يمكن أن يغير الغرز أو الحذف إطار القراءة، أو تجميعات الكودونات، وتنتج عن ذلك ترجمة مختلفة كليا عن الترجمة الأصلية،[18] وكلما كان الحذف أو الغرز قريبا من بداية التسلسل، زاد تغير البروتين الناتج. على سبيل المثال يشفر الترميز
CCU GAC UAC CUAالأحماض الأمينية: برولين، حمض الأسبارتيك، تيروسين وليوسين فإذا حُذف الحرف U من الكودون الأول CCU فإن التسلسل الناتجCCG ACU ACC UAxسيشفر: برولين، ثريونين، ثريونين وجزءا من حمض أميني آخر أو كودون توقف (حسب ماهية النوكليوتيد الموالي x). بالإجماع، يسمى كل حذف أو غرز يكون قابلا للقسمة على ثلاثة بـ الطفرة المتوافقة مع الإطار. - طفرة التبديل النقطية: وهي طفرة نقطية تحدث بواسطة عمليتي الاتنقال والتبدال وتتسبب في تغيير ماهية نوكليوتيدة واحدة ويمكن أن يكون الاستبدال ترادفي أو لاترادفي:
- الاستبدال الترادفي: وهو استبدال نوكليوتيد بواسطة نوكليوتيد آخر بحيث يشفر الكودون الناتج نفس الحمض الأميني الذي يشفره الكودون الأول، وبالتالي لا يتغير تسلسل الأحماض الأمينية. تحدث الطفرات الترادفية بسبب طبيعة الشيفرة الجينية التعددية [English]. إن لم تُحدث الطفرة تأثيرات في النمط الظاهري، تسمى حينها طفرة صامتة، لكن ما كل الاستبدالات الترادفية هي طفرات صامة. توجد كذلك طفرات صامتة خارج المناطق المشفرة مثل الإنترونات، لأن نفس تسلسل النوكليتدات بالضبط ليس ضروريا دائما كما هو في المناطق المشفرة للبروتين وقد لا يتأثر الإنترون باستبدال نوكليوتيد واحد، لكن هذه الطفرات لا تُعتبر استبدالات ترادفية.
- الاستبدال اللاترادفي: وهو استبدال نوكليوتيد بواسطة نوكليوتيد آخر بحيث لا يشفر الكودون الناتج نفس الحمض الأميني الذي يشفره الكودون الأول، وبالتالي يتغير تسلسل الأحماض الأمينية وتنقسم الاستبدالات اللاترادفية إلى طفرات مغلطة وهرائية:
- الطفرة المغلطة: تقوم باستبدال نوكليوتيد ينتج عنه تغير حمض أميني في تسلسل البروتين الناتج وهو ما قد يؤثر في وظيفة هذا البروتين أو يعطلها. مثل هذه الطفرات مسؤولة عن أمراض: كانحلال البشرة الفقاعي وفقر الدم المنجلي والتصلب الجانبي الضموري المتوسط بفوق أكسيد الدسموتاز.[19] من جهة أخرى، إذا حدثت الطفرة المغلطة في كودون يشفر حمضا أمينيا مختلفا لكن مماثلا كيميائيا، فيحنها قد يحدث تغيير طفيف أو منعدم في وظيفة البروتين. على سبيل المثال التغير من الكودون
AAAإلىAGAسيشفر الحمض الأميني أرجنين وهو مماثل كيميائيا للحمض الأميني المقصود ليسين، وفي مثل هذا المثال يكون التأثير طفيفا أو منعدما على النمط الظاهري وبالتالي تعتبر الطفرة محايدة.
- الطفرة الهرائية هي طفرة نقطية في تسلسل دنا ينتج عنها: كودون توقف مبتسر، أو كودون هرائي في الرنا الرسول المنسوخ، ومن الممكن بروتين مبتور أو غير وظيفي. هذا النوع من الطفرات له صلة بأمراض مختلفة مثل فرط تنسج الكظرية الخلقي.
معدل الطفرات
خلال القرن التاسع عشر لم يكن تشارلز داروين يعرف شيئا عن آلية التطور في الانتخاب الطبيعي . ويقول المشرف على مشروع الجينوم البشري البروفسيسور فرانسيس كولينز في كتابه «لغة الله ؛ عالم يقدم دليلا عن الإيمان»[1*]، يقول اننا نعرف الآن ان التغيرات التي افترضها داروين تؤيدها طفرات تحدث واقعيا في الدنا. ويبدو أنها تحدث في المتوسط بمعدل طفرة في كل 100 مليون زوج قاعدي خلال الجيل الواحد. وهذا معناه ان الإنسان الذي توجد في خليته نحو 3 مليارات من أزواج القواعد ؛ قاعدة من الأب وقاعدة من الأم فيحدث لكل منا نحو 60 طفرة لا توجد في الأب ولا توجد في الأم.
معظم تلك الطفرات تحدث في مناطق في الجينوم الغير مهمة، ولهذا فلا يكون لها تأثير سيئ ولا يترتب عليها تبعات ضارة . ولكن تلك الطفرات التي تحدث في أجزاء هامة من الدنا فغالبا يكون لها تبعات سيئة، فهي تعيق صاحبها ويكون احتمال انتقالها إلى الجيل التالي ضعيفا. ولكن تحدث أيضا طفرات نادرة يكتسب حاملها ميزة عن الاخرين، تكسبه قدرة أعلى من غيره فيتفوق ويكون أصلحا في حياته . ذلك التغير في الدنا سيكون احتمال انتقاله إلى النسل احتمالا كبيرا . وعبر فترة طويلة من الزمان ستنتقل تلك الطفرات الصفيرة المتتالية إلى العديد من أجيال النسل، مؤدية في ختام المطاف في تغير كبير في الوظيفة الحيوية بعد زمن طويل.
ويقول «فرانسيس كولينز» أننا نعاصر طفرات تحدث حولنا، نراها في تغيرات سريعة في فيروسات تسبب المرض، وفي بكتيريا وطفيليات تعرضنا لاخطار امراض شديدة . فقد كانت الملاريا تعالج وقائيا بعقار كلوروكوين Chloroquine، ولكن تغيرات حدثت في جينوم طفيل الملاريا أكسبته مناعة ضد الكلوركوين في بعض مناطق العالم فانتشرت فيها الملاريا سريعا.
وكذلك حدثت طفرات سريعة في فيروس HIV بحيث جعلت مرض الإيدز منيعا ضد المضادات الحيوية . علاوة على تخوف الناس من الإصابة بمرض انفلونزا الخنازير الذي تتطور من الفيروس H5N1 ، وغيرها. فيمكن القول أنه لدراسة علم الاحياء ودراسة الطب والعلاج لا يمكن فهمهما من دون فهم لنظرية التطور.
الطفرات الضارة
يمكن أن تسبب التغييرات الطارئة على الحمض النووي الريبوزي منقوص الأوكسجين (DNA) أخطاءً في تسلسل البروتين، مما يؤدي إلى تشكيل بروتينات غير وظيفية بشكل جزئي أو تام. تعتمد كل خلية -لكي تعمل بشكل صحيح- على الآلاف من البروتينات التي يجب تعمل في الأماكن الصحيحة، وفي الأوقات المناسبة. قد يؤدي تغيير طفرة ما لأحد البروتينات الهامة في الجسم إلى التسبب بحالة مَرَضية. مع ذلك، قد تُغَيِّر بعض الطفرات تسلسل قاعدة الحمض النووي للجين، ولكنها لا تغير وظيفة البروتين الذي يصنعه الجين. تشير إحدى الدراسات التي قارنت جينات أنواع مختلفة من ذبابة الفاكهة إلى أنّ تغيير طفرة ما لأحد البروتينات يكون ضارًا غالبًا؛ نحو 70% من تعدد أشكال الأحماض الأمينية يمتلك آثارًا مدمرة، والباقي إمّا محايد أو مفيد بشكل ضعيف.[7] أظهرت الدراسات أنّ 7% فقط من الطفرات النقطية في الحمض النووي غير المشفر للفطور تكون ضارة، بينما تكون النسبة 12% في الحمض النووي المُشَفِّر. وبقية الطفرات تكون إمّا محايدة أو مفيدة قليلًا.[20]
إذا كانت الطفرة موجودة في خلية جنسية، ستؤدي إلى نسل يحمل الطفرة في جميع خلاياه، وهذا ما يحصل في الأمراض الوراثية. إذا حدثت الطفرات في الجينات المسؤولة عن إصلاح الحمض النووي داخل الخلية الجنسية، سيرتفع خطر الإصابة بالسرطان لدى الأشخاص الحاملين لطفرات جنسية كهذه. تضم قائمة اضطراب قصور صيانة الحمض النووي 34 طفرة جنسية، ويُمَثِّل المهق مثالًا على ذلك؛ إذ تكون الطفرة في هذا المرض واقعة في الجين OCA1 أو OCA2، ويكون الأفراد الذين يعانون من هذا الاضطراب أكثر عرضةً لأنواعٍ كثيرةٍ من السرطانات والاضطرابات الأخرى، كما يكونون ضعاف البصر. من الناحية الأخرى، تكون طفرات الخلايا الجسدية موجودة لدى جميع نسل هذه الخلية داخل الكائن الحي نفسه، وقد تحوّل بعض هذه الطفرات الخلايا إلى خبيثة، وبالتالي تسبب السرطان.[21]
يمكن أن يتسبب تلف الحمض النووي في حدوث الخطأ أثناء نسخ الحمض النووي، ويمكن أن يتسبب خطأ الانتساخ هذا في حدوث طفرة جينية تؤدي بدورها إلى حدوث اضطراب وراثي. يتم إصلاح الضرر في الحمض النووي عن طريق نظام إصلاح خاص؛ تحتوي كل خلية على عدد من المسارات التي تتعرف من خلالها الإنزيمات على الأضرار الموجودة في الحمض النووي، وبالتالي إصلاحها. ونظرًا لأن الحمض النووي يمكن أن يتلف بعدة طرق، فإنّ عملية إصلاح الحمض النووي هي طريقة مهمة يحمي بها الجسم نفسه من الأمراض. لا يمكن إصلاح الطفرة بمجرد أن يؤدي تلف الحمض النووي إلى حدوثها؛ يمكن لمسارات إصلاح الحمض النووي التعرف والعمل على البنى الشاذة فقط في الحمض النووي، وبمجرد حدوث الطفرة في تسلسل الجينات، تصبح عندها بنية الحمض النووي طبيعية ولا يمكن إصلاحها.
الطفرات المفيدة
على الرغم من أنّ الطفرات التي تسبب تغيرات في تسلسل البروتين تكون ضارة في كثير من الأحيان للكائن الحي، إلّا أنها قد تمتلك في أحيان قليلة أخرى تأثيرًا إيجابيًا في بيئة معينة ما. في هذه الحالة، قد تُمكِّن الطفرة الكائن الحي المتحوِّر من تحمل ضغوط بيئية معينة أفضل من الكائنات الأخرى، أو من التكاثر بسرعة أكبر. تميل الطفرة في هذه الحالات إلى أن تصبح أكثر شيوعًا بين أفراد المجموعة الأحيائية من خلال الاصطفاء الطبيعي. تشمل الأمثلة ما يلي:
- مقاومة فيروس نقص المناعة البشرية: يمنح حذف الزوج 32 في البروتين CCR5 البشري (CCR5-Δ32) مقاومةً لفيروس نقص المناعة البشرية في الزيجوت متماثل الألائل، وتؤخر ظهور الإيدز في الزيجوت متغاير الألائل.[22] أحد التفسيرات المحتملة للتواتر العالي نسبيًا لهذه الطفرة لدى السكان الأوروبيين هو منحها مقاومة للطاعون الدملي في أوروبا في منتصف القرن الرابع عشر. كانت فرصة نجاة الأشخاص الذين يحملون هذه الطفرة أكبر، وبالتالي زاد تواترها بين السكان.[23] يمكن أن تفسر هذه النظرية سبب عدم وجود هذه الطفرة في جنوب إفريقيا التي ظلت بمنأى عن الطاعون الدملي. تقترح نظرية حديثة أن الضغط الانتخابي على طفرة كان سببه الجدري بدلًا من الطاعون الدملي.[24]
- مقاومة الملاريا: يعتبر داء الخلايا المنجلية من الأمثلة على الطفرات الضارة، وهو اضطراب في الدم ينتج فيه الجسم نوعًا غير طبيعي من مادة الهيموغلوبين التي تحمل الأكسجين في خلايا الدم الحمراء. يحمل ثلث جميع السكان الأصليين في أفريقيا جنوب الصحراء الكبرى هذا الجين. يحمل امتلاك جين واحد فقط للداء المنجلي (سمة الخلية المنجلية) أهمية للبقاء على قيد الحياة بسبب انتشار الملاريا في هذه المناطق.[25] إذ يمتلك من يحمل أليل منجلي وحيد مقاومة أكبر للملاريا بسبب تمنجل الخلايا التي تتطفل عليها المتصورات المسببة للملاريا.
- مقاومة المضادات الحيوية: تطور جميع البكتيريا عمليًا مقاومة عند تعرضها للمضادات الحيوية. في الواقع، يتم انتقاء البكتريا التي تمتلك مسبقًا طفراتٍ من هذا القبيل.[26] من الواضح أنّ هذه الطفرات مفيدة للبكتيريا فقط، وليس للمصابين بها بالطبع.
- استمرار إنتاج اللاكتاز: سمحت طفرة للبشر بإنتاج إنزيم اللاكتاز بعد فطامهم الطبيعي من حليب الأم، مما يسمح للبالغين بهضم اللاكتوز، والذي ربما يكون أحد أكثر الطفرات المفيدة في التطور البشري الحديث.[27]
طفرات البريونات
البريونات هي بروتينات لا تحتوي على مواد وراثية. ومع ذلك، فقد ثبت أن انتساخ البريونات خاضعٌ للتحوّر والانتقاء الطبيعي تمامًا مثل باقي أشكال الانتساخ الأخرى.[28] تُشَفِّر الجينة البشرية (PRNP) البريونات، وتخضع لطفرات يمكن أن تؤدي إلى بريونات مسببة للأمراض.
الطفرة الجسدية
هي تغيير يطرأ على التركيب الوراثي لا يُورَث ولا يُوَرَّث.[29] الطفرات الجسدية ليست موروثة لأنها لا تؤثر على الخلايا الجنسية. عادةً ما تكون هذه الأنواع من الطفرات مدفوعةً بأسبابٍ بيئيةٍ، مثل الأشعة فوق البنفسجية أو أي تعرّض لموادٍ كيميائيةٍ ضارّة. يمكن أن تسبب الطفرات الجسدية أمراضًا بما في ذلك السرطان.[30]
بالنسبة للنباتات، يمكن أن تنتقل بعض الطفرات الجسدية إلى الذرية دون الحاجة إلى إنتاج البذور، على سبيل المثال: عن طريق التطعيم وقطع الجذع. أدى هذا النوع من الطفرات إلى إنتاج أنواع جديدة من الفواكه.[31]
تمتلك الخلايا الجسدية البشرية والفأرية معدل طفرات أعلى من معدل طفرات الخلايا الجنسية بأكثر من عشرة أضعاف. تمتلك الفئران معدل أعلى من الطفرات الجسدية والجنسية مقارنةً بالبشر. يعكس التباين في معدل حدوث الطفرات بين الخلايا الجنسية والأنسجة الجسدية أهمية صيانة الجينوم في الخلايا الجنسية أكثر من الجسد. [116]
طفرات الجين الصامت
استخدم موللر مصطلح الجين الصامت في عام 1932، وهو أليل طافر فقد قدرة الأليل الوالد على ترميز أي بروتين وظيفي. قد تحدث طفرات الجين الصامت بسبب استبدال حمض أميني يعمل على إلغاء تنشيط إنزيم، أو بسبب حذف جزء من جين ينتج الإنزيم.
قد تعمل الخلايا ذات الطفرات متخالفة اللواقح (أحد النسخ جيدة والأخرى طافرة) بشكل طبيعي مع النسخة غير الطافرة حتى تتحور النسخة الجيدة عفويًا. يحدث هذا النوع من الطفرات طوال الوقت في الكائنات الحية، إلّا أنّ قياس معدل الحدوث يبقى صعبًا. ويعتبر قياسه مهمًّا للتنبؤ بالمعدل الذي قد يصاب به الناس بالسرطان.[32]
انظر أيضًا
- طفرة إطار التسطير
- شيفرة جينية
- مطفر
- حذف (وراثة)
- غرز (وراثة)
- إنديل
- مشروع الجينوم البشري
- تقنية FIND
- عملية التطفير (من تقنيات علم الأحياء الجزيئية)
- قائمة الجينات البشرية
مراجع
- ^ Q118929929، ص. 484، QID:Q118929929
- ^ Q114972534، ص. 162، QID:Q114972534
- ^ الناهي، هيثم؛ شريّ، هبة؛ حسنين، حياة. "مشروع المصطلحات الخاصة" (PDF). المنظمة العربية للترجمة: 491. مؤرشف من الأصل (PDF) في 2018-07-12.
- ^ أ ب Bertram J (2000). "The molecular biology of cancer". Mol. Aspects Med. ج. 21 ع. 6: 167–223. DOI:10.1016/S0098-2997(00)00007-8. PMID:11173079.
- ^ Aminetzach YT, Macpherson JM, Petrov DA (2005). "Pesticide resistance via transposition-mediated adaptive جين truncation in Drosophila". Science. ج. 309 ع. 5735: 764–7. DOI:10.1126/science.1112699. PMID:16051794.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Burrus V, Waldor M (2004). "Shaping bacterial genomes with integrative and conjugative elements". Res. Microbiol. ج. 155 ع. 5: 376–86. DOI:10.1016/j.resmic.2004.01.012. PMID:15207870.
- ^ أ ب Sawyer SA, Parsch J, Zhang Z, Hartl DL (2007). "Prevalence of positive selection among nearly neutral amino acid replacements in Drosophila". Proc. Natl. Acad. Sci. U.S.A. ج. 104 ع. 16: 6504–10. DOI:10.1073/pnas.0701572104. PMC:1871816. PMID:17409186.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Rates of Spontaneous Mutation Drake et al. Genetics, 1998 نسخة محفوظة 21 أغسطس 2010 على موقع واي باك مشين.
- ^ "Mutation, Mutagens, and DNA Repair", by Beth A. Montelone, Ph. D., Division of Biology, Kansas State University, 1998 نسخة محفوظة 12 يوليو 2017 على موقع واي باك مشين.
- ^ Freese, Ernst (أبريل 1959). "THE DIFFERENCE BETWEEN SPONTANEOUS AND BASE-ANALOGUE INDUCED MUTATIONS OF PHAGE T4". Proc. Natl. Acad. Sci. U.S.A. ج. 45 ع. 4: 622–33. DOI:10.1073/pnas.45.4.622. PMC:222607. PMID:16590424.
- ^ Freese, Ernst (1959). "The Specific Mutagenic Effect of Base Analogues on Phage T4". J. Mol. Biol. ج. 1 ع. 2: 87–105. DOI:10.1016/S0022-2836(59)80038-3.
- ^ Ellis NA, Ciocci S, German J (2001). "Back mutation can produce phenotype reversion in Bloom syndrome somatic cells". Hum Genet. ج. 108 ع. 2: 167–73. DOI:10.1007/s004390000447. PMID:11281456. مؤرشف من الأصل في 2013-06-17.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Charlesworth، D (1995). "The pattern of neutral molecular variation under the background selection model". Genetics. ج. 141 ع. 4: 1619–32. PMC:1206892. PMID:8601499. مؤرشف من الأصل في 2018-11-16.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Loewe، L (2006). "Quantifying the genomic decay paradox due to Muller's ratchet in human mitochondrial DNA". Genet Res. ج. 87 ع. 2: 133–59. DOI:10.1017/S0016672306008123. PMID:16709275. مؤرشف من الأصل في 2016-08-20.
- ^ Peck، J R (1997). "Imperfect genes, Fisherian mutation and the evolution of sex". Genetics. ج. 145 ع. 4: 1171–99. PMC:1207886. PMID:9093868. مؤرشف من الأصل في 2018-11-16.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Keightley، P.D. (2003). "Toward a realistic model of mutations affecting fitness". Evolution. ج. 57 ع. 3: 683–689. JSTOR:3094781?. PMID:12703958.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Barton، N.H. (2002). "Understanding quantitative genetic variation". Nat Rev Genet. ج. 3 ع. 1: 11–21. DOI:10.1038/nrg700. PMID:11823787.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - ^ Hogan CM (12 أكتوبر 2010). "Mutation". في Monosson E (المحرر). Encyclopedia of Earth. Washington, D.C.: Environmental Information Coalition,National Council for Science and the Environment. OCLC:72808636. مؤرشف من الأصل في 2015-11-14. اطلع عليه بتاريخ 2015-10-08.
- ^ Boillée S، Vande Velde C، Cleveland DW (أكتوبر 2006). "ALS: a disease of motor neurons and their nonneuronal neighbors". Neuron. ج. 52 ع. 1: 39–59. CiteSeerX:10.1.1.325.7514. DOI:10.1016/j.neuron.2006.09.018. PMID:17015226. S2CID:12968143.
- ^ Doniger SW، Kim HS، Swain D، Corcuera D، Williams M، Yang SP، Fay JC (أغسطس 2008). Pritchard JK (المحرر). "A catalog of neutral and deleterious polymorphism in yeast". PLoS Genetics. ج. 4 ع. 8: e1000183. DOI:10.1371/journal.pgen.1000183. PMC:2515631. PMID:18769710.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Ionov Y، Peinado MA، Malkhosyan S، Shibata D، Perucho M (يونيو 1993). "Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis". Nature. ج. 363 ع. 6429: 558–61. Bibcode:1993Natur.363..558I. DOI:10.1038/363558a0. PMID:8505985.
- ^ Sullivan AD، Wigginton J، Kirschner D (أغسطس 2001). "The coreceptor mutation CCR5Delta32 influences the dynamics of HIV epidemics and is selected for by HIV". Proceedings of the National Academy of Sciences of the United States of America. ج. 98 ع. 18: 10214–9. Bibcode:2001PNAS...9810214S. DOI:10.1073/pnas.181325198. PMC:56941. PMID:11517319.
- ^ "Mystery of the Black Death". Secrets of the Dead. موسم 3. حلقة 2. 30 أكتوبر 2002. بي بي إس. مؤرشف من الأصل في 12 أكتوبر 2015. اطلع عليه بتاريخ 10 أكتوبر 2015. Episode background.
- ^ Galvani AP، Slatkin M (ديسمبر 2003). "Evaluating plague and smallpox as historical selective pressures for the CCR5-Delta 32 HIV-resistance allele". Proceedings of the National Academy of Sciences of the United States of America. ج. 100 ع. 25: 15276–9. Bibcode:2003PNAS..10015276G. DOI:10.1073/pnas.2435085100. PMC:299980. PMID:14645720.
- ^ Konotey-Ahulu، Felix. "Frequently Asked Questions [FAQ's]". sicklecell.md. مؤرشف من الأصل في 30 أبريل 2011.
- ^ Hughes، Diarmaid؛ Andersson، Dan I. (09 08, 2017). "Evolutionary Trajectories to Antibiotic Resistance". Annual Review of Microbiology. ج. 71: 579–596. DOI:10.1146/annurev-micro-090816-093813. ISSN:1545-3251. PMID:28697667.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Ségurel، Laure؛ Bon، Céline (08 31, 2017). "On the Evolution of Lactase Persistence in Humans". Annual Review of Genomics and Human Genetics. ج. 18: 297–319. DOI:10.1146/annurev-genom-091416-035340. ISSN:1545-293X. PMID:28426286.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ "'Lifeless' prion proteins are 'capable of evolution'". Health. بي بي سي نيوز أون لاين. London. 1 يناير 2010. مؤرشف من الأصل في 25 سبتمبر 2015. اطلع عليه بتاريخ 10 أكتوبر 2015.
- ^ "Somatic cell genetic mutation". Genome Dictionary. Athens, Greece: Information Technology Associates. 30 يونيو 2007. مؤرشف من الأصل في 24 فبراير 2010. اطلع عليه بتاريخ 6 يونيو 2010.
- ^ "somatic mutation | genetics". Encyclopedia Britannica. مؤرشف من الأصل في 31 مارس 2017. اطلع عليه بتاريخ 31 مارس 2017.
- ^ Hartl, Jones، Daniel L., Elizabeth W. (1998). Genetics Principles and Analysis. Sudbury, Massachusetts: Jones and Bartlett Publishers. ص. 556. ISBN:978-0-7637-0489-6. مؤرشف من الأصل في 2019-12-21.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Milholland B، Dong X، Zhang L، Hao X، Suh Y، Vijg J (2017). "Differences between germline and somatic mutation rates in humans and mice". Nat Commun. ج. 8: 15183. Bibcode:2017NatCo...815183M. DOI:10.1038/ncomms15183. PMC:5436103. PMID:28485371.
[1*] Francis Collins , The Language of God , A Scientist Presents Evidence for Belief, Simon & Schuster UK Ltd 2007 , ISBN -13:978-1-84739-092-9
| في كومنز صور وملفات عن: طفرة |
