|
تضامنًا مع حق الشعب الفلسطيني |
عد دموي شامل
| عد دموي شامل (CBC) | |
|---|---|
عيّنة فحص عد دموي شامل أمام ورقة تعرض نتائج العد الدموي والعد التفريقي
| |
| ن.ف.م.ط. | D001772 |
| لوينك | Codes for CBC, e.g., 57021-8 |
| HCPCS-L2 | G0306 |
| مدلاين بلس | 003642 |
| تعديل مصدري - تعديل | |
العد الدموي الشامل (CBC) (بالإنجليزية: Complete blood count) يعرف أيضًا بتعداد الدم الكامل (FBC)، هي مجموعة من الفحوصات المخبرية الطبية التي توفر معلومات عن الخلايا الموجودة في دم الشخص. يشير إلى تعداد خلايا الدم البيضاء وخلايا الدم الحمراء والصفائح الدموية وتركيز الهيموجلوبين والهيماتوكريت (النسبة المئوية لحجم خلايا الدم الحمراء). حيث يتضمن مؤشرات خلايا الدم الحمراء والتي تشير إلى متوسط حجم ومحتوى الهيموجلوبين لخلايا الدم الحمراء، وقد يتضمن التعداد التفريقي لخلايا الدم البيضاء الذي يحسب الأنواع المختلفة منها.
غالبًا ما يُجرى فحص التعداد كجزء من التقييم الطبي، ويمكن استخدامه لمراقبة الصحة أو تشخيص الأمراض. تُفسّر النتائج من خلال مقارنتها بمجالات مرجعية، والتي تختلف حسب الجنس والعمر. وتُحدَّد حالات مثل فقر الدم ونقص الصفيحات من خلال نتائج غير طبيعية للتعداد. يمكن أن توفر مؤشرات خلايا الدم الحمراء معلومات حول سبب فقر الدم لدى الشخص مثل نقص الحديد ونقص فيتامين بي12، ويمكن أن تساعد نتائج الفحص التفريقي لخلايا الدم البيضاء في تشخيص الالتهابات الفيروسية والبكتيرية والطفيلية واضطرابات الدم مثل اللوكيميا؛ حيث لا تتطلب جميع النتائج التي تقع خارج النطاق المرجعي التدخل الطبي.
يُجرى فحص التعداد باستخدام معدات مخبرية أساسية أو محلل دموي آلي، يقوم بعد الخلايا وجمع المعلومات عن حجمها وهيكلها حيث يُقاس تركيز الهيموجلوبين، وتُحسب مؤشرات خلايا الدم الحمراء من قياسات خلايا الدم الحمراء والهيموجلوبين. ويمكن استخدام الاختبارات اليدوية لتأكيد النتائج غير الطبيعية بشكل مستقل. ما يقرب من 10-25% من العينات تتطلب مراجعة مسحات الدم يدويًا،[1] حيث يُصبغ الدم ويفحص تحت المجهر للتحقق من توافق نتائج المحلل مع مظهر الخلايا والبحث عن التشوهات. يمكن تحديد الهيماتوكريت يدويًا عن طريق الطرد المركزي للعينة وقياس نسبة خلايا الدم الحمراء، وفي المختبرات التي لا تستطيع الوصول إلى الأدوات الآلية، تُعد خلايا الدم تحت المجهر باستخدام عداد خلايا الدم.
في عام 1852، نشر كارل فييروردت الإجراء الأول لإجراء تعداد الدم، والذي تضمن نشر حجم معروف من الدم على شريحة مجهرية وإحصاء كل خلية منه. أدى اختراع عدّاد خلايا الدم في عام 1874 من قبل لويس تشارلز ملاسيز إلى تبسيط التحليل المجهري لخلايا الدم. وفي أواخر القرن التاسع عشر، طور بول إرليش وديمتري ليونيدوفيتش رومانوفسكي تقنيات لتلوين خلايا الدم البيضاء والحمراء التي لا تزال تستخدم لفحص مسحات الدم. طُوِّرت طرق آلية لقياس الهيموجلوبين في عشرينيات القرن الماضي، وقدم ماكسويل وينتروب طريقة هيماتوكريت دَمِ ونتروب في عام 1929، والتي سمحت له بدورها بتحديد مؤشرات خلايا الدم الحمراء. وكان أحد المعالم البارزة في أتمتة تعداد خلايا الدم هو مبدأ كولتر، الذي حصل على براءة اختراع من قبل والاس إتش كولتر في عام 1953. يستخدم مبدأ كولتر قياسات المعاوقة الكهربائية لحساب خلايا الدم وتحديد أحجامها؛ وهي تقنية لا تزال قيد الاستخدام في العديد من أجهزة التحليل الآلي. تضمنت الأبحاث الإضافية في السبعينيات استخدام القياسات البصرية لحساب وتحديد الخلايا، مما أتاح أتمتة التعداد التفريقي لخلايا الدم البيضاء.
الهدف من إجراء الفحص

يتكون الدم من جزء سائل يدعى البلازما، وجزء خلوي يحتوي على خلايا الدم الحمراء والبيضاء والصفائح الدموية.[2] ملاحظة 1 يقوم فحص العد الدموي الشامل بتقييم المكونات الخلوية الثلاثة للدم. واستنادًا إلى نتيجة الفحص تُقيّم حالة دم المريض ويمكن تحديد وجود بعض الأمراض مثل فقر الدم أو نقص الصفائح الدموية في الدم، وذلك في حال وجود زيادة أو نقصان ملحوظ في أحد الأنواع الثلاثة.[3] قد تؤثر التغيرات في العديد من أجهزة الجسم على الدم، لذلك فإن نتائج فحص العد الدموي الشامل مفيدة لتشخيص مجموعة واسعة من الحالات. نظرًا لكمية المعلومات التي يوفرها، يُعدُّ العد الدموي الشامل أحد أكثر الفحوصات المخبرية الطبية شيوعًا.[4][5][6]
غالبًا ما يُستخدم فحص العد الدموي الشامل للكشف عن الأمراض كجزء من التقييم الطبي.[7] يُستخدم هذا الفحص أيضًا عندما يظن مقدم الرعاية الصحية في إصابة شخص بمرض يؤثر على خلايا الدم؛ مثل العدوى أو الاعتلال الخثري (Coagulopathy) أو بعض أنواع السرطان. الأشخاص الذين يُشخَّصون باضطرابات قد تسبب نتائج غير طبيعية لفحص العد الدموي الشامل أو الذين يتلقون علاجات يمكن أن تؤثر على تعداد خلايا الدم قد يخضعون لفحص العد الدموي الشامل بانتظام لمراقبة صحتهم،[8][7] وغالبًا ما يُجرى الفحص كل يوم للناس المريضين بالمشفى.[9] قد تشير نتائج الفحص إلى الحاجة إلى نقل الدم أو نقل الصفائح الدموية.[10]
العد الدموي الشامل له تطبيقات في العديد من التخصصات الطبية. غالبًا ما يُجرى قبل خضوع الشخص لعملية جراحية للكشف عن فقر الدم، والتأكد من أن مستويات الصفائح الدموية كافية، والكشف عن العدوى في حال وجودها،[11][12] وكذلك بعد الجراحة، بحيث يمكن مراقبة فقدان الدم لدى المريض.[7][13] في طب الطوارئ، يُستخدام فحص العد الدموي الشامل للتحقق من العديد من الأعراض، مثل الحمى، آلام البطن، ضيق التنفس،[14][15][16] وتقييم النزيف والرَّضَّات.[17][18] يُراقَب تعداد الدم بشكل مستمر لدى الأشخاص الذين يخضعون للعلاج الكيميائي أو العلاج الإشعاعي للسرطان، لأن هذه العلاجات تثبط إنتاج خلايا الدم في نخاع العظام ويمكن أن تؤدي إلى إنتاج مستويات منخفضة للغاية من خلايا الدم البيضاء والصفائح الدموية والهيموجلوبين.[19] ومن الضروري للمرضى الذين يأخذون أدوية نفسية مثل كلوزابين وكاربامازيبين إجراء فحص العد الدموي الشامل بشكل منتظم، وذلك لأنها يمكن أن تؤدي في حالات نادرة إلى انخفاض في عدد خلايا الدم البيضاء (ندرة المحببات، أو agranulocytosis) قد يهدد الحياة.[20][21] ولأن فقر الدم أثناء الحمل يمكن أن يؤدي إلى نتائج سيئة للأم وطفلها، فإن العد الدموي الشامل هو جزء روتيني من رعاية ما قبل الولادة.[22] وفي الأطفال حديثي الولادة؛ قد تكون هناك حاجة لعمل فحص العد الدموي الشامل لفحص اليرقان أو لحساب عدد الخلايا غير الناضجة من خلايا الدم البيضاء، والتي يمكن أن تكون مؤشرًا للإنتان (تعفن الدم).[23][24]
يعد العد الدموي الشامل أداة أساسية لـعلم الدم، وهي دراسة أسباب وتشخيص وعلاج أمراض الدم والوقاية منها.[25] نتائج فحص العد الدموي الشامل وفحص اللطاخة تعكس عمل جهاز إنتاج الدم - الأعضاء والأنسجة المشاركة في إنتاج خلايا الدم وتطورها، وبالأخص نخاع العظام.[4][26] على سبيل المثال، يمكن أن يشير العدد المنخفض لجميع أنواع الخلايا الثلاثة (قلة الكريات الشاملة) إلى أن إنتاج خلايا الدم يكون متأثرًا باضطراب في نخاع العظم، ويمكن لفحص نخاع العظم أن يُساعد في تشخيص السبب.[27] قد تشير الخلايا غير الطبيعية في لطاخة الدم إلى اللوكيميا الحادة أو سرطان الغدد الليمفاوية،[26] في حين أن العدد المرتفع بشكل غير طبيعي من الخلايا المتعادلة (neutrophils) أو الخلايا الليمفاوية جنبًا إلى جنب مع الأعراض الأخرى ونتائج مسحة الدم قد تثير الشك في وجود مرض التكاثر النقوي أو اضطراب التكاثر اللمفاوي. نتائج فحص العد الدموي الشامل وعيّنة الدم يمكن أن تساعد في التمييز بين أسباب فقر الدم، مثل نقص التغذية، اضطرابات نخاع العظم، فقر الدم الانحلالي المكتسب أو الموروث مثل فقر الدم المنجلي والثلاسيميا.[28][29]
تمثل المجالات المرجعية للعد الدموي الشامل نطاق النتائج الموجودة في 95% من الأشخاص الأصحاء.[30]ملاحظة 2 بحكم التعريف؛ فإنَّ 5% من النتائج ستقع دائمًا خارج هذا النطاق، لذلك قد تعكس بعض النتائج غير الطبيعية تباينًا طبيعيًا بدلاً من الإشارة إلى مشكلة طبية.[31] يكون هذا مرجحًا بشكل خاص إذا كانت هذه النتائج خارج النطاق المرجعي بشكل طفيف، أو إذا كانت متوافقة مع النتائج السابقة، أو إذا لم يكن هناك نتائج غير طبيعية أخرى ذات صلة تظهر من قبل.[32] عندما يُجرى الاختبار على سكان أصحاء نسبيًا، فقد يتجاوز عدد النتائج غير الطبيعية غير المهمة سريريًا عدد النتائج التي تمثل الحالات المرضية.[33] لهذا السبب، توصي المنظمات المهنية في الولايات المتحدة والمملكة المتحدة وكندا بعدم إجراء فحص العد الدموي الشامل قبل إجراء الجراحة للعمليات الجراحية منخفضة المخاطر للأفراد الذين لا يعانون من حالات طبية ذات صلة.[11][34][35] يمكن أن يساهم سحب الدم المتكرر لفحص أمراض الدم في المرضى المقيمين في المستشفى في الإصابة بفقر الدم المكتسب من المستشفى وقد يؤدي إلى عمليات نقل دم غير ضرورية.[33]
عملية إجراء الفحص

تُجمع عينة من الدم في أنبوب يحتوي على مضاد تخثر -عادة تُستخدم أنابيب تحتوي على مادة ايديتا (ثنائي أمين الإيثيلين رباعي حمض الأسيتيك)- لمنع التخثر الطبيعي للدم.[36] يُؤخذ الدم عادة من الوريد، ولكن عندما يكون ذلك صعبًا، يمكن جمعه من الشعيرات الدموية بواسطة وخز الإصبع أو وخز الكعب عند الأطفال.[37][38] يُجرى الاختبار عادةً على محلل آلي، ولكن يمكن استخدام التقنيات اليدوية مثل فحص مسحة الدم أو اختبار الهيماتوكريت اليدوي للتحقق من النتائج غير الطبيعية.[39] يُجرى تعداد الخلايا وقياسات الهيموغلوبين يدويًا في المختبرات التي تفتقر إلى الأدوات الآلية.[40]
الفحص الآلي
على جهاز التحليل، تُحرَّك العينة لتوزيع الخلايا بالتساوي، ثم تُخفف وتُقسم إلى قناتين على الأقل، تُستخدم إحداهما لعد خلايا الدم الحمراء والصفائح الدموية، والأخرى لعد خلايا الدم البيضاء وتحديد تركيز الهيموجلوبين. تقيس بعض الأدوات الهيموجلوبين في قناة منفصلة، ويمكن استخدام قنوات إضافية لتعداد خلايا الدم البيضاء التفريقي، وتعداد الخلايا الشبكية والقياسات المتخصصة للصفائح الدموية.[41][42][43] تُعلّق الخلايا في تيار مائع وتُقاس خصائصها أثناء تدفقها عبر أجهزة الاستشعار في تقنية تعرف باسم قياس التدفق الخلوي.[44] ملاحظة 3 التركيز الهيدروديناميكي يُمَكِّن استخدامها لعزل الخلايا الفردية بحيث يمكن الحصول على نتائج أكثر دقة: تُحقن العينة المخففة في تيار من سائل منخفض الضغط، مما يؤدي إلى اصطفاف خلايا العينة في ملف واحد من خلال الجريان الصفيحي.[45][46]

لقياس تركيز الهيموجلوبين، يضاف كاشف كيميائي للعينة لتدمير خلايا الدم الحمراء في قناة منفصلة عن تلك المستخدمة في عد خلايا الدم الحمراء. بالنسبة لأجهزة التحليل التي تقوم بعد خلايا الدم البيضاء في نفس القناة التي يُقاس فيها الهيموغلوبين، فإن هذا يسمح بحساب عدد خلايا الدم البيضاء بسهولة أكبر.[47] محللو أمراض الدم يقومون بقياس الهيموغلوبين باستخدام قياس الضوء الطيفي (spectrophotometry) ويعتمدون على العلاقة الخطية بين امتصاص الضوء وكمية الهيموجلوبين الموجودة. وتستخدم المواد الكيميائية لتحويل أشكال مختلفة من الهيموغلوبين، مثل الأوكسي هيموغلوبين وكربوكسي هيموغلوبين، إلى شكل ثابت واحد، عادة «السيانميثيموغلوبين»، وذلك يُحدث تغييراً دائماً في اللون. إنّ امتصاص اللون الناتج، عند قياسه بطول موجي محدد -عادةً 540 نانومتر- يتناسب طرديًا مع تركيز الهيموجلوبين.[48][49]
أجهزة الاستشعار تقوم بِعَدّ وتحديد الخلايا في العينة باستخدام مبدأين أساسيين: معاوقة وتشتت الضوء.[50] يعمل تعداد الخلايا المعتمد على الممانعة على مبدأ كولتر: حيث تُعلّق الخلايا في سائل يحمل تيارًا كهربائيًا، وعندما تمر الخلايا عبر فتحة صغيرة، فإنها تسبب انخفاضًا في التيار بسبب ضعف توصيلها الكهربائي. وتتناسب السعة من نبض الجهد التي ولدت عند عبور الخلية من الفتحة مع حجم السائل المُزاح من الخلية؛ أي من حجم الخلية نفسها،[51][52] بينما يرتبط إجمالي عدد النبضات بعدد الخلايا في العينة. يُرسم توزيع أحجام الخلايا على الرسم البياني، ومن خلال تعيين عتبات الحجم بناءً على الأحجام النموذجية لكل نوع من الخلايا، يمكن تحديد مجموعات الخلايا المختلفة وحسابها.[53]

في تقنيات تشتت الضوء، يُوَجَّه الضوء من الليزر أو مصباح هالوجين-تنجستن إلى تيار الخلايا لجمع معلومات حول حجمها وبنيتها. تُشَتِّتُ الخلايا الضوء بزوايا مختلفة أثناء مرورها عبر الحزمة، والتي تُكتَشَف باستخدام أجهزة قياس الضوء.[54] التشتت الأمامي، الذي يشير إلى كمية الضوء المنتشر على طول محور الحزمة، ناتج أساسًا عن حيود الضوء ويرتبط بالحجم الخلوي، بينما يحدث التشتت الجانبي (الضوء المنتشر بزاوية 90 درجة) بسبب الانعكاس والانكسار ويوفر معلومات حول التعقيد الخلوي.[54][55]
يمكن استخدام الأساليب القائمة على الترددات الراديوية مع المعاوقة. تعمل هذه التقنيات على نفس مبدأ قياس الانقطاع في التيار حيث تمر الخلايا عبر فتحة، ولكن بما أن تيار التردد الراديوي عالي التردد ويخترق الخلايا، فإن اتساع النبضة الناتجة يتعلق بعوامل مثل الحجم النسبي للنواة، بنية النواة، وكمية الحبيبات (granules) في السيتوبلازم.[56][57] قد تتداخل الخلايا الحمراء الصغيرة والحطام الخلوي؛ اللذان هما متماثلان مع الصفائح الدموية في الحجم، مع عدد الصفائح الدموية، وقد يؤدي ذلك إلى عدم حساب الصفائح الدموية الكبيرة بدقة، لذلك يستخدم بعض المحللين تقنيات إضافية لقياس الصفائح الدموية، مثل الصبغ بمادة فلورية، تشتت الضوء متعدد الزوايا ووضع علامات على الأجسام المضادة أحادية النسيلة.[43]
يقيس معظم المحللين بشكل مباشر متوسط حجم خلايا الدم الحمراء، وهو ما يسمى الحجم الكروي المتوسط (MCV)، ويحسبون الهيماتوكريت بضرب عدد خلايا الدم الحمراء في الحجم الكروي المتوسط (MCV). يقيس البعض نسبة الهيماتوكريت من خلال مقارنة الحجم الكلي لخلايا الدم الحمراء بحجم الدم المأخوذ منه، ويحسبون الحجم الكروي المتوسط من الهيماتوكريت وعدد خلايا الدم الحمراء.[58] يُستخدم تركيز الهيموجلوبين، وعدد خلايا الدم الحمراء والهيماتوكريت لحساب متوسط كمية الهيموجلوبين داخل كل خلية دم حمراء، وهيموجلوبين الجسم المتوسط (MCH). وتركيزه؛ والذي هو متوسط تركيز الهيموجلوبين في الجسم (MCHC).[59] حساب آخر هوعرض توزيع خلايا الدم الحمراء (RDW)، مشتق من الانحراف المعياري لمتوسط حجم الخلية ويعكس التباين في الحجم الخلوي.[60]

بعد العلاج بالكواشف، تشكل خلايا الدم البيضاء ثلاث قمم مميزة عندما تُرسم أحجامها على الرسم البياني. تتوافق هذه القمم تقريبًا مع مجموعات الخلايا المحببة والخلايا الليمفاوية والخلايا أحادية النواة الأخرى، مما يسمح بإجراء فحص تفريقي ثلاثي الأجزاء بناءً على حجم الخلية وحده.[61][62] تستخدم أجهزة التحليل الأكثر تقدمًا تقنيات إضافية لتوفير فحص تفريقي مكون من خمسة إلى سبعة أجزاء، مثل تشتت الضوء أو تحليل الترددات الراديوية،[62] أو استخدام الأصباغ لصباغة مواد كيميائية معينة داخل الخلايا؛ على سبيل المثال: الأحماض النووية، التي توجد بتركيزات أعلى في الخلايا غير الناضجة، أو الميلوبيروكسيديز (البيروكسيديز النخاعي)[63] والذي هوإنزيم موجود في خلايا السلالة النخاعية.[64][65] قد تحسب الخلايا القاعدية (basophils) في قناة منفصلة حيث يقوم كاشف بتدمير الخلايا البيضاء الأخرى ويترك المستقعدات سليمة. تُحلل البيانات التي جُمعت من هذه القياسات وتُرسم على مخطط تشتت، حيث تشكل مجموعات مرتبطة بكل نوع من خلايا الدم البيضاء. ثمة نهج آخر لأتمتة فرق العد هو استخدام برمجيات المجهر الرقمي،[66] والذي يستخدم الذكاء الاصطناعي لتصنيف خلايا الدم البيضاء من الصور المجهرية من مسحة الدم. ومن ثَمَّ تُعرض صور الخلية لمحلل بشري، والذي يمكنه إعادة تصنيف الخلايا يدويًا إذا لزم الأمر.[67]
تستغرق معظم أجهزة التحليل أقل من دقيقة لإجراء جميع الاختبارات في العد الدموي الشامل.[50] نظرًا لأن المحللين يأخذون العديد من الخلايا الفردية ويعدونها، فإن النتائج تكون دقيقة للغاية.[68] ومع ذلك، قد لا تُشخّص بعض الخلايا غير الطبيعية بشكل صحيح، مما يتطلب مراجعة يدوية لنتائج الأداة والتعرف بوسائل أخرى على الخلايا غير الطبيعية التي لا تستطيع الأداة تصنيفها.[1][69]
الإختبار في نقطة الرعاية
يشير الإختبار في نقطة الرعاية إلى الاختبارات التي تُجرى خارج بيئة المختبر، كما هو الحال في سرير الشخص أو في العيادة.[70][71] طريقة الاختبار هذه أسرع وتستخدم دمًا أقل من الطرق التقليدية، ولا تتطلب موظفين مدربين بشكل خاص، لذا فهي مفيدة في حالات الطوارئ وفي المناطق ذات الوصول المحدود إلى الموارد. تشمل الأجهزة المستخدمة بشكل شائع لاختبار أمراض الدم في نقطة الرعاية جهاز هيموكيو (HemoCue)، وهو محَلِّل محمول يَستخدم القياس الطيفي الضوئي لقياس تركيز الهيموغلوبين في العينة، وجهاز آي ستات (i-STAT)، الذي يقيس قراءة الهيموغلوبين عن طريق تقدير تركيز خلايا الدم الحمراء من موصلية الدم.[71] يمكن قياس الهيموغلوبين والهيماتوكريت على أجهزة نقاط الرعاية المصممة لاختبار غازات الدم، ولكن هذه القياسات تتناسب أحيانًا بشكل سيئ بتلك التي يُحصل عليها من خلال الطرق القياسية.[70] هناك إصدارات مبسطة من أجهزة تحليل الدم المصممة للاستخدام في العيادات التي يمكن أن توفر العد الدموي الشامل والتفريقي.[72]
الفحص اليدوي

يمكن إجراء الاختبارات يدويًا في حالة عدم توفر المعدات الآلي أو عندما تشير نتائج جهاز التحليل إلى الحاجة إلى مزيد من التحقيق.[40] تُوضع علامة على النتائج التلقائية لمراجعة مسحة الدم اليدوية في 10-25% من الحالات، والتي قد تكون بسبب مجموعات الخلايا غير الطبيعية التي لا يستطيع جهاز التحليل عدها بشكل صحيح،[1] العلامات الداخلية التي أُنشئت بواسطة جهاز التحليل والتي تشير إلى أن النتائج يمكن أن تكون غير دقيقة[73] أو تقع نسبة كبيرة منها خارج النطاق المحدد.[69] للتحقيق في هذه المشكلات، يُتشر الدم على شريحة مجهرية، ويُصبغ بصبغة رومانوفسكي، ويُفحص تحت المجهر.[74] ثم يُقيِّم المُحلِّل مظهر خلايا الدم الحمراء والبيضاء والصفائح الدموية، ويُبلّغ عن التشوهات النوعية في حالة وجودها.[75] يمكن أن يكون للتغيرات في مظهر خلايا الدم الحمراء أهمية تشخيصية كبيرة - على سبيل المثال، يشير وجود الخلايا المنجلية إلى مرض فقر الدم المنجلي، ويتطلب عدد كبير من خلايا الدم الحمراء المجزأة (البلهارسيا أو «الكريات المنفلقة») إجراء تحقيق عاجل قدر الإمكان حيث يمكن أن تشير إلى فقر الدم الانحلالي باعتلال الأوعية الدقيقة.[76] في بعض الحالات الالتهابية وفي اضطرابات البروتين مثل المايلوما المتعددة (الورم النخاعي المتعدد)، قد تؤدي المستويات المرتفعة من البروتين في الدم إلى ظهور خلايا الدم الحمراء مكدسة معًا على مسحة الدم، وهو ما يسمى نضائد دموية.[77] بعض الأمراض الطفيلية مثل الملاريا والبابسيا، يمكن العثور على الكائنات الحية المسببة للمرض على مسحة الدم،[78] ويمكن تقديرعدد الصفائح الدموية من مسحة الدم، وهو أمر مفيد خاصّة إذا كان الفحص الآلي للصفائح الدموية غير دقيق.[69]
لإجراء فحص تفريقي يدوي لخلايا الدم البيضاء، يقوم مستخدم المجهر بحساب 100 خلية على عينة الدم ويصنفها بناءً على مظهرها؛ في بعض الأحيان تُعَدّ 200 خلية.[79] هذا يعطي النسبة المئوية لكل نوع من أنواع خلايا الدم البيضاء، وبضرب هذه النسب المئوية في العدد الإجمالي لخلايا الدم البيضاء، يمكن الحصول على العدد المطلق لكل نوع من خلايا الدم البيضاء.[80] العد اليدوي عرضة لخطأ أخذ العينات لأنه يُحسب عدد قليل جدًا من الخلايا مقارنة بالتحليل الآلي،[68] ولكن يمكنه تحديد الخلايا غير الطبيعية التي لا تستطيع أجهزة التحليل تحديدها،[64][69] مثل الخلايا الأرومية التي تظهر في اللوكيميا الحادة.[81] هناك ميزات كبيرة سريريًّا مثل التسمم بالحبيبات وظهور فجوات يُؤَكِّد أيضًا من الفحص المجهري لخلايا الدم البيضاء.[82]
يمكن إجراء الهيماتوكريت يدويًا عن طريق ملء أنبوب شُعَيرِي بالدم وطرده مركزيًا وقياس النسبة المئوية للدم الذي يتكون من خلايا الدم الحمراء.[58] هذا مفيد في بعض الحالات التي يمكن أن تكون فيها نتائج الهيماتوكريت الآلية غير صحيحة، مثل تعداد كريات الدم الحمراء المرتفع للغاية[58] أوالإرتفاع الشديد في عدد خلايا الدم البيضاء، والذي يسبب خطأً في قياسات خلايا الدم عن طريق التسبب في حساب خلايا الدم البيضاء كخلايا حمراء.[83]
يمكن حساب خلايا الدم الحمراء والبيضاء والصفائح الدموية باستخدام مقياس الكريات الدموية، وهو شريحة مجهرية تحتوي على حُجرة تحتوي على حجم معين من الدم المخفف. حُجرة مقياس الكريات الدموية محفورة بشبكة معايرة للمساعدة في عد الخلايا. تُعَد الخلايا الموجودة في الشبكة وتقسّم على حجم الدم الذي فُحِص، والذي يُحدد من خلال عدد المربعات المحسوبة على الشبكة، وذلك للحصول على تركيز الخلايا في العينة.[40][84] يُعَد تعداد الخلايا اليدوي كثيف العمل وغير دقيق مقارنة بالطرق الآلية، لذلك نادرًا ما يُستخدم إلا في المختبرات التي ليس لديها إمكانية الوصول إلى أجهزة التحليل الآلي.[40][84] لحساب خلايا الدم البيضاء، تُخفف العينة باستخدام سائل يحتوي على مركب يحلل خلايا الدم الحمراء، مثل أوكسالات الأمونيوم أو حمض الأسيتيك أو حمض الهيدروكلوريك.[85] في بعض الأحيان تُضاف صبغة إلى المادة المخففة لكي تبرز نوى خلايا الدم البيضاء، مما يسهل التعرف عليها. ويُجرى تعداد الصفيحات اليدوي بطريقة مماثلة، على الرغم من أن بعض الطرق تترك خلايا الدم الحمراء سليمة. يمكن أن يؤدي استخدام مجهر تباين الطور، بدلاً من المجهر الضوئي، إلى تسهيل التعرف على الصفائح الدموية.[86] نادرًا ما يُجرى تعداد خلايا الدم الحمراء يدويًا، لأنه غير دقيق وهناك طرق أخرى متاحة لتقييم خلايا الدم الحمراء مثل قياس الهيموجلوبين والهيماتوكريت اليدوي؛ ولكن إذا لزم الأمر، يمكن عد خلايا الدم الحمراء في الدم المخفف بمحلول ملحي.[87]
يمكن قياس الهيموغلوبين يدويًا باستخدام مقياس الطيف الضوئي أو مقياس الألوان. لقياس الهيموجلوبين يدويًا، تُخفف العينة باستخدام الكواشف التي تدمر خلايا الدم الحمراء لإطلاق الهيموجلوبين. وتُستخدم مواد كيميائية أخرى لتحويل أنواع مختلفة من الهيموجلوبين إلى شكل واحد، مما يسمح بقياسه بسهولة. ثم يُوضع المحلول في كويب مخبري قياس ويُقاس الامتصاص عند طول موجي محدد، والذي يعتمد على نوع الكاشف المستخدم. ويُستخدم معيار مرجعي يحتوي على كمية معروفة من الهيموجلوبين لتحديد العلاقة بين الامتصاص وتركيز الهيموجلوبين، مما يسمح بقياس مستوى الهيموجلوبين في العينة.[88]
في المناطق الريفية والمناطق الضعيفة اقتصاديًا، يكون الاختبار المتاح محدودًا بسبب صعوبة الوصول إلى المعدات والموظفين. في مرافق الرعاية الأولية في هذه المناطق، قد يقتصر الاختبار على فحص مورفولوجيا (شكل) الخلايا الحمراء والقياس اليدوي للهيموجلوبين، بينما تُجرى تقنيات أكثر تعقيدًا مثل تعداد الخلايا اليدوي والفحص التفريقي، وأحيانًا تعداد الخلايا الآلي، في مختبرات المنطقة. تتمتع المستشفيات والمراكز الأكاديمية الإقليمية والمحلية بإمكانية الوصول إلى أجهزة التحليل الآلي. في حالة عدم توفر مرافق المختبر، يمكن الحصول على تقدير لتركيز الهيموجلوبين عن طريق وضع قطرة دم على نوع موحد من الورق الماص ومقارنته بمقياس ألوان.[89]
رقابة الجودة
يجب معايرة أجهزة التحليل الآلي بانتظام. توفر معظم الشركات المصنعة دمًا محفوظًا مع نتائج محددة له وتُعدّل أجهزة التحليل إذا كانت النتائج مختلفة عن النتائج المحددة.[90] لضمان استمرار دقة النتائج، تُختبر عينات مراقبة الجودة، والتي تُوَفَّر عادةً من قبل الشركة المصنعة للأداة، مرة واحدة على الأقل يوميًا. تُفحص العينات لتقديم نتائج محددة، وتقارِن المختبرات نتائجها بالقيم المعروفة لضمان عمل الأداة بشكل صحيح.[91][92] بالنسبة للمختبرات التي لا تستطيع الوصول إلى مواد مراقبة الجودة التجارية، توصي منظمة تنظيمية هندية بتشغيل عينات المرضى من نسختين ومقارنة النتائج.[93] يمكن استخدام قياس المتوسط المتحرك، حيث يُقاس متوسط النتائج لعينات المرضى على فترات زمنية محددة، كأسلوب إضافي لمراقبة الجودة. بافتراض أن خصائص مجموعة المرضى تظل كما هي تقريبًا بمرور الوقت، يجب أن يظل المتوسط ثابتًا؛ يمكن أن تشير التحولات الكبيرة في متوسط القيمة إلى مشاكل في جهاز القياس.[91][92] قيم MCHC مفيدة بشكل خاص في هذا الصدد.[94]
بالإضافة إلى تحليل عينات مراقبة الجودة الداخلية، قد تتلقى المختبرات عينات خارجية لتقييم الجودة من المنظمات التنظيمية. في حين أن الغرض من مراقبة الجودة الداخلية هو التأكد من أن نتائج المحلل قابلة للتكرار داخل مختبر معين، فإن تقييم الجودة الخارجي يتحقق من أن النتائج من المختبرات المختلفة متوافقة مع بعضها البعض ومع القيم المستهدفة.[95] النتائج المتوقعة لعينات تقييم الجودة الخارجية لا يُكشف عنها للمختبر.[96] اعتُمدت برامج خارجية لتقييم الجودة على نطاق واسع في أمريكا الشمالية وأوروبا الغربية،[91] وغالبًا ما يُطلب من المختبرات المشاركة في هذه البرامج للحفاظ على الاعتماد.[97] وقد تجعل المشكلات اللوجستية من الصعب على المختبرات في المناطق منخفضة الموارد تنفيذ مخططات خارجية لتقييم الجودة.[98]
اختبارات متضمنة
فحص العد الدموي الشامل يقيس كميات الصفائح الدموية وخلايا الدم الحمراء وخلايا الدم البيضاء، جنبا إلى جنب مع الهيموجلوبين وقيم الهيماتوكريت.تعرض قيم مؤشرات خلايا الدم الحمراء -MCV، MCH و MCHC- التي تصف حجم خلايا الدم الحمراء ومحتواها من الهيموجلوبين، مع عرض توزيع خلايا الدم الحمراء (RDW)، الذي يقيس مقدار الاختلاف في أحجام خلايا الدم الحمراء. قد يُجرى فحص تفريقي لخلايا الدم البيضاء، الذي يحدد عدد الأنواع المختلفة من خلايا الدم البيضاء، ويُضمَّن عدد من خلايا الدم الحمراء غير الناضجة (الخلايا الشبكية) في بعض الأحيان.[5][99]
خلايا الدم الحمراء، الهيموجلوبين، والهيماتوكريت
| نوع التحليل | النتائج | المجال المرجعي |
|---|---|---|
| RBC | 5.5*1012 /لتر | 4.5–5.7 |
| WBC | 9.8 * 109 /لتر | 4.0–10.0 |
| HGB | 123 غم/لتر | 133–167 |
| HCT | 0.42 | 0.35–0.53 |
| MCV | 76 fL | 77–98 |
| MCH | 22.4 pg | 26–33 |
| MCHC | 293 غم/لتر | 330–370 |
| RDW | 14.5% | 10.3–15.3 |
تقوم خلايا الدم الحمراء بإيصال الأكسجين من الرئتين إلى الأنسجة وعند عودتها تحمل ثاني أكسيد الكربون مرة أخرى إلى الرئتين حيث يخرج من خلالهما. وتُجرى هذه الوظائف بواسطة هيموجلوبين الخلايا.[101] يَعُدُّ جهاز التحليل خلايا الدم الحمراء، ويُعطي النتيجة في وحدات من 106 (مليون) خليّة لكل ميكرولتر من الدم (1× 106/μL) أو 1012 خلية لكل لتر (1× 1012/لتر)، ويقيس متوسط حجمها، والذي يسمى متوسط حجم الخلايا ويعبر عنه في فيمتوليتر أو ميكرومترات مكعبة.[5] يمكن اشتقاق الهيماتوكريت (HCT) أو حجم الخلايا المكدّسة (PCV) بضرب متوسط حجم الخلية (MCV) في عدد خلايا الدم الحمراء، والذي هو قياس للنسبة المئوية من خلايا الدم الحمراء في الدم.[58] وعندما يُفحص الهيماتوكريت مباشرة، يمكن حساب حجم الخلية المتوسط (MCV) من تعداد خلايا الدم الحمراء والهيماتوكريت.[102][103] بعد فحص خلايا الدم الحمراء تُحلل الخلايا (تنفجر) ويُفحص الهيموجلوبين وتُعطى النتيجة بوحدة غرام/لتر (g/L) أو غرام/ديسيلتر.[104] وبافتراض أن خلايا الدم الحمراء طبيعية، هناك علاقة ثابتة بين الهيموجلوبين والهيماتوكريت: نسبة الهيماتوكريت هي تقريبًا ثلاث مرات أكبر من قيمة الهيموغلوبين في غرام/ديسيلتر، بإضافة أو إنقاص ثلاثة. هذه العلاقة، التي تسمى قاعدة الثلاثة، يمكن استخدامها للتأكد من أن نتائج الفحص صحيحة.[105]
يُحسب قياسان آخران من عدد خلايا الدم الحمراء، وتركيز الهيموجلوبين، والهيماتوكريت: هيموجلوبين الكريّة الوسطي (MCH) وتركيز الهيموجلوبين الكريوي الوسطي (MCHC).[106][107] تصف هذه المَعلَمات محتوى الهيموجلوبين لكل خلية دم حمراء. هيموجلوبين الكريّة الوسطي (MCH) وتركيز الهيموجلوبين الكريوي الوسطي (MCHC) يمكن أن يكونا مربكين؛ هيموجلوبين الكريّة الوسطي (MCH) هو مقياس لمتوسط كمية الهيموغلوبين لكل خلية دم حمراء. ويعطي تركيز الهيموجلوبين الكريوي الوسطي (MCHC) متوسط نسبة الخلية الذي يشغله الهيموجلوبين. لا يأخذ هيموجلوبين الكريّة الوسطي (MCH) في الاعتبار حجم خلايا الدم الحمراء في حين أن تركيز الهيموجلوبين الكريوي الوسطي (MCHC) يفعل.[108] وبشكل جماعي، يشار إلى MCV وMCH وMCHC على أنها مؤشرات خلايا الدم الحمراء.[106][107] وتكون التغيرات في هذه المؤشرات مرئية على عيّنة الدم: حيث يمكن تحديد خلايا الدم الحمراء الكبيرة أو الصغيرة بشكل غير طبيعي بالمقارنة مع أحجام خلايا الدم البيضاء، وتظهر الخلايا ذات تركيز منخفض من الهيموجلوبين شاحبة.[109] وتُحسَب معلمة أخرى من القياسات الأولية لخلايا الدم الحمراء: وهي عرض توزيع خلايا الدم الحمراء أو RDW، والذي يعكس درجة الاختلاف في حجم الخلايا.[110]
يشير انخفاض غير طبيعي في الهيموجلوبين أو الهيماتوكريت أو عدد خلايا الدم الحمراء إلى فقر الدم.[111] فقر الدم ليس تشخيصاً بحدِّ ذاته، لكنه يشير إلى حالة تؤثر على خلايا الدم الحمراء للشخص.[80] الأسباب العامة لفقر الدم تشمل فقدان الدم، وإنتاج خلايا الدم الحمراء المعيبة (إنتاج خلايا دم حمراء غير فعالة)، وانخفاض إنتاج خلايا الدم الحمراء (إنتاج خلايا دم حمراء غير كافية)، وزيادة تدمير خلايا الدم الحمراء (فقر الدم الأنحلالي).[112] يقلل فقر الدم من قدرة الدم على حمل الأكسجين، مما يسبب أعراضًا مثل التعب وضيق التنفس.[113] إذا انخفض مستوى الهيموجلوبين إلى ما دون العتبات بناءً على الحالة السريرية للشخص، فقد يكون نقل الدم ضروريًا.[114]

ويسمى العدد المتزايد من خلايا الدم الحمراء، والذي يؤدي عادة إلى زيادة في الهيموجلوبين والهيماتوكريت،ملاحظة 4 بكثرة الكريات الحمر أو كثرة الحمر أو فرط كريات الدم الحمراء.[115] يمكن أن يسبب الجفاف أو استخدام مدرات البول مرض كثرة كريات الدم الحمر «بشكل نسبي» وذلك عن طريق تقليل كمية البلازما مقارنة بخلايا الدم الحمراء. يمكن أن تحدث زيادة حقيقية في عدد خلايا الدم الحمراء، تسمى بكثرة كريات الدم الحمر المطلقة، عندما ينتج الجسم المزيد من خلايا الدم الحمراء للتعويض عن مستويات الأكسجين المنخفضة بشكل مزمن في حالات مثل أمراض الرئة أو القلب، أو عندما يكون لدى الشخص مستويات عالية بشكل غير طبيعي من الإريثروبويتين (EPO) أو مكوِّن الكريات الحُمر، وهو هرمون يحفز إنتاج خلايا الدم الحمراء. في مرض كثرة الحمر الحقيقية، ينتج نخاع العظم خلايا حمراء وخلايا دم أخرى بمعدل مرتفع بشكل مفرط.[116]
تقييم مؤشرات خلايا الدم الحمراء (هيموجلوبين الكريّة الوسطي (MCH) وتركيز الهيموجلوبين الكريوي الوسطي (MCHC) ومتوسط حجم الخلية (MCV) وعرض توزيع خلايا الدم الحمراء (RDW)) مفيد في تحديد سبب فقر الدم. إذا كان متوسط حجم الخلية (MCV) منخفضًا؛ يسمى فقر الدم صغير الكريات، في حين أن فقر الدم مع وجود MCV مرتفع يسمى فقر الدم كبير الكريات. ويسمى فقر الدم مع قيم MCHC منخفضة فقر الدم الناقص الصباغ. إذا كان فقر الدم موجودًا ولكن مؤشرات خلايا الدم الحمراء طبيعية، فإن فقر الدم يعتبر سويّ الكريات (فقر الدم السوي الكريات).[109] مصطلح فرط الإنصباغ، في إشارة إلى وجود قيم MCHC عالية، لا يستخدم عمومًا. ارتفاع قيم MCHC فوق القيمة المرجعية العليا أمر نادر الحدوث، يحدث بشكل رئيسي في حالات مثل كثرة الكريات الحمر الكروية، ومرض الخلايا المنجلية ومرض الهيموجلوبين c.[107][117] يمكن أن يكون ارتفاع قيم MCHC أيضًا نتيجة خاطئة من حالات مثل تخثر خلايا الدم الحمراء (مما يسبب انخفاضًا زائفًا في عدد خلايا الدم الحمراء، مما يرفع من قيم MCHC)[118][119] أو كميات مرتفعة للغاية من الدهون في الدم (مما يسبب زيادة خاطئة في نتيجة الهيموجلوبين).[117][120]
عادة ما يرتبط فقر الدم صغير الكريات بنقص الحديد، الثلاسيميا، وفقر الدم من الأمراض المزمنة، في حين يرتبط فقر الدم الكلي مع إدمان الكحول، ونقص الفوليك ونقص فيتامين B12، واستخدام بعض الأدوية وبعض أمراض نخاع العظام. يمكن أن يؤدي فقدان الدم الحاد وفقر الدم الأنحلالي واضطرابات نخاع العظام والأمراض المزمنة المختلفة إلى فقر الدم السويّ الكريات.[107][121] تخدم قيم MCV غرض إضافي في مراقبة جودة المختبرات. حيث أن قيم MCV مستقرة نسبيا مع مرور الوقت بالمقارنة مع غيرها من معلمات فحص العد الدموي الكامل، لذلك قد يشير تغيير كبير في MCV إلى أن العينة أُخذت من المريض الخطأ.[122]
لا يوجد لدى قيم عرض توزيع خلايا الدم الحمراء (RDW) المنخفضة أي أهمية سريرية، ولكن ارتفاع قيم عرض توزيع خلايا الدم الحمراء (RDW) يمثل زيادة الاختلاف في حجم خلايا الدم الحمراء، وهي حالة تعرف باسم تفاوت حجم كريات الدم الحمراء.[110] مرض تفاوت حجم كريات الدم الحمراء شائع في فقر الدم الغذائي مثل فقر الدم الناجم عن نقص الحديد وفقر الدم بسبب نقص فيتامين بي 12 أو نقص الفوليك، في حين أن الأشخاص المصابين بالثلاسيميا قد يكون لديهم قيم عرض توزيع خلايا الدم الحمراء (RDW) طبيعية.[110] بناءً على نتائج فحص العد الدمي الكامل، يمكن اتخاذ خطوات أخرى للتحقيق في فقر الدم، مثل اختبار الفيريتين للتأكد من وجود نقص الحديد، أو فصل كهربائي للهيموجلوبين لتشخيص اعتلال الهيموجلوبين مثل مرض الثلاسيميا أو مرض الخلايا المنجلية.[123]
خلايا الدم البيضاء
|
|
تقوم خلايا الدم البيضاء بالدفاع ضد أي عدوى وتشارك في الاستجابة الالتهابية.[125] غالبًا ما يحدث ارتفاع في عدد خلايا الدم البيضاء، والذي يُسمى ارتفاع الكريات البيض، في حالات العدوى والالتهاب والإجهاد الفسيولوجي. ويمكن أيضا أن يكون نتيجة لأحد الأمراض التي تؤدي إلى إنتاج غير طبيعي لخلايا الدم، مثل مرض التكاثر النقوي والاضطرابات التكاثرية اللمفية.[126] يمكن أن يؤدي انخفاض عدد خلايا الدم البيضاء، الذي يطلق عليه قلّة الكريات البيض، إلى زيادة خطر الإصابة بالعدوى،[127] ويحدث في حالات مثل العلاج الكيميائي والعلاج الإشعاعي والعديد من الحالات التي تمنع إنتاج خلايا الدم.[128] يرتبط الإنتان (تعفّن الدم) بكل من إرتفاع الكريات البيض وقلّة الكريات البيض.[129] عادة ما تُعطى نتيجة إجمالي عدد خلايا الدم البيضاء في الخلايا لكل ميكرومتر من الدم (/μL) أو 109 خلايا لكل لتر (1× 109/L).[129]
في الفحص التفريقي لخلايا الدم البيضاء، تُحَدَّد أنواع مختلفة من خلايا الدم البيضاء وتُرز. وتُعطى النتائج كنسب مئوية وأرقام مطلقة لكل وحدة حجم. وعادةً ما تُقاس خمسة أنواع من خلايا الدم البيضاء — العدلات، الخلايا اللمفاوية، الخلايا الأحادية، الخلايا اليوزينية، والخلايا القاعدية.[130] بعض الأجهزة تُعطي نتيجة خلايا الدم البيضاء غير الناضجة، وهو تصنيف للخلايا القاعدية الأوّلية؛ تحيديدًا الخلايا النخاعية القبلية والخلايا النخاعية المتبدّلة والخلايا النقوية.[131] ملاحظة 5 وتُعطى نتائج عن أنواع الخلايا الأخرى إذا حُددت في الفرق اليدوي.[132]
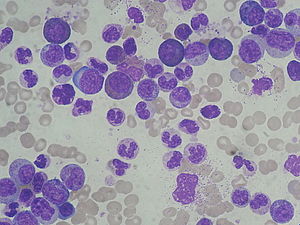
النتائج التفريقية مفيدة في تشخيص ورصد العديد من الحالات الطبية. على سبيل المثال، يرتبط عدد العدلات المرتفع (كثرة العدلات) بعدوى بكتيرية أو التهابات أو الاضطرابات النخاعية،[133][134] في حين أن انخفاض عدد العدلات (قلة الخلايا المتعادلة) قد يحدث في الأفراد الذين يخضعون للعلاج الكيميائي أو يأخذون أدوية معينة، أو الذين لديهم أمراض تؤثر على نخاع العظام.[135][136] يمكن أن تحدث قلة الخلايا المتعادلة بسبب بعض العيوب الخلقية ويمكن أن تحدث بشكل عابر بعد العدوى الفيروسية أو البكتيرية لدى الأطفال.[137] يُعالج الأشخاص الذين يعانون من قلّة الخلايا المتعادلة الشديدة والذين لديهم علامات سريرية للعدوى بالمضادات الحيوية للوقاية من الأمراض التي قد تهدد الحياة.[138]
يُطلق مصطلح «ازاحة إلى اليسار» إلى عدد متزايد من العدلات الأطرية -العدلات الشابّة التي تفتقر إلى النوى المجزأة- أو الحبيبات غير ناضجة ويحدث في حالات مثل الإنتان وبعض اضطرابات الدم، ولكنّ حصوله أمر طبيعي في الحمل.[139][140] يرتبط ارتفاع عدد الخلايا الليمفاوية (كثرة اللمفاويات) بالعدوى الفيروسية[141] والاضطرابات اللمفية مثل ابيضاض الدم اللمفاوي المزمن.[142] يرتبط ارتفاع عدد الخلايا الأحادية (كثرة الوحيدات) مع حالات التهابية مزمنة.[143] وغالبا ما يزداد عدد الخلايا اليوزينية (كثرة اليوزينيات) في حالات العدوى الطفيلية وظروف الحساسية.[144] يمكن أن يحدث عدد متزايد من الخلايا القاعديّة، الذي يطلق عليه كثرة المستقعدات، في اضطرابات نخاعية مثل ابيضاض المحببات المزمن وكثرة الحمر الحقيقية.[134] وجود بعض أنواع الخلايا غير الطبيعية، مثل الخلايا الأرومية أو الخلايا اللمفاوية ذات الخصائص الورميّة، يوحي بوجود سرطان دموي خبيث.[81][145]
الصفائح الدموية
تلعب الصفائح الدموية دورًا أساسيًا في التخثر. عندما يكون جدار الأوعية الدموية مدمرًاً، ُلتصق الصفائح الدموية بالسطح المكشوف في موقع الإصابة وتسد الفجوة. يؤدي التنشيط المتزامن لسلسلة التخثرالفسيولوجية إلى تكوين الفايبرين، مما يعزز الصفائح الدموية لإنشاء خثرة مستقرة.[146] قد يتسبب انخفاض عدد الصفائح الدموية، المعروف باسم قلة الصفيحات، في حدوث نزيف إذا كان شديدًا.[147] يمكن أن يحدث في الأفراد الذين يخضعون للعلاجات التي تقمع (توقف نشاط) نخاع العظم، مثل العلاج الكيميائي أو العلاج الإشعاعي، أو تناول بعض الأدوية، مثل الهيبارين، التي يمكن أن تحفز الجهاز المناعي على تدمير الصفائح الدموية. قلة الصفيحات هي سمة من سمات العديد من اضطرابات الدم، مثل سرطان الدم الحاد وفقر الدم اللا تنسجي، فضلا عن بعض أمراض المناعة الذاتية.[148][149] إذا كان عدد الصفائح الدموية منخفضًا للغاية، فقد يُجرى نقل للصفائح الدموية.[150] قد يحدث تخثر الدم، أي ارتفاع عدد الصفائح الدموية، في حالات الالتهاب أو الصدمة،[151] وكذلك في نقص الحديد،[152] وقد يصل عدد الصفائح الدموية إلى مستويات عالية بشكل استثنائي في الأشخاص الذين يعانون من كثرة الصفيحات الأولية، وهو مرض نادر في الدم.[151] تُعطى نتائج عدد الصفائح الدموية في وحدات من الخلايا لكل ميكرومتر من الدم (/μL)،[153] أو 103 خلايا لكل ميكرومتر (× 103/μL)، أو 109 خلايا للتر الواحد (× 109/L).
متوسط حجم الصفائح الدموية (MPV) يقيس متوسط حجم الصفائح الدموية بوحدة فيمتوليتر. ويمكن أن تساعد في تحديد سبب قبة الصفائح الدموية؛ حيث قد يحدث ارتفاع في قيم متوسط حجم الصفائح الدموية عندما تُحرر الصفائح الدموية الشابّة في مجرى الدم للتعويض عن زيادة تدمير الصفائح الدموية، في حين انخفاض إنتاج الصفائح الدموية بسبب خلل في نخاع العظام يمكن أن يؤدي إلى انخفاض في قيم متوسط حجم الصفائح الدموية. وقيم متوسط حجم الصفائح الدموية مفيدة أيضًا للتمييز بين الأمراض الخلقية التي تسبب قلة الصفائح الدموية.[110][154] تُعطى نتائج عن كسر الصفائح الدموية غير الناضج (IPF) أو عدد الصفائح الدموية غير الناضجة من قبل بعض أجهزة التحليل وتقدم معلومات حول معدل إنتاج الصفائح الدموية عن طريق قياس عدد الصفائح الدموية غير الناضجة في الدم.[155]
اختبارات أخرى
عدد الشبكيات

الخلايا الشبكية هي خلايا دم حمراء غير ناضجة وتحتوي على حمض نووي ريبوزي، على عكس الخلايا الناضجة. يُجرى تعداد الخلايا الشبكية كجزء من العد الدموي الشامل، وعادةً ما يُساعد في التحقق من سبب فقر الدم عند الشخص أو لتقييم استجابته للعلاج. يمكن أن يشير فقر الدم مع ارتفاع عدد الشبكيات إلى أن نخاع العظام يقوم بإنتاج خلايا الدم الحمراء بمعدل أعلى للتعويض عن فقدان الدم أو تحلله،[66] في حين أن فقر الدم مع انخفاض عدد الخلايا الشبكية قد يشير إلى أن الشخص لدى جسمه قدرة أقل على إنتاج خلايا الدم الحمراء.[156] عندما يُعطى الأشخاص الذين يعانون من فقر الدم الغذائي مكملات المغذيات، تشير الزيادة في عدد الشبكيات إلى أن أجسامهم تستجيب للعلاج عن طريق إنتاج المزيد من خلايا الدم الحمراء.[157] تقوم أجهزة تحليل أمراض الدم بإجراء تعدادات الشبكيات عن طريق صباغة خلايا الدم الحمراء بصبغة ترتبط بالحمض النووي الريبوزي وقياس عدد الخلايا الشبكية من خلال تشتت الضوء أو التحليل الفلورسي. يمكن إجراء الاختبار يدويًا عن طريق صباغة الدم بصبغة الميثيلين الزرقاء الجديدة وحساب النسبة المئوية لخلايا الدم الحمراء التي تحتوي على الحمض النووي الريبيوزي تحت المجهر. يُعبَّر عن عدد الشبكيات على أنه رقم مطلق[156] أو كنسبة مئوية من خلايا الدم الحمراء.[158]
بعض الأدوات تقيس متوسط كمية الهيموغلوبين في كل خلية شبكية؛ وهي معلمة تمت دراستها كمؤشر لنقص الحديد لدى الأشخاص الذين لديهم حالات تتداخل مع الاختبارات القياسية.[159] الكسر للخلايا الشبكية غير الناضجة (IRF) هو قياس آخر ينتجه بعض أجهزة التحليل ويحدد كمية نضج الشبكيات: الخلايا الأقل نضجا تحتوي كمية أكبر من الحمض النووي الريبوزي وبالتالي تنتج إشارة فلورية أقوى. يمكن أن تكون هذه المعلومات مفيدة في تشخيص فقر الدم وتقييم إنتاج خلايا الدم الحمراء بعد علاج فقر الدم أو زراعة نخاع العظام.[160]
خلايا الدم الحمراء ذات النوى
أثناء تشكيلها في نخاع العظام -وفي الكبد والطحال في الأجنة-[161] تحتوي كل خلية دم حمراء على نواة، وهي عادة ما تكون غائبة في الخلايا الناضجة التي تدور في مجرى الدم.[162] عند اكتشافها، يشير وجود خلايا حمراء ذات نواة، خاصة في الأطفال والبالغين، إلى زيادة الطلب على خلايا الدم الحمراء، والتي يمكن أن تكون ناجمة عن النزيف أو بعض أنواع السرطان أو فقر الدم.[110] يمكن لمعظم أجهزة التحليل الكشف عن هذه الخلايا كجزء من فحص عدد الخلايا التفريقي. يمكن أن تسبب أعداد كبيرة من الخلايا الحمراء ذات النوى بفحص عدد خلايا الدم البيضاء على أنها عالية بشكل خاطئ، الأمر الذي سيتطلب ضبطًا وتعديلًا للنتائج.[163]
معلمات أخرى
تقوم أجهزة تحليل أمراض الدم المتقدمة بإنتاج قياسات جديدة لخلايا الدم التي أظهرت أهمية تشخيصية في الدراسات البحثية ولكنها لم تجد بعد استخدامًا سريريًا واسع النطاق.[159] على سبيل المثال، تنتج بعض أنواع أجهزة التحليل قراءات متناسقة تشير إلى حجم كل مجموعة خلايا الدم البيضاء وموضعها. وقد دُرست هذه المعلمات (والتي تسمّى: بيانات جمهور الخلايا)[164] كعلامات محتملة لاضطرابات الدم والالتهابات البكتيرية والملاريا. يمكن أن تقوم أجهزة التحليل)التي تستخدم البيروكسيديز النخاعي (أو ماييلوبيروكسيديز) لإنتاج عدد تفريقي) بقياس إظهار خلايا الدم البيضاء للإنزيم، والذي يتغير في العديد من الاضطرابات.[67] يمكن لبعض الأدوات الإبلاغ عن النسبة المئوية لخلايا الدم الحمراء بالإضافة إلى تقديم نتيجة متوسط قيمة MCHC، أو تقديم عدد من الخلايا الحمراء المجزأة (كريّة منفلقة)،[159] التي تحدث في بعض أنواع فقر الدم الانحلالي.[165] ولأن هذه المعلمات غالباً ما تكون محددة لعلامات تجارية معينة من أجهزة التحليل، فإنه من الصعب على المختبرات تفسير ومقارنة النتائج.[159]
المجالات المرجعية
| الفحص | الوحدة | البالغون | حديثو الولادة
(عمر 0-1 أيام) |
الأطفال
(عمر 4-7 سنوات) |
|---|---|---|---|---|
| WBC | × 109/لتر | 3.6–10.6 | 9.0–37.0 | 5.0–17.0 |
| RBC | × 1012/لتر |
|
4.10–6.10 | 4.00–5.20 |
| HGB | غم/لتر |
|
165–215 | 102–152 |
| HCT | لتر/لتر |
|
0.48–0.68 | 0.36–0.46 |
| MCV | fL | 80–100 | 95–125 | 78–94 |
| MCH | pg | 26–34 | 30–42 | 23–31 |
| MCHC | غم/لتر | 320–360 | 300–340 | 320–360 |
| RDW | % | 11.5–14.5 | مرتفعةملاحظة 6 | 11.5–14.5 |
| PLT | × 109/لتر | 150–450 | 150–450 | 150–450 |
| العدلات | × 109/لتر | 1.7–7.5 | 3.7–30.0 | 1.5–11.0 |
| لمفاويات | × 109/لتر | 1.0–3.2 | 1.6–14.1 | 1.5–11.1 |
| الخلايا الأحادية | × 109/لتر | 0.1–1.3 | 0.1–4.4 | 0.1–1.9 |
| الخلايا اليوزينية | × 109/لتر | 0.0–0.3 | 0.0–1.5 | 0.0–0.7 |
| المستقعدات | × 109/لتر | 0.0–0.2 | 0.0–0.7 | 0.0–0.3 |
يُفَسَّرْ العد الدموي الشامل من خلال مقارنة النتائج بالمجالات المرجعية، والتي تمثل النتائج الموجودة في 95% من الأشخاص الأصحاء.[30] بناءً على التوزيع الاحتمالي الطبيعي، تختلف مجالات العينات المختبرة حسب الجنس والعمر. في المتوسط، تمتلك الإناث البالغات قيم أقل من الهيموغلوبين، والهيماتوكريت، وعدد خلايا الدم الحمراء مُقَارَنَةً بالذكور؛ وبعد سن اليأس يقل الفرق ولكنّه يبقى موجودًا.[167]
يختلف دم الأطفال حديثي الولادة اختلافا كبيرا عن دم الأطفال الأكبر سِناً، الذي يختلف أيضًا عن دم البالغين. إن تعداد الهيموجلوبين، والهيماتوكريت، وخلايا الدم الحمراء لحديثي الولادة مرتفع للغاية لتعويض انخفاض مستويات الأكسجين في الرحم، ووجود النسبة العالية من هيموجلوبين الجنين، والذي هو أقل فعالية في توصيل الأكسجين إلى الأنسجة مُقَارَنَةً بأشكال الهيموجلوبين الناضجة، داخل خلايا الدم الحمراء.[168][169] أيضًا تزداد قيم MCV، ويزداد عدد خلايا الدم البيضاء مع كثرة الخلايا الحبيبية المتعادلة.[168][170] يبدأ عدد خلايا الدم الحمراء والقيم ذات الصلة به في الانخفاض بعد فترة وجيزة من الولادة، وتصل إلى أدنى نقطة لها في حوالي شهرين من العمر وتزداد بعد ذلك.[171][172] تكون خلايا الدم الحمراء لدى الرضع والأطفال الأكبر سِناً أصغر حجماً، مع وجود قيم MCH أقل من البالغين. في الفحوصات التفريقية لخلايا الدم البيضاء للأطفال، غالبًا ما يفوق عدد الخلايا الليمفاوية عدد الخلايا المتعادلة، بينما يغلب عدد الخلايا المتعادلة في البالغين.[168]
هناك اختلافات أخرى بين السكان قد تؤثر على المجالات المرجعية: على سبيل المثال، فإن الأشخاص الذين يعيشون على ارتفاعات عالية لديهم نتائج أعلى للهيموغلوبين، والهيماتوكريت، وخلايا الدم الحمراء، واالناس الذين لديهم جينات إفريقية لديهم أعداد أقل من خلايا الدم البيضاء في المتوسط.[173] يؤثر نوع المحلل المُستخدم لتشغيل فحص الـ CBC على المجالات المرجعية أيضاً. ولذلك يحدد كل مختبر مجالات مرجعية على أساس مجموعة المرضى والمعدات الخاصة بها.[174][175]
محددات

إن بعض الحالات الطبية (المَرَضية) والمشكلات في تحضير عينة الدم؛ قد تؤدي إلى نتائج غير دقيقة للفحص، حيث إذا كانت العينة متخثرة بشكل واضح -والتي يمكن أن تكون هكذا بسبب مشكلة في سحب الدم- فإنها غير مناسبة للاختبار؛ لأن نتيجة فحص الصفائح الدموية ستكون خاطئة وستظهر منخفضة والنتائج الأخرى قد تظهر غير طبيعية.[176][177] بالنسبة للعينات المخزنة في درجة حرارة الغرفة لعدة ساعات فإنها قد تعطي قراءات عالية (خاطئة) لنتيحة فحص الحجم الكروي الوسطي؛[178] حيث أن خلايا الدم الحمراء تكون منتفخة بسبب إمتصاصها الماء من البلازما، بالإضافة إلى أن نتائج الصفائح الدموية وخلايا الدم البيضاء تكون غير دقيقة في العينات القديمة؛ حيث تتحلل هذه الخلايا بمرور الوقت.[83]
قد تُظهر العينات المأخوذة من الأفراد الذين لديهم مستويات عالية جدًا من البيليروبين أوالدهون في عينات البلازما خاصَّتُهُم (يشار إليهم باسم عينة يرقانية (صفراوية) أوعينة شحمية، على التوالي)[179] قراءات عالية (خاطئة) للهيموجلوبين، لأن هذه المواد تغيِّر لون وشفافية العينة مما يتعارض مع قياس الهيموجلوبين.[180] يمكن تخفيف هذا التأثير عن طريق استبدال البلازما بمحلول ملحي.[83]
ينتج بعض الأشخاص جسمًا مضادًا يدفع الصفائح الدموية لتكون تكتلات (خثرات) عندما يُسحب دَمُهُم في أنابيب تحتوي على مادة إيديتا، وهي مادة مضادة للتخثر وتستخدم عادةً عند جمع عينات العد الدموي الشامل. يمكن حساب تكتل (تخثُّر) الصفائح الدموية كصفيحة دموية واحدة بواسطة أجهزة التحليل الآلي، مما يؤدي إلى انخفاض عدد الصفائح الدموية بشكل خاطئ، يمكن تجنب ذلك عن طريق استخدام مضادات تخثر بديلة مثل سترات الصوديوم أو الهيبارين.[181]
هناك حالة أخرى تحدث بوساطة الأجسام المضادة والتي يمكن أن تؤثر على نتائج فحص العد الدموي الشامل تسمى ظاهرة تراص خلايا الدم الحمراء أو التراص التلقائي، تؤدي هذه الظاهرة إلى تراكم خلايا الدم الحمراء معًا بسبب ارتباط الأجسام المضادة بسطح الخلية.[182] وتُحسب تجمعات خلايا الدم الحمراء كخلية مفردة واحدة بواسطة المحلل الآلي، مما يؤدي إلى انخفاض ملحوظ في عدد خلايا الدم الحمراء والهيماتوكريت، وارتفاع ملحوظ في MCV و MCHC.[45] في كثير من الأحيان، تكون هذه الأجسام المضادة نشطة فقط في درجة حرارة الغرفة (وفي هذه الحالة تسمى الراصات الباردة)، وعند تسخين العينة إلى 37 درجة مئوية (99 درجة فهرنهايت) يمكن عكس الظاهرة وفك هذا التراص، قد تُظهر العينات المأخوذة من الأشخاص المصابين بفقر الدم الانحلالي المناعي الذاتي الدافئ، تراص لخلايا الدم الحمراء الذي لا يختفي عند ارتفاع درجة الحرارة.[119]
بينما يمكن التعرف على الأورام اللمفاوية والخلايا الأرومية في التفريق اليدوي، إلا أنه لا يمكن للفحص المجهري تحديد سلالات خلايا تكون الدم بشكل موثوق، وغالبًا ما تكون هذه المعلومات ضرورية لتشخيص سرطانات الدم. بعد التعرف على الخلايا غير الطبيعية، يمكن استخدام تقنيات إضافية مثل التنميط الظاهري المناعي بوساطة قياس التدفق الخلوي، لتحديد الواسمات، التي توفر معلومات إضافية عن الخلايا.[183][184]
تاريخ

قبل أن تظهر أجهزة تعداد الخلايا الآلية، أُجريت اختبارات تعداد الدَّم الكاملِ يدويًا، حيث حُسِبت خلايا الدم البيضاء والحمراء والصَّفائح الدموية باستخدام المَجاهر.[186] كان أنطوني فان ليفينهوك[187] هو أوّلُ شخصٍ ينشر تصوّراتٍ مجهرية لخلايا الدم، حيث أخبر برسالة عن ظهور الخلايا الحمراء في 1674 إلى وقائع الجمعية الملكية في لندن،[188] حيث أنّ يان زفامردام قد وَصَف خلايا الدم الحمراء قبل ذلك ببِضع سنوات، لكنَّه لم ينشر النّتائج التي تَوَصّل إِليها فِي ذلكَ الوَقت. خلال القرنين الثامن عشر والتاسع عشر، سمحت التَّحسينات في تقنية المجهر مثل العدسات الأكروماتية بإحصاء خلايا الدم البيضاء والصّفائح الدَّموية في عيناتٍ غير مصبوغة.[189]
يَرجِع الفَضل إلى عالِم الفسيولوجيا كارل فييروردت في إجراء أول تعداد دم.[3][190][191] اشتملت تقنيته والتي نُشرت عام 1852، على شَفط حَجم دم مُقاسٍ بعناية في أنبوب شُعيري ونشره على شريحة مجهرية مغطاة ببياض البيض، وبعد أن جفَّ الدَّم أَحصى كُلَّ خليةٍ على الشَّريحة، وهذه العَملية قد تستغرق أكثر من ثلاث ساعات حتى تكتمل.[192] وفي عام 1874 قدّم لويس تشارلز ملاسيز مقياس الكريات الدموي والذي سهّل العَد المجهري لخلايا الدم.[192] يتكون هذا المِقياس من شريحة مجهرية تحتوي على أنبوب شُعيري مسطح. يُدخَل الدم المخفف إلى غرفة الشّعيرات الدموية عن طريق أنبوب مطاطي مُتَّصِل بِأحد طرفيه، حيث رُبِط المجهر بِعدسةٍ ذات شبكة متدرِّجة مما يسمح للميكروسكوب بحساب عددِ الخلايا لكل حجم من الدم. وفي عام 1877، اخترع ويليام غاورز مقياس لعد خلايا الدّم (بالإنجليزية: Hemocytometer) مع شبكة عدّ مدمجة ممّا ألغى الحاجة إلى إِنتاج عدساتٍ معايرة خاصة لكل مجهر.[193]

فِي سبعينيات القَرن التّاسع عشر طوّر باول ارليش تقنية صباغة باستخدام مَزيجٍ من الصّبغة الحمضيّة والقاعديّة التي يمكن أَن تميز أنواعًا مختلفة من خلايا الدم البيضاء وتسمح بفحص مورفولوجيا (شكل) خلايا الدم الحمراء.[189] قام ديمتري ليونيدوفيتش رومانوسكي بتحسين هذه التقنية في تسعينيات القرن التاسع عشر بِاستخدام مزيج من الإيوسين والميثيلين الأزرق المُعتّق لإنتاج مجموعةٍ واسعةٍ من الصَّبغات غيرالموجودة عند استخدام أيّ من الصّبغات بمفردها وأصبح هذا أساس صبغة رومانوسكي، وهو الأسلوب الذي لا يزال يستخدم لصباغة مَسحات الدم للمراجعة اليدوية.[194]
ابتُكِرت التّقنيات الأولى لِقياس الهيموجلوبين في أواخر القرن التاسع عشر، وتَضمَّنت مقارنات بصرية للون الدم المُخَفّف مقابل معيار معروف،[191] كانت محاولات أتمتة هذه العملية باستخدام القياس الطّيفي وقياس الألوان مقيّدة بحقيقة أنَّ الهيموجلوبين موجود في الدم بأشكالٍ مختلفة عديدة مما يعني أنَّه لا يمكن قياسه بطول موجة واحد، وفي عام 1920، قُدِّمت طريقة لتحويل الأشكال المختلفة للهيموجلوبين إلى شكل ثابت واحد (سيانميتهيموغلوبين أو سيانيد الهيموغلوبين)، مما يسمح بقياس مستويات الهيموجلوبين تلقائيًا. تظلُّ طريقة السيانميتهيموغلوبين هي الطريقة المرجعية لقياس الهيموغلوبين ولا تزال مستخدمة في العديد من أجهزة تحليل الدم الآلية.[49][195][196]
يعود الفضل إلى ماكسويل وينتروب في اختراع اختبار الهيماتوكريت (نسبة حجمية للكريات الحمراء في الدم).[58][197] في عام 1929 أجرى مشروعاً للدكتوراه في جامعة تولين لتحديد النّطاقات الطّبيعية لقيم خلايا الدم الحمراء، واخترع طريقة تعرف باسم هيماتوكريت ونتروب (بالإنجليزية: Wintrobe Hematocrit)، حيث وُصِفَت قياسات الهيماتوكريت في الأبحاث السابقة، لكن طريقة وينتروب اختلفت من حيث أنها تستخدم أنبوبًا كبيرًا يمكن إنتاجُه بكميات كبيرة وفقًا لمواصفات دقيقة مع مقياسٍ مدمج، حيث قِيست نسبة خلايا الدم الحمراء في الأنبوب بعد الطّرد المركزي لتحديد نسبة الهيماتوكريت. كما أنَّ إختراعه لطريقة قابلة للتكرار لتحديد قيم الهيماتوكريت سمح لوينتروب بتعريف محددات خلايا الدم الحمراء.[191]

بدأ البحث في العد الآلي للخلايا في أوائل القرن العشرين.[196] في عام 1928 طُوِّرت طريقة استخدمت كمية الضّوء التي تنتقل عبر عينة دم مخففة، كما قِيست بواسطة القياس الضّوئي لتقدير عدد خلايا الدم الحمراء، ولكن ثبت أنّ هذا غير دقيقٍ للعينات ذات خلايا الدّم الحمراء غير الطبيعية،[3] أمّا المُحاولات الفاشلة الأخرى في الثلاثينيات والأربعينيات من القرن الماضي فقد شملت أجهزة كشف كهروضوئية مُتَّصلة بِالمجاهر والتي كانت تعد الخلايا أثناء فحصها. وفي أواخر الأربعينيات من القرن الماضي حاول والاس هـ. كولتر بدافع الحاجة إلى طرق أفضل لعد خلايا الدم الحمراء بعد قصف هيروشيما وناغازاكي[198] إلى تحسين تقنيات عدَِ الخلايا الكهروضوئية،ملاحظة 7 حيث ساعده شقيقه في بحثه والمعروف بجوزيف آر كولتر وكان ذلك في مختبر الطّابق السّفلي في شيكاغو،[52] حيث كانت نتائجهم باستخدام الطرق الكهروضوئية مخيِّبة للآمال، وفي عام 1948 بعد قراءة ورقةٍ تربط توصيل الدم بتركيز خلايا الدم الحمراء ابتكر والاس مبدأ كولتر - النّظريّة القائلة بأنَّ الخليَِة المعلَّقة في وسط مُوصل تولِّد انخفاضًا في التيّار المتناسب لحجمها عند مُرورِها عبر فتحة.[198]
وفي شهر أكتوبر لنفس العام، قام والاس ببناء عدّاد يوضّح مبدأ كولتر. ولكن نظرََا للقيود المالية، فَقد قام بإحداث فتحة عن طريق حرق ثقب في قطعة من السيلوفان من علبة سجائر.[52][198] وفي العام 1949 قدَّم والاس للحصول على براءة اختراع لهذه التقنية، وفي عام 1951 تقدَّم بطلبِِ إلى معمل أبحاث البحرية الأمريكية لتمويل تطوير عدّاد كولتر.[198] وحصل والاس على براءة الاختراع في عام 1953. وبعد إحداث تحسيناتِِ على التقنية وإدخال مقياس ضغط الزئبق لتوفير تحكّم دقيق في حجم العينة، أسّسَ الإخوة في عام 1958 شركة كولتر للإلكترونيات من أجل تسويق منتجاتهم. في البداية كان عداد كولتر مصمّمََا لعدِّ خلايا الدم الحمراء، ولكن مع إدخال التعديلات اللاحقة أثبت العدّاد كفاءته في حساب خلايا الدم البيضاء،[52] وبعدها انتشرت عدّادات كولترعلى نطاق واسع في المختبرات الطبية.[196]
كان تيكنيكون (Technicon SMA 4A−7A) والذي أُصدر في عام 1965، أول محلِّلِِ قادرِِ على تعداد أنواعِِ متعدّدة من الخلايا في نفس الوقت. حيث كان مبدأُ عمله يقوم على تقسيم عينات الدّم إلى قناتين؛ واحدةٌ لتعداد خلايا الدّم الحمراء والبيضاء، والثانية لقياس الهيموجلوبين. ومع ذلك، كان الجهاز غير موثوقِِ ويصعب الحفاظ عليه. في عام 1968، أُصدر محلل كولتر نموذج اس والذي انتشر على نطاق واسع. وعلى غرار تيكنيكون، فقد استخدم نموذج كولتر اس حُجرتي تفاعلِِ مختلفتين؛ واحدةً لتعداد خلايا الدم الحمراء، والثانيةَ لتعداد خلايا الدم البيضاء وقياس الهيموجلوبين. بالإضافة إلى أن نموذج اس كان قادرََا على إيجاد الحجم الكروي الوسطي للخلايا من خلال قياس المعاوقة، مما سمح بحساب واشتقاق مؤشرات خلايا الدم الحمراء والهيماتوكريت. وفي عام 1970 أُدخل التعداد الآلي للصفائح الدموية إالى جهاز تيكنيكون هيمالوغ-8، والذي اعتُمد في عام 1980 من قبل سلسلة كولتر اس بلس (بالإنجليزية: Coulter's S Plus) للمُحَلّلات.[199]
وبعد أن أُتمِتَ نظام تعداد الخلايا الأساسي، ظلَّ التفريق بين أنواع خلايا الدّم البيضاء يُمَثِّلُ تحَدّيََا، فخلال السبعينيات، أوجَدَ الباحثون طريقتين لأتمتة التعداد التفريقي لخلايا الدم البيضاء: معالجة الصور الرقمية وقياس التّدَفّق الخلوي. فباستخدام التكنولوجيا التي طُوِّرت في الخمسينيات والستينيات من القرن الماضي لأتمتة قراءة لطاخة بابانيكولاو، أُنتِجت عدة نماذج من أجهزة تحليل معالجة الصور.[200] حيث تقوم هذه الأجهزة بعمل مسحة لعَيّنة دم مصبوغة للعثور على نواة الخلية، ثم تأخذ لقطة بدقة أعلى للخلية لتحليلها من خلال قياس الكثافة.[201] لكن هذه النماذج كانت باهظة الثمن، بطيئةً، ولم تفعل شيئًا يذكر لتقليل عبء العمل في المختبرات، لأنّها كانت لا تزال بحاجة إلى أن تُحضَّر عينات الدم وتصبغ يدَوِيََّا، لذلك أصبحت الأنظمة القائمة على قياس التّدفق الخلوي أكثر شيوعًا،[202][203] وبحلول عام 1990، لم تكن هناك أي أدوات لمعالجة الصور الرقمية متوفرةََ تجارياً في الولايات المتحدة أو أوروبا الغربية.[204] لكن انتعَشَت هذه التّقنيات في الألفينيّات مع إدخال منصّات تحليل الصور الأكثر تقدمًا باستخدام الشبكات العصبونية الاصطناعية.[205][206][207]
عملت أجهزة قياس التّدفق الخلوي المبكرة على إطلاق حزمِِ ضوئية على الخلايا بأطوال موجية محددة وقياس الامتصاصية، الفلورية، أو انتشار الضوء الناتج. الأمر الذي يسمح بالحصول على معلومات عن خصائص الخلايا ومكوناتها مثل تحديد كميّة الحمض النووي الريبوزي منقوص الأكسجين (DNA) فيها.[208] وأَحَدُ هذه الأجهزة - مقياس الضوء الطَيفي السريع للخلايا، والذي طوره لويس كامينتسكي في عام 1965 لأتمتة سيتولوجيا عنق الرحم - والذي يستطيع رسم مخططات التشتت للضوء عن طريق تقنية الصباغة الكيميائية الخلوية. ساعد ليونارد أورنستين على تطوير نظام صباغة الخلايا عن طريق استخدام مقياس الضوء الطَيفي السريع. وفي وقت لاحق، ابتكر زملاؤه محللََا لقياس التّدفق الخلوي التفريقي لخلايا الدم البيضاء. وفي عام 1974،[209][210] أُضيف مُحلل هيمالوغ دي،[211][212] حيث يعمل هذا المُحلل على استخدام تشتت الضوء، الامتصاصية، أو صبغ الخلايا لتحديد الأنواع الخمس لخلايا الدم البيضاء بالإضافة إلى «الخلايا الكبيرة غير المحدّدة»، وهو تصنيف يطلِق على الخلايا اللمفاوية اللانمطية أو الخلايا الأرومية. ومن أهم ما يميّز الهيمالوغ دي عن طريقة التفريق اليدوي، أنه يستطيع عدَّ 10000 خلية في المرّة الواحدة.[212][213] وفي عام 1981 جُمِعَ بين هيمالوغ دي وهيمالوغ-8 للحصول على تيكنيكون H6000، وهو أول جهاز يجمع بين العد الدموي الشامل والتعداد التّفريقي للخلايا. لكن لم يلقَ هذا الجهاز رواجََا في مختبرات الدم لأنّه يتطلب جهدا كبيرََا من أخصّائيي المختبر. وفي أواخر الثمانينيات وأوائل التسعينيات، أُنتجت أنظمة مماثلة على نطاق واسع من قبل الشركات المصنعة الأخرى مثل Sysmex وAbbott وRoche وBeckman Coulter.[214]
ملاحظات توضيحية
- (ملاحظة 1) على الرغم من الإشارة إليها عمومًا على هذا النحو، فإن الصفائح الدموية من الناحية الفنية ليست خلايا: فهي عبارة عن أجزاء خلوية تتكون من سيتوبلازم الخلايا العملاقة في نخاع العظم.[7]
- (ملاحظة 2) عادة ما تُشتق البيانات المستخدمة لإنشاء المجالات المرجعية من العيّنات «العادية»، ولكن من الممكن أن يكون هؤلاء الأفراد مصابين بمرض بدون أعراض.[33]
- (ملاحظة 3) بمعناه الأوسع، يشير مصطلح قياس التدفق الخلوي إلى أي قياس لخصائص الخلايا الفردية في تيار السوائل،[45][119] وفي هذا الصدد، فإن جميع محللات أمراض الدم (باستثناء تلك التي تستخدم معالجة الصور الرقمية) هي مقاييس التدفق الخلوي. ومع ذلك، يستخدم المصطلح بشكل شائع للإشارة إلى طرق تشتت الضوء والفلورة، خاصة تلك التي تتضمن تحديد الخلايا باستخدام الأجسام المضادة المسمى التي ترتبط بعلامات سطح الخلية (التنميط المناعي).[45][183]
- (ملاحظة 4) هذا ليس هو الحال دائما. ففي بعض أنواع الثلاسيميا، على سبيل المثال، يحدث ارتفاع عدد خلايا الدم الحمراء جنبًا إلى جنب مع الهيموجلوبين المنخفض أو الطبيعي، حيث تكون خلايا الدم الحمراء صغيرة جدًا. يمكن استخدام مؤشر منتزر، الذي يقارن الحجم الكروي المتوسط MCV بعدد كريات الدم الحمراء، للتمييز بين فقر الدم الناجم عن نقص الحديد والثلاسيميا.
- (ملاحظة 5) تَجمع الأدوات الآلية هذه الأنواع الثلاثة من الخلايا معًا تحت تصنيف «الخلايا الحبيبية غير الناضجة»، ولكنها تُعدّ بشكل منفصل في الفحص التفريقي اليدوي.
- (ملاحظة 6) يكون RDW مرتفعًا عند الولادة وينخفض تدريجيًا حتى عمر ستة أشهر تقريبًا.
- (ملاحظة 7) تقول قصة ملفقة أن والاس اخترع عداد كولتر لدراسة الجسيمات في الدهانات المستخدمة على سفن البحرية الأمريكية. تزعم حسابات أخرى أنه صُمِّم في الأصل خلال الحرب العالمية الثانية لحساب العوالق. ومع ذلك، لم يعمل والاس أبدًا مع البحرية، وتذكر كتاباته المبكرة على الجهاز أنه استُخدم لأول مرة لتحليل الدم. وسُجبت قصة الطلاء في النهاية من الوثائق التي أنتجتها مؤسسة والاس إتش كولتر.
المراجع
استشهادات مرجعيّة
- ^ أ ب ت Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Advantages and sources of error with automated hematology".
- ^ Harmening, DM (2009). pp. 2–3.
- ^ أ ب ت Green، R؛ Wachsmann-Hogiu، S (2015). "Development, history, and future of automated cell counters". Clinics in Laboratory Medicine. ج. 35 ع. 1: 1–10. DOI:10.1016/j.cll.2014.11.003. ISSN:0272-2712. PMID:25676368.
- ^ أ ب Keohane, E et al. (2015). p. 244.
- ^ أ ب ت Leach، M (2014). "Interpretation of the full blood count in systemic disease – a guide for the physician". The Journal of the Royal College of Physicians of Edinburgh. ج. 44 ع. 1: 36–41. DOI:10.4997/JRCPE.2014.109. ISSN:1478-2715. PMID:24995446.
- ^ Marshall, WJ et al. (2014). p. 497.
- ^ أ ب ت ث Van Leeuwen, AM; Bladh, ML (2019). p. 377.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعLTO-C - ^ Lewandrowski, K et al. (2016). p. 96.
- ^ American Association of Blood Banks (24 أبريل 2014). "Five Things Physicians and Patients Should Question". اختر بحكمة: an initiative of the اختر بحكمة. American Association of Blood Banks. مؤرشف من الأصل في 2014-09-24. اطلع عليه بتاريخ 2020-07-12.
- ^ أ ب Lewandrowski, K et al. (2016). p. 97.
- ^ Hartman, CJ; Kavoussi, LR (2017). pp. 4–5.
- ^ Dewan، M (2016). "Reducing unnecessary postoperative complete blood count testing in the pediatric intensive care unit". The Permanente Journal. DOI:10.7812/TPP/16-051. ISSN:1552-5767. PMC:5283785. PMID:28241909.
- ^ Walls, R et al. (2017). p. 130.
- ^ Walls, R et al. (2017). p. 219.
- ^ Walls, R et al. (2017). p. 199.
- ^ Walls, R et al. (2017). p. 1464.
- ^ Moore, EE et al. (2017). p. 162.
- ^ Lewis, SL et al. (2015). p. 280.
- ^ Wiciński، M؛ Węclewicz، MM (2018). "Clozapine-induced agranulocytosis/granulocytopenia". Current Opinion in Hematology. ج. 25 ع. 1: 22–28. DOI:10.1097/MOH.0000000000000391. ISSN:1065-6251. PMID:28984748.
- ^ Fatemi, SH; Clayton, PJ. (2016). p. 666.
- ^ Dooley, EK; Ringler, RL. (2012). pp. 20–21.
- ^ Keohane, E et al. (2015). pp. 834–835.
- ^ Schafermeyer, RW et al. (2018). pp. 467–468.
- ^ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Introduction".
- ^ أ ب Kaushansky, K et al. (2015). p. 11.
- ^ Kaushansky, K et al. (2015). p. 43.
- ^ Kaushansky, K et al. (2015). pp. 42–44.
- ^ McPherson, RA; Pincus, MR (2017). p. 574.
- ^ أ ب Bain, BJ et al. (2017). p. 10.
- ^ Bain, BJ (2015). p. 213.
- ^ Keohane, E et al. (2015). p. 245.
- ^ أ ب ت Lewandrowski, K et al. (2016). pp. 96–97.
- ^ "Routine Preoperative Tests for Elective Surgery (NG45)". المعهد الوطني للصحة وجودة الرعاية. 5 أبريل 2016. مؤرشف من الأصل في 2020-07-28. اطلع عليه بتاريخ 2020-09-08.
- ^ Kirkham, KR et al. (2016). p. 805.
- ^ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Specimen collection".
- ^ Keohane, E et al. (2015). p. 28.
- ^ Bain, BJ et al. (2017). p. 1.
- ^ Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Cell counts", "Volume of packed red cells (hematocrit)", "Leukocyte differentials".
- ^ أ ب ت ث Bain, BJ et al. (2017). pp. 551–555.
- ^ Bain, BJ (2015). p. 29.
- ^ Dasgupta, A; Sepulveda, JL (2013). p. 305.
- ^ أ ب D’Souza، C؛ Briggs، C؛ Machin، SJ (2015). "Platelets: the few, the young and the active". Clinics in Laboratory Medicine. ج. 35 ع. 1: 123–131. DOI:10.1016/j.cll.2014.11.002. ISSN:0272-2712. PMID:25676376.
- ^ Kaushansky, K et al. (2015). p. 12.
- ^ أ ب ت ث Bain, BJ et al. (2017). pp. 32–33.
- ^ McPherson, RA; Pincus, MR (2017). p. 44.
- ^ Bain, BJ (2015). pp. 29–30.
- ^ Whitehead، RD؛ Mei، Z؛ Mapango، C؛ Jefferds، MED (أغسطس 2019). "Methods and analyzers for hemoglobin measurement in clinical laboratories and field settings". Annals of the New York Academy of Sciences. ج. 1450 ع. 1: 147–171. DOI:10.1111/nyas.14124. PMC:6709845. PMID:31162693.
- ^ أ ب Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Hemoglobin concentration".
- ^ أ ب Keohane, E et al. (2015). p. 208.
- ^ Bain, BJ (2015). pp. 30–31.
- ^ أ ب ت ث Graham، MD (2003). "The Coulter principle: foundation of an industry". Journal of the Association for Laboratory Automation. ج. 8 ع. 6: 72–81. DOI:10.1016/S1535-5535(03)00023-6. ISSN:1535-5535. مؤرشف من الأصل في 2021-06-18.
- ^ Keohane, E et al. (2015). pp. 208–209.
- ^ أ ب Bain, BJ et al. (2017). p. 32.
- ^ Keohane, E et al. (2015). pp. 210–211.
- ^ Keohane, E et al. (2015). p. 210.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 27.
- ^ أ ب ت ث ج Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Volume of packed red cells (hematocrit)".
- ^ Smock, KJ. Chapter 1 in Greer JP et al, ed. (2018), sec. "Mean corpuscular volume"; "Mean corpuscular hemoglobin"; "Mean corpuscular hemoglobin concentration"; "Red cell distribution width".
- ^ Keohane, E et al. (2015). p. 2.
- ^ Keohane, E et al. (2015). p. 209.
- ^ أ ب Bain, BJ et al. (2017). p. 37.
- ^ Arneth, BM; Menschikowki, M. (2015). p. 3.
- ^ أ ب Smock, KJ. Chapter 1 in Greer JP et al, ed. (2018), sec. "Leukocyte differentials".
- ^ Naeim, F et al. (2009). p. 210.
- ^ أ ب Turgeon, ML (2016). p. 318.
- ^ أ ب Bain, BJ et al. (2017). p. 39.
- ^ أ ب Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Introduction"; "Cell counts".
- ^ أ ب ت ث Gulati، G؛ Song، J؛ Dulau Florea، A؛ Gong، J (2013). "Purpose and criteria for blood smear scan, blood smear examination, and blood smear review". Annals of Laboratory Medicine. ج. 33 ع. 1: 1–7. DOI:10.3343/alm.2013.33.1.1. ISSN:2234-3806. PMC:3535191. PMID:23301216.
- ^ أ ب Mooney، C؛ Byrne، M؛ Kapuya، P؛ Pentony، L؛ De la Salle، B؛ Cambridge، T؛ Foley، D (2019). "Point of care testing in general haematology". British Journal of Haematology. ج. 187 ع. 3: 296–306. DOI:10.1111/bjh.16208. ISSN:0007-1048. PMID:31578729.
- ^ أ ب Sireci، AN (2015). "Hematology testing in urgent care and resource-poor settings: an overview of point of care and satellite testing". Clinics in Laboratory Medicine. ج. 35 ع. 1: 197–207. DOI:10.1016/j.cll.2014.10.009. ISSN:0272-2712. PMID:25676380.
- ^ Bain, BJ et al. (2017). p. 43.
- ^ Keohane, E et al. (2015). p. 225.
- ^ Bain, BJ. (2015). pp. 9–11.
- ^ Palmer, L et al. (2015). pp. 288–289.
- ^ Turgeon, ML (2016). pp. 325–326.
- ^ Bain, BJ (2015). p. 98.
- ^ Bain, BJ (2015). p. 154.
- ^ Wang, SA; Hasserjian, RP (2018). p. 10.
- ^ أ ب Turgeon, ML (2016). p. 329.
- ^ أ ب d'Onofrio, G; Zini, G. (2014). p. 289.
- ^ Palmer, L et al. (2015). pp. 296–297.
- ^ أ ب ت Keohane, E et al. (2015). p. 226.
- ^ أ ب Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Cell counts".
- ^ Keohane, E et al. (2017) p. 189.
- ^ Bain, BJ (2015). pp. 22–23.
- ^ Keohane, E et al. (2017). pp. 190–191.
- ^ Bain, BJ et al. (2017). pp. 19–22.
- ^ Bain, BJ et al. (2017). pp. 548–552.
- ^ Keohane, E et al. (2015). p. 46.
- ^ أ ب ت Vis، JY؛ Huisman، A (2016). "Verification and quality control of routine hematology analyzers". International Journal of Laboratory Hematology. ج. 38: 100–109. DOI:10.1111/ijlh.12503. ISSN:1751-5521. PMID:27161194.
- ^ أ ب Kottke-Marchant, K; Davis, B (2012). pp. 697–698.
- ^ Pai، S؛ Frater، JL (2019). "Quality management and accreditation in laboratory hematology: Perspectives from India". International Journal of Laboratory Hematology. ج. 41 ع. S1: 177–183. DOI:10.1111/ijlh.13017. ISSN:1751-5521. PMID:31069974.
- ^ Greer, JP (2008). p. 4.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 438.
- ^ Bain, BJ et al. (2017). pp. 539–540.
- ^ Favaloro، EJ؛ Jennings، I؛ Olson، J؛ Van Cott، EM؛ Bonar، R؛ Gosselin، R؛ Meijer، P (2018). "Towards harmonization of external quality assessment/proficiency testing in hemostasis". Clinical Chemistry and Laboratory Medicine (CCLM). ج. 0 ع. 0. DOI:10.1515/cclm-2018-0077. ISSN:1437-4331. PMID:29668440. مؤرشف من الأصل في 2021-06-18.
- ^ Bain, BJ et al. (2017). p. 551.
- ^ Keohane, E et al. (2015). pp. 4–5.
- ^ Blann, A; Ahmed, N (2014). p. 106.
- ^ Turgeon, ML (2016). p. 293.
- ^ Bain, BJ et al. (2017). pp. 33–34.
- ^ Turgeon, ML (2016). pp. 319–320.
- ^ Brereton، M؛ McCafferty، R؛ Marsden، K؛ Kawai، Y؛ Etzell، J؛ Ermens، A (2016). "Recommendation for standardization of haematology reporting units used in the extended blood count". International Journal of Laboratory Hematology. ج. 38 ع. 5: 472–482. DOI:10.1111/ijlh.12563. ISSN:1751-5521. PMID:27565952.
- ^ Keohane, E et al. (2015). p. 195.
- ^ أ ب Bain, BJ (2015). p. 22.
- ^ أ ب ت ث Keohane, E et al. (2015). p. 196.
- ^ Schmaier, AH; Lazarus, HM (2012). p. 25.
- ^ أ ب Bain, BJ (2015). pp. 73–75.
- ^ أ ب ت ث ج May، JE؛ Marques، MB؛ Reddy، VVB؛ Gangaraju، R (2019). "Three neglected numbers in the CBC: The RDW, MPV, and NRBC count". Cleveland Clinic Journal of Medicine. ج. 86 ع. 3: 167–172. DOI:10.3949/ccjm.86a.18072. ISSN:0891-1150. PMID:30849034.
- ^ Keohane, E et al. (2015). p. 285.
- ^ Keohane, E et al. (2015). p. 286.
- ^ Kaushansky, K et al. (2015). p. 503.
- ^ Vieth, JT; Lane, DR (2014). pp. 11-12.
- ^ Bain, BJ (2015). p. 232.
- ^ McPherson, RA; Pincus, MR (2017). pp. 600–601.
- ^ أ ب Smock, KJ. Chapter 1 in Greer, JP et al, ed. (2018), sec. "Mean corpuscular hemoglobin concentration".
- ^ Keohane, E et al. (2015). p. 197.
- ^ أ ب ت Kottke-Marchant, K; Davis, B (2012). p. 88.
- ^ Bain, BJ (2015). p. 193.
- ^ Bain, BJ et al. (2017). pp. 501–502.
- ^ Ciesla, B (2018). p. 26.
- ^ Powell, DJ; Achebe, MO. (2016). pp. 530, 537–539.
- ^ Harmening, DM (2009). p. 380.
- ^ Pagana, TJ et al. (2014). p. 992.
- ^ Walls, R et al. (2017). pp. 1480–1481.
- ^ Territo، M (يناير 2020). "Overview of White Blood Cell Disorders". Merck Manuals Consumer Version. مؤرشف من الأصل في 2020-06-23. اطلع عليه بتاريخ 2020-09-08.
- ^ Pagana, TJ et al. (2014). p. 991.
- ^ أ ب McCulloh, RJ; Opal, SM. Chapter 42 in Oropello, JM et al, ed. (2016), sec. "White blood cell count and differential".
- ^ American Association for Clinical Chemistry (29 يوليو 2020). "WBC Differential". Lab Tests Online. مؤرشف من الأصل في 2020-08-19. اطلع عليه بتاريخ 2020-09-08.
- ^ Chabot-Richards, DS; George, TI (2015). p. 10.
- ^ Palmer, L et al. (2015). p. 294.
- ^ Turgeon, ML (2016). p. 306.
- ^ أ ب Kaushansky, K et al. (2015). p. 44.
- ^ Hoffman, EJ et al. (2013). p. 644.
- ^ Porwit, A et al. (2011). pp. 247–252.
- ^ Walls, R et al. (2017). p. 1483.
- ^ Walls, R et al. (2017). pp. 1497–1498.
- ^ Bain, BJ (2015). p. 99.
- ^ Bain, BJ et al. (2017). p. 85.
- ^ Turgeon, ML (2016). p. 309.
- ^ Bain, BJ et al. (2017). p. 498.
- ^ Bain, BJ (2015). p. 243.
- ^ Porwit, A et al. (2011). p. 256.
- ^ Palmer, L et al. (2015). p. 298.
- ^ Turgeon, ML (2016). pp. 358–360.
- ^ Kaushansky, K et al. (2015). p. 1993.
- ^ Turgeon, ML (2016). p. 315.
- ^ Walls, R et al. (2017). pp. 1486–1488.
- ^ Kaufman، RM؛ Djulbegovic، B؛ Gernsheimer، T؛ Kleinman، S؛ Tinmouth، A T.؛ Capocelli، KE؛ وآخرون (2015). "Platelet transfusion: a clinical practice guideline from the AABB". Annals of Internal Medicine. ج. 162 ع. 3: 205. DOI:10.7326/M14-1589. ISSN:0003-4819. PMID:25383671.
- ^ أ ب Keohane, E et al. (2015). p. 4.
- ^ Walls, R et al. (2017). p. 1489.
- ^ Gersten، T (25 أغسطس 2020). "Platelet count: MedlinePlus Medical Encyclopedia". MedlinePlus. United States National Library of Medicine. مؤرشف من الأصل في 2020-09-09. اطلع عليه بتاريخ 2020-09-09.
- ^ Wang, SA; Hasserjian, RP (2018). p. 7.
- ^ Kaushansky, K et al. (2015). pp. 18–19.
- ^ أ ب Kaushansky, K et al. (2015). p. 14.
- ^ Turgeon, ML (2016). pp. 318–319.
- ^ Turgeon, ML (2016). p. 319.
- ^ أ ب ت ث Kaushansky, K et al. (2015). p. 16.
- ^ Bain, BJ et al. (2017). pp. 42–43.
- ^ Harmening, DM (2009). pp. 8–10.
- ^ Constantino، B؛ Cogionis، B (2000). "Nucleated RBCs – significance in the peripheral blood film". Laboratory Medicine. DOI:10.1309/D70F-HCC1-XX1T-4ETE.
- ^ Zandecki, M et al. (2007). pp. 24–25.
- ^ Virk، H؛ Varma، N؛ Naseem، S؛ Bihana، I؛ Sukhachev، D (2019). "Utility of cell population data (VCS parameters) as a rapid screening tool for acute myeloid leukemia (AML) in resource-constrained laboratories". Journal of Clinical Laboratory Analysis. ج. 33 ع. 2: e22679. DOI:10.1002/jcla.22679. ISSN:0887-8013. PMID:30267430.
- ^ Bain, BJ (2015). p. 90.
- ^ Keohane, E et al. (2015). Front matter.
- ^ Bain, BJ (2015). pp. 211–213.
- ^ أ ب ت Bain, BJ (2015). p. 143.
- ^ Lanzkowsky, P et al. (2016). p. 197.
- ^ Kaushansky, K et al. (2015). p. 99.
- ^ Kaushansky, K et al. (2015). p. 103.
- ^ Bain, BJ (2015). p. 220.
- ^ Bain, BJ (2015). p. 214.
- ^ Bain, BJ et al. (2017). pp. 8–10.
- ^ Palmer, L et al. (2015). p. 296.
- ^ Bain, BJ (2015). p. 195.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 67.
- ^ Bain, BJ (2015). p. 194.
- ^ Turgeon, ML (2016). p. 91.
- ^ Kottke-Marchant, K; Davis, B (2012) pp. 80, 86–87.
- ^ Bain, BJ (2015). pp. 196–197.
- ^ Rodak, BF; Carr, JH. (2013). p. 109.
- ^ أ ب Wang, SA; Hasserjian, RP (2018). p. 9.
- ^ Kottke-Marchant, K; Davis, B (2012). pp. 19–20.
- ^ Science Museum, London. "Haemoglobinometer, United Kingdom, 1850–1950". Wellcome Collection. مؤرشف من الأصل في 2020-03-29. اطلع عليه بتاريخ 2020-03-29.
- ^ Keohane, E et al. (2015). pp. 1–4.
- ^ Kottke-Marchant, K; Davis, B. (2012). p. 1.
- ^ Wintrobe, MM. (1985). p. 10.
- ^ أ ب Kottke-Marchant, K; Davis, B. (2012). pp. 3–4.
- ^ Verso، ML (مايو 1962). "The evolution of blood counting techniques". Read at a Meeting of the Section of the History of Medicine, First Australian Medical Congress. ج. 8 ع. 2: 149–158. DOI:10.1017/s0025727300029392. PMC:1033366. PMID:14139094.
- ^ أ ب ت Means، RT (2011). "It all started in New Orleans: Wintrobe, the hematocrit and the definition of normal". The American Journal of the Medical Sciences. ج. 341 ع. 1: 64–65. DOI:10.1097/MAJ.0b013e3181e2eb09. ISSN:0002-9629. PMID:21191263.
- ^ أ ب Kottke-Marchant, K; Davis, B (2012). p. 4.
- ^ Davis, JD (1995). pp. 168–171.
- ^ Bezrukov، AV (2017). "Romanowsky staining, the Romanowsky effect and thoughts on the question of scientific priority". Biotechnic & Histochemistry. ج. 92 ع. 1: 29–35. DOI:10.1080/10520295.2016.1250285. ISSN:1052-0295. PMID:28098484.
- ^ Keohane, E et al. (2015). p. 134.
- ^ أ ب ت Kottke-Marchant, K; Davis, B (2012). p. 5.
- ^ Robinson، JP (2013). "Wallace H. Coulter: decades of invention and discovery". Cytometry Part A. ج. 83A ع. 5: 424–438. DOI:10.1002/cyto.a.22296. ISSN:1552-4922. PMID:23596093.
- ^ أ ب ت ث Graham، MD (2013). "The Coulter principle: Imaginary origins". Cytometry Part A. ج. 83 ع. 12: 1057–1061. DOI:10.1002/cyto.a.22398. ISSN:1552-4922. PMC:4237176. PMID:24151220.
- ^ Kottke-Marchant, K; Davis, B (2012). p. 6.
- ^ Groner, W (1995). pp. 12–14.
- ^ Lewis، SM (1981). "Automated differential leucocyte counting: Present status and future trends". Blut. ج. 43 ع. 1: 1–6. DOI:10.1007/BF00319925. ISSN:0006-5242. PMID:7260399.
- ^ Da Costa, L (2015). p. 5.
- ^ Groner, W (1995). pp. 12–15.
- ^ Bentley، SA (1990). "Automated differential white cell counts: a critical appraisal". Baillière's Clinical Haematology. ج. 3 ع. 4: 851–869. DOI:10.1016/S0950-3536(05)80138-6. ISSN:0950-3536. PMID:2271793.
- ^ Kratz، A؛ Lee، S؛ Zini، G؛ Riedl، JA؛ Hur، M؛ Machin، S (2019). "Digital morphology analyzers in hematology: ICSH review and recommendations". International Journal of Laboratory Hematology. DOI:10.1111/ijlh.13042. ISSN:1751-5521. PMID:31046197.
- ^ Da Costa, L (2015). pp. 5–6.
- ^ McCann, SR (2016). p. 193.
- ^ Melamed, M (2001). pp. 5–6.
- ^ Picot, J et al. (2012). p. 110.
- ^ Mansberg، HP؛ Saunders، AM؛ Groner، W (1974). "The Hemalog D white cell differential system". Journal of Histochemistry & Cytochemistry. ج. 22 ع. 7: 711–724. DOI:10.1177/22.7.711. ISSN:0022-1554. PMID:4137312.
- ^ Shapiro, HM (2003). pp. 84–85.
- ^ أ ب Melamed, M. (2001). p. 8.
- ^ Pierre, RV (2002). p. 281.
- ^ Kottke-Marchant, K; Davis, B (2012). pp. 8–9.
قراءة موسعة
- Arneth، BM؛ Menschikowki، M (2015). "Technology and new fluorescence flow cytometry parameters in hematological analyzers". Journal of Clinical Laboratory Analysis. ج. 29 ع. 3: 175–183. DOI:10.1002/jcla.21747. ISSN:0887-8013. PMC:6807107. PMID:24797912.
- Bain، BJ (2015). Blood Cells: A Practical Guide (ط. 5). John Wiley & Sons. ISBN:978-1-118-81733-9. مؤرشف من الأصل في 2021-05-01.
- Bain، BJ؛ Bates، I؛ Laffan، MA (2017). Dacie and Lewis Practical Haematology (ط. 12). Elsevier Health Sciences. ISBN:978-0-7020-6925-3. مؤرشف من الأصل في 2021-05-01.
- Blann، A؛ Ahmed، N (2014). Blood Science (ط. 1). Institute of Biomedical Science. ص. 106. ISBN:978-1-118-35146-8.
- Chabot-Richards، DS؛ George، TI (2015). "White blood cell counts". Clinics in Laboratory Medicine. ج. 35 ع. 1: 11–24. DOI:10.1016/j.cll.2014.10.007. ISSN:0272-2712. PMID:25676369.
- Ciesla، B (2018). Hematology in Practice (ط. 3). F. A. Davis Company. ISBN:978-0-8036-6825-6. مؤرشف من الأصل في 2021-05-05.
- Da Costa، L (2015). "Digital image analysis of blood cells". Clinics in Laboratory Medicine. ج. 35 ع. 1: 105–122. DOI:10.1016/j.cll.2014.10.005. ISSN:0272-2712. PMID:25676375.
- Dasgupta، A؛ Sepulveda، JL (2013). Accurate Results in the Clinical Laboratory: A Guide to Error Detection and Correction. Elsevier. ISBN:978-0-12-415858-0. مؤرشف من الأصل في 2021-05-04.
- Davis، JD (1995). "The evolution of the progressive-era hemocytometer". Caduceus: A Humanities Journal for Medicine and the Health Sciences. ج. 11 ع. 3: 164–183. PMID:8680947. مؤرشف من الأصل في 2021-12-08.
- DiGregorio، RV؛ Green-Hernandez، C؛ Holzemer، SP (2014). Primary Care: An Interprofessional Perspective (ط. 2). Springer Publishing Company. ISBN:978-0-8261-7148-1. مؤرشف من الأصل في 2021-05-01.
- Dooley، EK؛ Ringler، RL (2012). "Prenatal care: touching the future". Primary Care: Clinics in Office Practice. ج. 39 ع. 1: 17–37. DOI:10.1016/j.pop.2011.11.002. ISSN:0095-4543. PMID:22309579.
- Fatemi، SH؛ Clayton، PJ (2016). The Medical Basis of Psychiatry (ط. 4). Springer. ISBN:978-1-4939-2528-5. مؤرشف من الأصل في 2021-05-01.
- Greer، JP (2008). Wintrobe's Clinical Hematology (ط. 12). Lippincott Williams & Wilkins. ISBN:978-0-7817-6507-7. مؤرشف من الأصل في 2021-05-02.
- Greer، JP؛ Arber، DA؛ Glader، BE؛ List، AF؛ Means، RM؛ Rodgers، GM (2018). Wintrobe's Clinical Hematology (ط. 14). Wolters Kluwer Health. ISBN:978-1-4963-6713-6. مؤرشف من الأصل في 2021-05-02.
- Groner، W (1995). Practical Guide to Modern Hematology Analyzers. Wiley. ISBN:978-0-471-95712-6. مؤرشف من الأصل في 2021-05-08.
- Harmening، D (2009). Clinical Hematology and Fundamentals of Hemostasis (ط. 5). F. A. Davis Company. ISBN:978-0-8036-1732-2. مؤرشف من الأصل في 2021-05-04.
- Hartman، CJ؛ Kavoussi، LR (2017). Handbook of Surgical Technique: A True Surgeon's Guide to Navigating the Operating Room. Elsevier Health Sciences. ISBN:978-0-323-51222-0. مؤرشف من الأصل في 2021-05-01.
- Hoffman، R؛ Benz, Jr.، EJ؛ Silberstein، LE؛ Heslop، H؛ Anastasi، J؛ Weitz، J (2013). Hematology: Basic Principles and Practice (ط. 6). Elsevier Health Sciences. ISBN:978-1-4377-2928-3. مؤرشف من الأصل في 2021-05-10.
- Isaacs، C؛ Agarwala، S؛ Cheson، B (2017). Hoffman and Abeloff's Hematology-Oncology Review (ط. 1). Elsevier Health Sciences. ISBN:978-0-323-44318-0. مؤرشف من الأصل في 2021-05-09.
- Kaushansky، K؛ Lichtman، MA؛ Prchal، J؛ Levi، MM؛ Press، OW؛ Burns، LJ؛ Caligiuri، M (2015). Williams Hematology (ط. 9). McGraw-Hill Education. ISBN:978-0-07-183301-1. مؤرشف من الأصل في 2021-05-05.
- Keohane، E؛ Smith، L؛ Walenga، J (2015). Rodak's Hematology: Clinical Principles and Applications (ط. 5). Elsevier Health Sciences. ISBN:978-0-323-23906-6. مؤرشف من الأصل في 2021-05-10.
- Kirkham، KR؛ Wijeysundera، DN؛ Pendrith، C؛ Ng، R؛ Tu، JV؛ Boozary، AS؛ وآخرون (2016). "Preoperative laboratory investigations". Anesthesiology. ج. 124 ع. 4: 804–814. DOI:10.1097/ALN.0000000000001013. ISSN:0003-3022. PMID:26825151. S2CID:35916964.
- Kottke-Marchant، K؛ Davis، B (2012). Laboratory Hematology Practice (ط. 1). John Wiley & Sons. ISBN:978-1-4443-9857-1. مؤرشف من الأصل في 2021-05-09.
- Lanzkowsky، P؛ Lipton، JM؛ Fish، JD (2016). Lanzkowsky's Manual of Pediatric Hematology and Oncology. Elsevier Science. ISBN:978-0-12-801674-9. مؤرشف من الأصل في 2021-05-08.
- Lewandrowski، K؛ Rudolf، J (2016). "Utilization Management in the Routine Hematology Laboratory". في Lewandrowski J, Sluss PM (المحرر). Utilization Management in the Clinical Laboratory and Other Ancillary Services. Springer. DOI:10.1007/978-3-319-34199-6_10. ISBN:978-3-319-34199-6.
- Lewis، SL؛ Dirksen، SR؛ Heitkempet، MM؛ Bucher، L؛ Camera، I (2015). Medical-Surgical Nursing: Assessment and Management of Clinical Problems, Single Volume (ط. 8). Elsevier Health Sciences. ISBN:978-0-323-29033-3. مؤرشف من الأصل في 2021-05-10.
- Marshall، WJ؛ Lapsley، M؛ Day، A؛ Ayling، R (2014). Clinical Biochemistry E-Book: Metabolic and Clinical Aspects (ط. 3). Elsevier Health Sciences. ISBN:978-0-7020-5478-5. مؤرشف من الأصل في 2021-05-09.
- McCann، SR (2016). A History of Haematology: From Herodotus to HIV. OUP Oxford. ISBN:978-0-19-102713-0. مؤرشف من الأصل في 2021-05-10.
- McPherson، RA؛ Pincus، MR (2017). Henry's Clinical Diagnosis and Management by Laboratory Methods (ط. 23). Elsevier Health Sciences. ISBN:978-0-323-41315-2. مؤرشف من الأصل في 2020-09-14.
- Melamed، M (2001). "Chapter 1 a brief history of flow cytometry and sorting". Methods in Cell Biology. Elsevier. ج. 63 part A. ص. 3–17. DOI:10.1016/S0091-679X(01)63005-X. ISBN:978-0-12-544166-7. PMID:11060834.
- Moore، EE؛ Feliciano، DV؛ Mattox، KL (2017). Trauma (ط. 8). McGraw-Hill Education. ISBN:978-1-260-12860-4. مؤرشف من الأصل في 2021-05-08.
- Naeim، F؛ Rao، PN؛ Grody، WW (2009). Hematopathology: Morphology, Immunophenotype, Cytogenetics, and Molecular Approaches (ط. 1). Academic Press. ISBN:978-0-08-091948-5. مؤرشف من الأصل في 2021-05-01.
- d'Onofrio، G؛ Zini، G (2014). Morphology of Blood Disorders (ط. 2). Wiley. ISBN:978-1-118-44258-6. مؤرشف من الأصل في 2021-05-01.
- Oropello، JM؛ Kvetan، V؛ Pastores، SM (2016). Lange Critical Care. McGraw-Hill Education. ISBN:978-0-07-181726-4. مؤرشف من الأصل في 2021-05-01.
- Pagana، KD؛ Pagana، TJ؛ Pagana، TN (2014). Mosby's Diagnostic and Laboratory Test Reference. Elsevier Health Sciences. ISBN:978-0-323-22592-2. مؤرشف من الأصل في 2021-05-05.
- Palmer، L؛ Briggs، C؛ McFadden، S؛ Zini، G؛ Burthem، J؛ Rozenberg، G؛ Proytcheva، M؛ Machin، SJ (2015). "ICSH recommendations for the standardization of nomenclature and grading of peripheral blood cell morphological features". International Journal of Laboratory Hematology. ج. 37 ع. 3: 287–303. DOI:10.1111/ijlh.12327. ISSN:1751-5521. PMID:25728865.
- Picot، J؛ Guerin، CL؛ Le Van Kim، C؛ Boulanger، C (2012). "Flow cytometry: retrospective, fundamentals and recent instrumentation". Cytotechnology. ج. 64 ع. 2: 109–130. DOI:10.1007/s10616-011-9415-0. ISSN:0920-9069. PMC:3279584. PMID:22271369.
- Porwit، A؛ McCullough، J؛ Erber، WN (2011). Blood and Bone Marrow Pathology (ط. 2). Elsevier Health Sciences. ISBN:978-0-7020-4535-6. مؤرشف من الأصل في 2021-05-05.
- Pierre، RV (2002). "Peripheral blood film review: the demise of the eyecount leukocyte differential". Clinics in Laboratory Medicine. ج. 22 ع. 1: 279–297. DOI:10.1016/S0272-2712(03)00075-1. ISSN:0272-2712. PMID:11933579.
- Powell، DJ؛ Achebe، MO (2016). "Anemia for the primary care physician". Primary Care: Clinics in Office Practice. ج. 43 ع. 4: 527–542. DOI:10.1016/j.pop.2016.07.006. ISSN:0095-4543. PMID:27866575.
- Rodak، BF؛ Carr، JH (2013). Clinical Hematology Atlas (ط. 4). Elsevier Health Sciences. ISBN:978-1-4557-0830-7. مؤرشف من الأصل في 2021-05-10.
- Schafermeyer، RW؛ Tenenbein، M؛ Macias، CJ (2018). Strange and Schafermeyer's Pediatric Emergency Medicine (ط. 5). McGraw-Hill Education. ISBN:978-1-259-86076-8. مؤرشف من الأصل في 2021-05-01.
- Shapiro، HM (2003). Practical Flow Cytometry (ط. 4). John Wiley & Sons. ISBN:978-0-471-43403-0. مؤرشف من الأصل في 2021-05-01.
- Schmaier، AH؛ Lazarus، HM (2012). Concise guide to hematology (ط. 1). Wiley-Blackwell. ISBN:978-1-4051-9666-6.
- Turgeon، ML (2016). Linné & Ringsrud's Clinical Laboratory Science: Concepts, Procedures, and Clinical Applications (ط. 7). Elsevier Mosby. ISBN:978-0-323-22545-8. مؤرشف من الأصل في 2020-09-22.
- Van Leeuwen، AM؛ Bladh، ML (2019). Davis's Comprehensive Manual of Laboratory and Diagnostic Tests with Nursing Implications (ط. 8). F. A. Davis Company. ISBN:978-0-8036-9448-4. مؤرشف من الأصل في 2021-05-01.
- Vieth، JT؛ Lane، DR (2014). "Anemia". Emergency Medicine Clinics of North America. ج. 32 ع. 3: 613–628. DOI:10.1016/j.emc.2014.04.007. ISSN:0733-8627. PMID:25060253.
- Walls، R؛ Hockberger، R؛ Gausche-Hill، M (2017). Rosen's Emergency Medicine - Concepts and Clinical Practice (ط. 9). Elsevier Health Sciences. ISBN:978-0-323-39016-3. مؤرشف من الأصل في 2021-05-09.
- Wang، SA؛ Hasserjian، RP (2018). Diagnosis of Blood and Bone Marrow Disorders. Springer. ISBN:978-3-319-20279-2. مؤرشف من الأصل في 2021-05-04.
- Wintrobe، MM (1985). Hematology, the Blossoming of a Science: A Story of Inspiration and Effort. Lea & Febiger. ISBN:978-0-8121-0961-0. مؤرشف من الأصل في 2021-05-05.
- Zandecki، M؛ Genevieve، F؛ Gerard، J؛ Godon، A (فبراير 2007). "Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes". International Journal of Laboratory Hematology. ج. 29 ع. 1: 21–41. DOI:10.1111/j.1365-2257.2006.00871.x. PMID:17224005.
| عد دموي شامل في المشاريع الشقيقة: | |


