|
تضامنًا مع حق الشعب الفلسطيني |
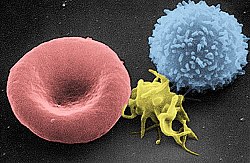
صفيحة دموية
| صفائح دموية | |
|---|---|
صورة من المجهر الضوئي (500 ×) لشريحة من الدم مصبوغة بصبغة جيمزا تُظهِر الصفائح الدموية (النقاط الزرقاء) وتحيط بها خلايا الدم الحمراء (الوردية الدائرية)
| |
| تفاصيل | |
| تعديل مصدري - تعديل |
الصفيحة الدموية[1][2] أو الصُفَيحة (بالإنجليزية: Platelet) أو (بالإنجليزية: Thrombocyte) أحد مكونات الدم الرئيسية.[3][4][5] وظيفتها تكوين الخثرات (الجلطات) لوقف النزف من الأوعية الدموية المصابة.[6] تنتج الصفائح من قبل خلايا نواء في نخاع العظم.[7]
لا تعتبر الصفيحات خلايا، بل هي أجزاء مفلطحة من السيتوبلازم، ويتألف معظم السيتوبلازم من بروتين قابض يسمى ثرومبوستينين. وتكون الصفائح الدموية غير النشطة محدبة الوجهين (على شكل عدسة)[8][9] بقطر 2-3 نانو متر تقريباً،[10] وهي ذات أشكال مختلفة، ولا تحتوي على نواة أو عضيات خلوية، ويتراوح عمرها الوسطي من سبعة إلى عشرة أيام. تلعب الصفائح الدموية دوراً هاماً في عملية التخثر بسبب قدرتها على الالتصاق والترابط فيما بينها نتيجة تنشيطها بواسطة إشارات التنشيط التخثري. وهي من المواد الأكثر تواجدا بالدم بعد الخلايا الحمراء حيث يتراوح عددها ما بين 150000 إلى 450000 ألف صفيحة في كل مم مكعب.
توجد الصفائح الدموية فقط في الثدييات، في حين أن صفيحات الحيوانات الأخرى (مثل الطيور والبرمائيات) توجد في الدم في شكل خلايا أحادية النوى سليمة.[11]
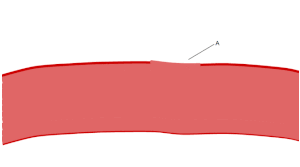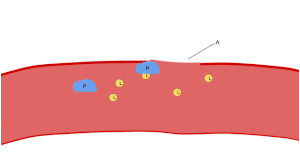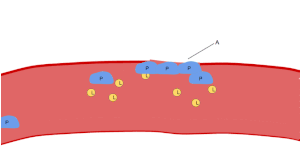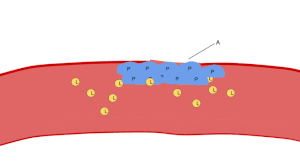
تظهر الصفائح الدموية على شريحة الدم المصبوغة كبقع أرجوانية داكنة، بقطر يساوي حوالي 20٪ من قطر خلايا الدم الحمراء. ويتم استخدام الشريحة لفحص الصفائح الدموية من حيث الحجم، والشكل، والعدد النوعي، والتكتل. وتتراوح نسبة الصفائح الدموية إلى خلايا الدم الحمراء في البالغين الأصحاء من 1:10 إلى 1:20.
وتتمثل المهمة الرئيسية للصفائح الدموية في المساهمة في الإرقاء (عملية وقف النزيف في مكان تقطع البطانة)، حيث تتجمع في الموقع، وإذا لم يكن القطع كبيرا جدا، فإنها تسد الثقب. أولا، تعلق الصفائح الدموية على المواد خارج قطع البطانة (الالتصاق). ثانيا، تتغير في الشكل، وتنشط المستقبلات وتفرز الرسل الكيميائية (التفعيل). ثالثا، تتصل مع بعضها البعض من خلال جسور المستقبلات (التجمع).[12] ويرتبط تشكيل هذه السدادة من الصفائح الدموية (الإرقاء الأولي) مع تفعيل سلسلة تجلط الدم مع ترسب الفيبرين الناتج (الإرقاء الثانوي). وقد تتداخل هذه العمليات، فتكون أغلب المكونات من الصفائح الدموية «جلطة بيضاء» أو الفيبرين «جلطة حمراء» أو خليط بينهما، والنتيجة النهائية هي الجلطة. يضيف البعض انكماش الجلطة اللاحق وتثبيط الصفائح الدموية كخطوتين رابعة وخامسة لاستكمال العملية،[13] والخطوة السادسة هي التئام الجرح.
ويسمى انخفاض تركيز الصفائح الدموية قلة الصفيحات، ويرجع ذلك إما إلى انخفاض الإنتاج أو زيادة التكسير. بينما يسمى ارتفاع تركيز الصفائح الدموية كثرة الصفيحات، وهي إما خِلقية، أو رد فعل للسيتوكينات، أو بسبب الإنتاج غير المنظم، مثل أورام التكثر المناعي أو بعض الأورام النخاعية الأخرى. ويسمى اضطراب وظيفة الصفائح الدموية اعتلال الصفيحات.
وقد تستجيب الصفائح الدموية العادية لشذوذ على جدار الوعاء الدموي بدلا من نزيف، مما يؤدى إلى الالتصاق والتنشيط غير المناسب للصفائح الدموية وتجلط الدم، فتتشكل جلطة داخل وعاء سليم. وينشأ هذا النوع من التخثر من آليات مختلفة عن تلك التي تكوّن الجلطة العادية. وقد تؤدي الجلطة الشريانية إلى عرقلة تدفق الدم جزئيا، مما يسبب نقص التروية، أو قد يعوقه تماما مسببا موت الأنسجة التي يغذيها.
تاريخ
- رسم جورج جاليفر في عام 1841 صورا للصفائح الدموية[14] باستخدام المجهر مزدوج العدسات (المركب)، الذي تم اختراعه في عام 1830 من قِبَل جوزيف جاكسون ليستر.[15] وقد حسّن هذا المجهر الجودة بما فيه الكفاية لجعل من الممكن رؤية الصفائح الدموية للمرة الأولى.
- رسم ويليام أديسون في عام 1842 صورا لجلطة مكونة من الفيبرين والصفائح الدموية.[16]
- كان ليونيل بيل أول من نشر رسم يبين الصفائح الدموية في عام 1864.[17]
- وصف ماكس شولتز في عام 1865 ما سمّاه ب «الكريات»، التي لاحظ أنها أصغر بكثير من خلايا الدم الحمراء، وتتجمع أحيانا، كما وُجِدَت في تجمعات من مادة الفيبرين.[18]
- درس جوليو بيززوزيرو في عام 1882 دم البرمائيات بالمجهر في الجسم الحي. وسمي كريات شولتز «صفيحات صغيرة».[3][19]
- وقد لاحظهم ويليام أوسلر، وأطلق عليهم الكريات الدموية الثالثة، وصفيحات الدم في محاضرات نشرت في عام 1886، ووصفها بأنها قرص بروتوبلازمي عديم اللون.[20]
- فحص جيمس رايت مسحات الدم باستخدام الصبغة المسماة باسمه (صبغة جيمزا)، واستخدم مصطلح صفائح (plates) في منشور عام 1906،[21] ولكن بدله إلى الصفائح الدموية (platelets) في منشوره عام 1910،[22] والذي أصبح المصطلح المقبول عالميا.
دخل مصطلح خلية الخثار (thrombocyte) أو خلية الجلطة حيز الاستخدام في أوائل التسعينات، ويُستخدم في بعض الأحيان كمرادف للصفائح الدموية، ولكن لا يستخدم بشكل عام في المؤلفات العلمية إلا عند وصفها كأصل للكلمة لمصطلحات أخرى تتعلق بالصفائح الدموية (على سبيل المثال، قلة الصفيحات (thrombocytopenia) الذي يعني انخفاض عدد الصفائح الدموية).[11] الخلايا الخثارية هي خلايا موجودة في دم الفقاريات غير الثدييات، ولهم وظيفة تعادل وظيفة الصفائح الدموية، ولكنها تكون خلايا سليمة وحيدة النوى، وليست مجرد فتات سيتوبلازمي من الخلية النواء من النخاع العظمي.[11]
يتم استخدام كلمة خثرة بالتبادل مع كلمة تجلط أو تخثر في بعض السياقات، بغض النظر عن تكوينها (أبيض أو أحمر أو مختلط). وفي سياقات أخرى، يتم استخدامها لمقارنة الجلطة الطبيعية من الجلطة غير الطبيعية، حيث أن الخثرة تنشأ من الإرقاء الفسيولوجي، بينما ينشأ التخثر من كمية مرضية وفائضة من الجلطات.[23] ويتم استخدامها في سياق ثالث لمقارنة النتيجة من العملية: فالخثرة (thrombus) هي النتيجة، والتخثر (thrombosis) هو العملية.
القياس
يتم قياس تركيز الصفائح الدموية إما يدويا باستخدام عداد خلايا الدم، أو عن طريق وضع الدم في محلل صفائح آلي باستخدام مقاومة كهربائية، مثل عداد كولتر.[24] المعدل الطبيعي للصفائح الدموية (بتحليل دم 99٪ من السكان) في القوقازيين الأصحاء هو من 150,000 إلى 450,000 لكل مليمتر مكعب[25] (مم مكعب يساوي ميكروليتر)، أو 150-400 × 109 للتر الواحد. وقد ثبت أن ذلك المعدل الطبيعي هو نفسه الموجود في كبار السن[26] والشعوب الإسبانية.[27]
التركيب
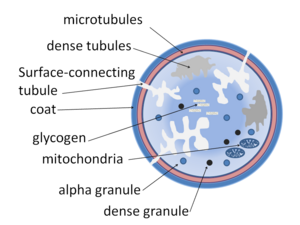
يمكن تقسيم الصفائح الدموية هيكليا إلى أربع مناطق، من الطرف إلى العمق:
- المنطقة الطرفية: غنية بالبروتينات السكرية المطلوبة لاتصاق الصفائح الدموية، والتفعيل، والتجميع، مثل: البروتين السكري Ib/IX/X، و VI، وIIb/IIIa.
- منطقة سول-جيل: غنية بالأنابيب الدقيقة والخيوط الدقيقة، مما يسمح للصفائح الدموية بالحفاظ على شكلها القرصي.
- منطقة العضيات: غنية بحبيبات الصفائح الدموية، وتحتوي حبيبات ألفا على وسطاء التخثر، مثل العامل الخامس، والعامل الثامن، والفيبرينوجين، والفيبرونكتين، وعامل النمو المستمد من الصفائح الدموية، والعوامل الكيميائية الجاذبة، كما تحتوي حبيبات دلتا، أو الأجسام الكثيفة على أدينوسين ثنائي الفوسفات، وكالسيوم، وسيروتونين، وهم وسطاء تفعيل الصفائح الدموية.
- المنطقة الغشائية: تحتوي على الأغشية المستمدة من الشبكة الإندوبلازمية الملساء للخلية النواء مرتبة في نظام أنبوبي كثيف مسؤول عن تخليق الثروموبوكسان A2. ويرتبط هذا النظام الأنبوبي الكثيف بغشاء الصفائح الدموية السطحية للمساعدة في إطلاق ثرومبوكسان A2.
اضطرابات الصفائح الدموية
يمكن أن يحدث نزيف عفوي ومفرط؛ بسبب اضطرابات الصفائح الدموية، فقد يكون سبب هذا النزيف نقص عدد الصفائح الدموية، أو الصفائح الغير وظيفية، أو وجود أعداد مفرطة جدا من الصفائح الدموية (أكثر من 1.0 مليون/ ميكروليتر). (تخلق الأعداد المفرطة من الصفائح الدموية نقص عامل فون ويلبراند النسبي بسبب العزل).[28][29]
ويمكن للمرء أن يحصل على فكرة عما إذا كان النزيف يرجع إلى اضطراب الصفائح الدموية أو اضطراب عامل التخثر من خلال خصائص وموقع النزيف.[30] ويشير كل ما يلي إلى نزيف بسبب الصفائح الدموية، وليس التخثر:
- النزيف من قطع في الجلد مثل شق موس الحلاقة، ولكن يمكن السيطرة عليه بالضغط.
- النزيف العفوي في الجلد، الذي يسبب بقع أرجوانية تسمى حسب حجمها، مثل: الحبرة، والفرفرية، والكدمات.
- النزيف في الأغشية المخاطية، مما يسبب نزيف اللثة، ونزيف الأنف، والنزيف المعوي، وغزارة الطمث. والنزيف داخل الشبكية أو داخل الجمجمة.
وقد تؤدي الأعداد المفرطة من الصفائح الدموية و/ أو الصفائح الدموية الطبيعية التي تستجيب لشذوذ جدران الأوعية الدموية إلى الخثار الوريدي والخثار الشرياني، وتعتمد الأعراض على مكان تخثر الدم.
علم الحركة

- يُنظَم إنتاج خلايا النواءات والصفائح الدموية بواسطة الثرومبوبويتين، وهو هرمون ينتج في الكلى والكبد.
- تنتج كل خلية نواء ما بين 1000-3000 صفيحة خلال حياتها.
- يتم إنتاج 1011 صفيحة يوميا في الشخص البالغ الصحيح.
- يتم تخزين الصفائح الاحتياطية في الطحال، ويتم الإفراج عنهم عند الحاجة من خلال تقلص الطحال الناجم عن الجهاز العصبي الودي.

- متوسط عمر الصفائح الدموية هو 8 إلى 9 أيام.[31] ويتم التحكم في فترة حياة الصفائح الدموية الفردية من قِبَل مسار تنظيم موت الخلايا المبرمج الداخلي.[32]
- يتم تدمير الصفائح الدموية القديمة عن طريق البلعمة في الطحال والكبد.
علم الديناميكا

يشارك ما لا يقل عن 193 بروتين و301 تفاعل في ديناميكية الصفائح الدموية. وتفصيل ديناميكية الصفائح الدموية إلى ثلاث مراحل مفيد في هذا الصدد، لكنه اصطناعي، ففي الواقع، يتم البدء في كل مرحلة في تتابع سريع، ويستمر كل منها حتى تتوقف الإثارة لتلك المرحلة، ومن ثَم فإن هناك تداخل بينهم.[12]
الالتصاق
يتم منع تشكيل خثرة على بطانة سليمة بواسطة أكسيد النيتريك،[33] وبروستاسيكلين،[34] وكتلة التمايز39.[35]
وتعلق الخلايا البطانية إلى الكولاجين الموجود تحت البطانة بواسطة عامل فون ويل براند، الذي تنتجه هذه الخلايا. ويتم تخزين فون ويل براند أيضا في أجسام ويبل - بالاد في الخلايا البطانية، وتُفرَز في الدم. وتقوم الصفائح الدموية بتخزين عامل فون ويل براند في حبيبات ألفا.
وعندما تتمزق الطبقة البطانية، يقوم الكولاجين وعامل فون ويل براند بتثبيت الصفائح الدموية إلى تحت البطانة، فترتبط مستقبلات البروتين السكري 1ب-9-5 للصفائح الدموية مع عامل فون ويل براند، كما يرتبط مستقبل البروتين السكري السادس وإنتغرين ألفا2 بيتا1 مع الكولاجين.[36]
التفعيل
التثبيط
تمنع البطانة الداخلية السليمة تفعيل الصفائح الدموية عن طريق إنتاج أكسيد النيتريك، وإنزيم أدينوزين ثنائي الفوسفاتاز البطاني، وبروستاغلاندين I2 (بروستاسيكلين)، حيث يكسر إنزيم أدينوزين ثنائي الفوسفاتاز البطاني أدينوزين ثنائي الفوسفات المنشط للصفائح الدموية.
تحافظ الصفائح الدموية المستقرة على تدفق الكالسيوم النشط عن طريق مضخة الكالسيوم المنشطة بأحادي فوسفات الأدينوسين الحلقي. ويحدد تركيز الكالسيوم داخل الخلايا حالة تفعيل الصفائح الدموية؛ لأنه الرسول الثاني الذي يقود إلى تغيرات الصفائح الدموية التوافقية. ويرتبط بروستاسيكلين البطاني إلى مستقبلات البروستانويد على سطح الصفائح الدموية المستقرة. ويحفز هذا الحدث البروتين المقترن Gsα لزيادة نشاط إنزيم محلقة الأدينيلات، وزيادة إنتاج أحادي فوسفات الأدينوسين الحلقي، وزيادة تعزيز تدفق الكالسيوم والحد من توافر الكالسيوم داخل الخلايا لتنشيط الصفائح الدموية.
ويرتبط أينوزين ثنئي الفوسفات من ناحية أخرى مع المستقبلات البورينرجية على سطح الصفائح الدموية. وبسبب اقتران المستقبلات البورينرجية P2Y12 مع بروتينات Gi، يقوم أدينوزين ثنائي الفوسفات بتقليل نشاط إنزيم محلقة الأدينيلات من الصفائح الدموية وإنتاج أحادي فوسفات الأدينوسين الحلقي، مما يؤدي إلى تراكم الكالسيوم داخل الصفائح الدموية عن طريق تعطيل مضخة تدفق الكالسيوم المنشطة بأحادي فوسفات الأدينوسين الحلقي. كما تقترن مستقبلات P2Y1 الأخرى مع Gq الذي ينشط إنزيم فوسفوليباز C- بيتا 2 PLCB2 منتجا إينوسيتول 1,4,5-ثلاثي السفوسفات (IP3) وإطلاق المزيد من الكالسيوم داخل الخلايا، مما يؤدي في النهاية إلى تفعيل الصفائح الدموية. ويكسر إنزيم أدينوزين ثنائي الفوسفات البطاني أدينوزين ثنائي الفوسفات ويمنع ذلك من الحدوث. ويعمل كلوبيدوغريل والأدوية المضادة للصفيحات ذات الصلة أيضا كمضادات مستقبلات P2Y12 البورينرجية.
الإثارة
يبدأ تنشيط الصفائح الدموية بعد ثوان من حدوث الالتصاق. وتتم الإثارة عندما يرتبط الكولاجين من تحت البطانة مع مستقبلاته على الصفائح الدموية. ويرتبط البروتين السكري السادس مع سلسلة مستقبلات جاما Fc، ومما يؤدي في النهاية إلى تفعيل PLC-gamma2 PLCG2 والإفراج عن المزيد من الكالسيوم عن طريق تفعيل سلسلة التيروزين كيناز.
يرتبط العامل النسيجي أيضا بالعامل السابع في الدم، فيبدأ شلال التخثر الخارجي بزيادة إنتاج الثرومبين. والثرومبين هو منشط للصفائح الدموية يعمل من خلال البروتين Gq وG12، وهي مستقبلات مقترنة بالبروتين ج تفتح مسارات الكالسيوم بوساطة توصيل إشارات داخل الصفائح الدموية، وتتغلب على تدفق الكالسيوم الأساسي. وتعمل عائلات بروتينات ج الثلاثة (Gq، Gi، G12) معا من أجل التفعيل الكامل. كما يعزز الثرومبين تقوية الفيبرين الثانوية لغطاء الصفائح الدموية. فيحفز تنشيط الصفائح الدموية الذي بدوره يطلق العامل الخامس والفيبرينوجين، مما يعزز سلسلة تجلط الدم؛ لذا فإن عملية تكتل الصفائح الدموية والتخثر تحدث في الواقع في وقت واحد وليس بالتتابع، حيث تحرض كل منها الأخرى لتشكيل الجلطة النهائية.
المكونات (العواقب)
تنشيط البروتين السكري 2ب/3أ
تُزيد إشارة البروتين السكري 6 المعدَل بالكولاجين من إنتاج الصفائح الدموية للثرموبوكسان A2، وتقلل من إنتاج بروستاسيكلين. ويحدث ذلك عن طريق تغيير تدفق أيض مسار تصنيع إيكوزانويد للصفيحات، والذي ينطوي على إنزيم فوسفوليباز A2، وسيكلو الأكسجيناز 1، والثرومبوكسان-A سينثاز. تفرز الصفائح الدموية ثرومبوكسان A2، الذي يعمل على مستقبلات الثرومبوكسان الخاصة به على سطحها، وعلى سطح الصفائح الدموية الأخرى. وتنتج هذه المستقبلات إشارات بين الصفائح، مما يحول مستقبلات البروتين السكري 2ب/3أ إلى شكلها النشط لبدء التجمع.[12]
إفراز الحبيبات
تحتوي الصفائح الدموية على حبيبات كثيفة، وحبيبات لامدا، وحبيبات ألفا. وتفرز الصفائح الدموية المنشطَة محتويات هذه الحبيبات من خلال نظمها القنية إلى الخارج. وببساطة، تتحبب الصفائح الدموية المنشطة لإفراز مواد جذب كيميائية؛ لجذب المزيد من الصفائح الدموية إلى موقع إصابة البطانة. ومن خصائص الحبيبات:
- حبيبات ألفا: تحتوي على بي-سيلكتين، وعامل الصفيحات 4، وعامل النمو المحول بيتا 1، وعامل النمو المستخلص من الصفائح الدموية، والفبرونيكتين، وبي-ثرومبوغلوبين، وعامل فون ويل براند، والفيبرينوجين، وعوامل التخثر الخامس والثالث عشر.
- حبيبات δ (دلتا أو الحبيبات الكثيفة): تحتوي على أدينوزين ثنائي الفوسفات أو أدينوزين ثلاثي الفوسفات، والكالسيوم، والسيروتونين.
- حبيبات γ (حبيبات جاما): مماثلة للليسوسومات، وتحتوي على عدة إنزيمات مائية.
- حبيبات λ (حبيبات لامدا): تشارك المحتويات في ارتشاف الجلطة خلال المراحل اللاحقة من إصلاح الوعاء.
التغير الشكلي
فرط استقطاب الميتوكوندريا هو حدث رئيسي في بدء التغييرات في الشكل،[37] فيزيد تركيز الكالسيوم داخل الصفائح، ويحفز التداخل بين مركب الأنيببات الدقيقة وخيوط الأكتين. ومن الأفضل رؤية التغييرات المستمرة في الشكل من الصفائح الدموية غير النشطة إلى الصفائح الدموية النشطة عن طريق المسح بالمجهر الإلكتروني. وتسمى الخطوات الثلاثة على طول هذا المسار: التشجر المبكر، والانتشار المبكر، والانتشار. ويبدو سطح الصفائح الدموية غير النشطة مشابه جدا لسطح الدماغ مع ظهور التجاعيد من العديد من الطيات الضحلة لزيادة مساحة السطح، فيبدو السطح في وقت التشجر المبكر كالأخطبوط بأذرع وسيقان متعددة، وفي الانتشار المبكر كالبيض غير المطبوخ في المقلاة، حيث يكون «الصفار» هو الجسم المركزي، بينما في الانتشار، يكون السطح مشابه للبيض المقلي المطبوخ مع جسم مركزي أكثر كثافة. تحدث هذه التغيرات كلها عن طريق التفاعل بين مركب الأنيبيبات الدقيقة والأكتين مع غشاء الصفائح الدموية ونظام القنية المفتوحة (OCS). يعمل هذا المركب فقط تحت تلك الأغشية، وهو المحرك الكيميائي الذي يسحب OCS المنطوية من داخل الصفائح الدموية للخارج مثل تحول جيوب السراويل من الداخل إلى الخارج، مما يخلق التشعبات، ثم يمتد كل تشعب حتى لا يمكن تمييز OCS بالكامل من غشاء الصفائح الدموية الأولية في شكل «البيض المقلي». وتأتي هذه الزيادة الكبيرة في مساحة السطح دون تمدد أو إضافة الفوسفوليبيدات إلى غشاء الصفائح الدموية.[38]
تسهيل التخثر
يؤدي تنشيط الصفائح الدموية إلى أن يصبح سطح الغشاء مشحونا سلبا. وتفتح أحد مسارات الإشارات بروتين السكرامبلز، الذي يحرك الدهون الفوسفورية السالبة من السطح الداخلي إلى السطح الخارجي لغشاء الصفائح الدموية. ثم ترتبط تلك الدهون الفوسفورية بمركبات التيناز والبروثرومبيناز، وهما من مواقع التفاعل بين الصفائح الدموية وشلال التجلط. كما أن أيونات الكالسيوم ضرورية لربط عوامل التخثر.
التجمع
يبدأ تجمع الصفائح بعد دقائق من التنشيط، ويحدث نتيجة لتشغيل مستقبلات البروتين السكري 2ب/3أ، مما يسمح لهذه المستقبلات بالارتباط مع عامل فون ويل براند أو الفيبرينوجين.[12] وهناك حوالي 60,000 من هذه المستقبلات على كل صفيحة دموية،[39] وعندما يتم تشغيل واحد أو أكثر من تسعة مستقبلات مختلفة على الأقل على سطح الصفائح الدموية أثناء التنشيط، فإن مسارات الإشارات بين الصفائح تسبب تغير شكل مستقبلات البروتين السكري 2ب/3أ - من الالتواء إلى الاستقامة - وبالتالي تصبح قادرة على الارتباط.[12]
تستطيع الصفائح النشطة المقترنة بالبروتين السكري 2ب/ 3أ الظاهر الارتباط مع الفيبرينوجين للتجمع؛ حيث أن الفيبرينوجين هو بروتين يشبه العود مع وجود عقيدات على طرفيه قادرة على الارتباط مع البروتين السكري 2ب/3أ. كما يمكن أن يقوم البروتين السكري 2ب/ 3أ بتثبيت الصفائح الدموية إلى عامل فون ويل براند تحت البطاني من أجل مزيد من التثبيت لهيكل الجلطة.
وقد كان يُعتقد أن هذه هي الآلية الوحيدة التي تشارك في التجميع، ولكن تم تحديد ثلاث آليات جديدة يمكن أن تبدأ التجميع اعتمادا على سرعة تدفق الدم.[40]
التئام الجروح
تجلط الدم هو مجرد حل مؤقت لوقف النزيف، ويكون هناك حاجة إلى إصلاح الأنسجة. يتم التعامل مع القطع الصغير في البطانة بواسطة الآليات الفسيولوجية، بينما يتم التعامل مع القطع الكبير بواسطة الجراحة.[41] ويتم حل الفيبرين ببطء بواسطة الإنزيم الحال للفيبرين والبلازمين، ويتم التخلص من الصفائح الدموية عن طريق البلعمة.[4]
تفاعلات عامل تجلط الدم والصفائح الدموية
بالإضافة إلى التفاعل مع عامل فون ويل براند والفيبرين، تتفاعل الصفائح الدموية مع الثرومبين، والعامل العاشر، والخامس أ، والسابع أ، والحادي عشر، والتاسع، والبروثرومبين لاستكمال تكوين جلطة عن طريق سلسلة تجلط الدم.[42][43] وأشارت ست دراسات إلى أن الصفائح الدموية تعبر عن العامل النسيجي، بينما تظهر الدراسة النهائية أن ذلك لا يحدث.[42] ووُجِد أن الصفائح الدموية في الفئران تعبر عن بروتين العامل النسيجي، كما ثبت أنها تحمل كل من العامل النسيجي ما قبل الحمض النووي الريبوزي الرسول والحمض النووي الريبوزي الرسول الناضج.[44]
دور الصفائح الدموية في الأمراض غير الدموية
الالتهاب
بالإضافة إلى كونها المستجيب الخلوي للارقاء، يتم نشر الصفائح الدموية بسرعة إلى مواقع الإصابة أو العدوى، حيث يمكن أن تعدل العمليات الالتهابية من خلال التفاعل مع كرات الدم البيضاء، وإفراز السيتوكينات، والكيموكينات، ووسطاء الالتهابات الأخرى،[45][46][47][48] كما تفرز الصفائح الدموية عامل النمو المشتق من الصفيحات.
تكوين الجلطات في الفقاريات غير الثديية
تمتلك الفقاريات غير الثديية صفيحات لها نواة وتشبه الخلايا الليمفاوية البائية في الشكل بدلا من وجود الصفائح الدموية. وتتجمع استجابةً للثرومبين، وليس لأدينوزين ثنائي الفوسفات، ولا السيروتونين، ولا الأدرينالين كما يحدث مع الصفائح الدموية.[49][50]
اختبارات وظيفة الصفائح الدموية
زمن النزيف
هو اختبار وُضِع من قِبَل ديوك في عام 1910 وحمل اسمه، حيث يقيس الزمن الذي يستغرقه النزيف ليتوقف من جرح موحد في فص الأذن مع تجفيفه كل 30 ثانية، واستغرق الزمن الطبيعي أقل من 3 دقائق،[51] وتستخدم الآن تقنيات أكثر حداثة. ويعكس زمن النزيف الطبيعي طبيعة أعداد ووظيفة الصفائح الدموية بالإضافة إلى كفاءة الأوعية المجهرية.
مقياس التكدس متعدد الأقطاب
في محلل التعداد، يتم خلط الدم كاملا مضاف إليه مضاد للتخثر مع محلول ملحي وناهض للصفائح الدموية في كوفيت (حوض ترسيب) يستخدم لمرة واحدة وله زوجان من الأقطاب الكهربائية. وتقاس الزيادة في المقاومة بين الأقطاب عندما تتجمع الصفائح الدموية عليها، وتظهر كمنحنى.
فحص وظيفة الصفيحة الدموية-100
فحص وظيفة الصفيحة الدموية-100 (PFA-100) هو نظام لتحليل وظيفة الصفائح الدموية، حيث يتم سحب الدم المضاف إليه سترات من خلال لفيفة تستعمل مرة واحدة وتحتوي على فتحة خلال غشاء مغلف إما بالكولاجين والأدرينالين أو الكولاجين وأدينوزين ثنائي الفوسفات. وتحفز هذه الناهضات التصاق الصفائح الدموية وتفعيلها وتجميعها، مما يؤدي إلى انسداد الفتحة سريعا، ووقف تدفق الدم فيما يسمى «زمن الإغلاق». وقد يشير ارتفاع زمن الإغلاق مع الأدرينالين والكولاجين إلى عيوب جوهرية مثل مرض فون ويلبراند، أو يوريمية، أو تعميم مثبطات الصفائح الدموية. ويتم استخدام اختبار المتابعة التي ينطوي على الكولاجين وأدينوزين ثناثي الفوسفات للإشارة إلى ما إذا كان زمن الإغلاق غير الطبيعي مع الكولاجين والأدرينالين سببه آثار أسيتيل حمض السلفوساليسيليك (الأسبرين) أو الأدوية التي تحتوي على مثبطات.[52]
اضطرابات الصفائح الدموية
مقتبس من:[53] الفئات الثلاث الواسعة لاضطرابات الصفائح الدموية، وهي «غير كافية»، و«مختلة الوظيفة»، و«كثيرة جدا».[53]
قلة الصفيحات
- فرفرية قليلة الصفيحات مجهولة السبب، وتعرف أيضا بقلة الصفيحات المناعي
- تضخم الطحال
- قلة الصفيحات العائلية[54]
- العلاج الكيميائي
- داء البابسيات
- حمى الضنك
- أونياليا
- فرفرية قلة الصفيحات الخثارية
- متلازمة هيلب
- متلازمة انحلال الدم اليوريمية
- فرفرية قلة الصفيحات بسبب الأدوية، وهم خمسة أدوية أخطرهم قلة الصفيحات المحدثة بالهيبارين
- قلة الصفيحات المرتبطة بالحمل
- فقر الدم اللاتنسجي
- قلة الصفيحات المرتبطة بنقل الدم
- قلة الصفيحات الكاذبة
- متلازمة غلبرت[55]
اختلال وظيفة الصفيحة الدموية
- اختلال وظيفة الصفيحة الدموية الخلقي:
- اضطرابات الالتصاق
- اضطرابات التفعيل
- اضطرابات كمية أو إفراز الحبيبات
- متلازمة هيرمانسكي-بودلاك
- متلازمة الصفيحات الرمادية
- عيب مستقبلات أدينوزين ثنائي الفوسفات
- نقص نشاط إنزيم سيكلوأكسجيناز
- اضطرابات التجمع
- اختلال وظيفة الصفيحة الدموية المكتسب
- اضطرابات الالتصاق
- بيلة هيموغلوبينية ليلية انتيابية
- الربو[56]
- ربو محرض بالأسبرين[57]
- السرطان[58]
- الملاريا[59]
- نقص نشاط إنزيم سيكلوأكسجيناز
- اضطرابات الالتصاق
كثرة الصفيحات
- كثرة الصفيحات التفاعلي
- عدوى مزمنة
- التهاب مزمن
- الأورام الخبيثة
- انعدام الطحال
- نقص الحديد
- فقد الدم الحاد
- مرض تكاثر نقوي: ارتفاع أعداد ونشاط الصفائح الدموية
- كثرة الصفيحات المرتبطة بالأمراض النقوية الأخرى
- كثرة الصفيحات الخلقية
فرفرية
العدد الحرج من الصفائح الدموية هو 40,000 / مم^3. إذا كان العدد أقل من العدد الحرج ثم ظهرت بقع حمراء أو طفح جلدي على الجلد، يسمى ذلك مرض الفرفرية.
أدوية تؤثر على الصفائح الدموية
الأدوية المضادة للالتهابات
بعض الأدوية المستخدمة لعلاج الالتهاب لها تأثير جانبي غير مرغوب فيه عن طرق قمع وظيفة الصفائح الدموية العادية، وهي الأدوية اللاستيرويدية المضادة للالتهابات (NSAIDS)، حيث يعطل الأسبرين وظيفة الصفائح الدموية بشكل لا رجعة فيه عن طريق تثبيط سيكلوأكسجيناز-1 (COX1)، وبالتالي يثبط الإرقاء الطبيعي. وتصبح الصفيحات الناتجة غير قادرة على إنتاج سيكلوأكسجيناز جديد؛ لأنه ليس لديهم حمض نووي ريبوزي منقوص الأكسجين (DNA). ولن تعود وظيفة الصفائح الدموية العادية إلى أن يتوقف استخدام الأسبرين ويتم استبدال ما يكفي من الصفائح الدموية المتضررة بالصفائح الدموية الجديدة التي يمكن أن تستغرق أكثر من أسبوع. الإيبوبروفين، هو دواء آخر لاستيرويدي مضاد للالتهاب ليس له تأثير طويل الأمد، حيث تسترجع الصفائح الدموية وظيفتها عادة في غضون 24 ساعة،[60] كما أن أخذ الإيبوبروفين قبل الأسبرين يمنع الآثار التي لا رجعة فيها للأسبرين.[61]
أدوية تثبط وظيفة الصفائح الدموية
تستخدم هذه الأدوية لمنع تشكيل خثرة.
أدوية تعطى عن طريق الفم
- أسبرين
- كلوبيدوغريل
- سيلوستازول
- تيكاغريلور
- تيكلوبيدين
أدوية تحفز إنتاج الصفائح الدموية
أدوية تعطى عن طريق الوريد
- أبسيكسيماب
- تيروفيبان
- روميبلوستيم
- إلترومبوباغ
- أرجباتروبان
العلاج بالصفائح الدموية
نقل الصفيحات
دواعي الاستخدام
غالبا ما يستخدم نقل الصفائح الدموية لتصحيح انخفاض تعدادات الصفائح الدموية بشكل غير عادي، إما لمنع النزف العفوي (عادة يكون العدد أقل من 10 × 109/ لتر) أو تحسبا للإجراءات الطبية التي سوف تنطوي بالضرورة على بعض النزيف، على سبيل المثال في المرضى الذين يخضعون لعملية جراحية، يرتبط مستوى الصفيحات الأقل من 50 × 109/ لتر مع نزف جراحي غير طبيعي، كما يتم تجنب التخدير الموضعي، مثل تخدير فوق الجافية مع مستويات الصفائح الأقل من 80 × 109/ لتر.[62] كما يمكن نقل الصفائح الدموية عندما يكون عدد الصفائح الدموية طبيعيا ولكن وظيفتها مختلة، مثل مع حالات تناول الفرد الأسبرين أو كلوبيدوغريل.[63] وأخيرا، يمكن نقل الصفائح الدموية كجزء من بروتوكول نقل الدم المكثف، حيث يتم نقل مكونات الدم الرئيسية الثلاثة (خلايا الدم الحمراء، والبلازما، والصفائح الدموية) لمعالجة نزف حاد. بينما يُمنَع نقل الصفائح الدموية مع فرفرية قلة الصفائح الدموية الخثارية، حيث أنه يحفز التخثر الاعتلالي.
تجميع الصفيحات

الصفائح الدموية إما مشتقة من الوحدات المجمعة من الدم الكامل ويتم تجميعها لعمل جرعة علاجية، أو يتم جمعها عن طريق فصل الصفائح الدموية من الدم، وذلك عن طريق جهاز طبي يقوم بسحب الدم ثم عزل الصفائح الدموية وإرجاع الدم إلى الجسم. المعيار الصناعي بالنسبة للصفائح الدموية هو فحصها من البكتيريا قبل نقل الدم لتجنب ردود الفعل الإنتانية، والتي يمكن أن تكون قاتلة. وقد سمحت مؤخرا معايير صناعة AABB لبنك الدم وخدمات نقل الدم (5.1.5.1) باستخدام تكنولوجيا الحد من مسببات الأمراض كبديل للفحص البكتيري في الصفائح الدموية.[64] ويستطيع الشخص الطبيعي أن يقوم بالتبرع ب200 مل- 400 مل في المرة الواحدة. وتستمر عملية التبرع حوالي ساعة كاملة ويعوض الجسم النقص خلال 8-10 أيام ويستطيع المتبرع إعادة التبرع خلال أسبوع إلى أسبوعين بسلامة تامة.
تخزين الصفيحات
الصفائح الدموية التي تم جمعها بأي من الأسلوبين لها فترة صلاحية قصيرة جدا، عادة خمسة أيام، مما يؤدي إلى مشاكل متكررة مع نقص الإمداد، حيث أن اختبار التبرعات غالبا ما يتطلب ما يصل إلى يوم كامل. وبما أنه لا توجد حلول فعالة حافظة للصفائح الدموية، فإنها تفقد فاعليتها بسرعة، وتكون أفضل عندما تكون جديدة.
يتم تخزين الصفائح الدموية تحت التحريض المستمر في 20-24 درجة مئوية (68-75.2 درجة فهرنهايت). ولا يمكن تبريد الوحدات لأن ذلك يسبب تغير شكل الصفائح الدموية كما أنها تفقد وظيفتها. ويوفر التخزين في درجة حرارة الغرفة بيئة للبكتيريا التي يتم إدخالها إلى مكونات الدم أثناء عملية الجمع لتتكاثر وتسبب في وقت لاحق تجرثم دم المريض. وتوجد لوائح في الولايات المتحدة تتطلب اختبار المنتج من حيث وجود تلوث جرثومي به قبل نقله.[65]
توصيل الصفيحات للمتلقي
لا تحتاج الصفائح الدموية إلى الانتماء إلى نفس فصيلة الدم A-B-O للمتلقي أو إلى أن تكون متقاربة لضمان التوافق المناعي بين المانح والمتلقي ما لم تحتوي على كمية كبيرة من خلايا الدم الحمراء، ويعطي وجود كرات الدم الحمراء في الدم لون برتقالي محمر للمنتج. ويتم أحيانا بذل جهد للحصول على نوع معين من الصفائح الدموية، ولكن هذا الأمر ليس خطرا كما هو الحال مع كرات الدم الحمراء.
قد يتم تعريض الصفائح للإشعاع قبل نقل الصفائح إلى المتلقي لمنع حدوث رفض العائل لدم المضيف أو قد يتم غسلها لإزالة البلازما إذا كان هناك حاجة لذلك.
ويسمى التغيير في عدد الصفائح الدموية للمتلقي بعد نقل الدم «الزيادة (increment)» ويتم حسابها بطرح عدد الصفائح الدموية قبل نقل الدم من عدد الصفائح الدموية بعد نقل الدم. وتؤثر العديد من العوامل على الزيادة بما في ذلك حجم جسم المتلقي، وعدد الصفائح الدموية المنقولة، والسمات السريرية التي قد تسبب تدمير سابق لأوانه للصفائح الدموية المنقولة. وعندما يفشل المتلقي في إثبات زيادة كافية بعد نقل الدم، يسمى ذلك «حِران نقل الصفيحات».
يمكن معالجة الصفائح الدموية، إما المشتقة من فصل الدم أو من التبرع العشوائي، من خلال عملية خفض الحجم. وفي هذه العملية، يتم تدوير الصفائح الدموية في جهاز الطرد المركزي وإزالة البلازما الزائدة تاركا من 10 إلى 100 مل من ركازة الصفائح الدموية. وعادة ما يتم نقل هذه الصفائح الدموية ذات الحجم المنخفض إلى المرضى حديثي الولادة والأطفال فقط، حيث يكون حجم البلازما الكبير زائدا بالنسبة لنظام الدورة الدموية الصغيرة للطفل. كما يقلل انخفاض حجم البلازما أيضا من فرص رد الفعل السلبي لنقل الدم مع بروتينات البلازما.[66] الصفائح الدموية مخفضة الحجم لديها صلاحية لمدة أربع ساعات فقط.[5]
علاج الجروح
تطلق الصفائح الدموية عامل النمو المشتق من الصفائح الدموية؛ وهو عامل جذب كيميائي فعال، وعامل النمو المحول بيتا الذي يحفز ترسب النسيج خارج الخلية، وعوامل نمو الأرومة الليفية، وعامل النمو شبيه الأنسولين 1، وعامل نمو البشرة المشتق من الصفائح الدموية، وعامل نمو بطانة الأوعية الدموية. ويعمل الاستخدام الموضعي لهذه العوامل على زيادة التركيزات مع استخدام البلازما الغنية بالصفائح الدموية كعامل مساعد في التئام الجروح.[67]
طالع أيضا
مراجع
- ^ Q118929929، ص. 514، QID:Q118929929
- ^ Q114972534، ص. 56، QID:Q114972534
- ^ أ ب Brewer DB (2006). "Max Schultze (1865), G. Bizzozero (1882) and the discovery of the platelet". Br. J. Haematol. ج. 133 ع. 3: 251–58. DOI:10.1111/j.1365-2141.2006.06036.x. PMID:16643426.
- ^ أ ب Movat HZ؛ Weiser WJ؛ Glynn MF؛ Mustard JF (1965). "Platelet phagocytosis and aggregation". J. Cell Biol. ج. 27 ع. 3: 531–43. DOI:10.1083/jcb.27.3.531. PMC:2106759. PMID:4957257.
- ^ أ ب CBBS: Washed and volume-reduced Plateletpheresis units. Cbbsweb.org (2001-10-25). Retrieved on 2011-11-14. نسخة محفوظة 14 أبريل 2014 على موقع واي باك مشين.
- ^ Laki K (8 ديسمبر 1972). "Our ancient heritage in blood clotting and some of its consequences". Annals of the New York Academy of Sciences. ج. 202: 297–307. Bibcode:1972NYASA.202..297L. DOI:10.1111/j.1749-6632.1972.tb16342.x. PMID:4508929.
- ^ Machlus KR؛ Thon JN؛ Italiano JE (2014). "Interpreting the developmental dance of the megakaryocyte: A review of the cellular and molecular processes mediating platelet formation". British Journal of Haematology. ج. 165 ع. 2: 227–36. DOI:10.1111/bjh.12758. PMID:24499183.
- ^ Jain NC (1975). "A scanning electron microscopic study of platelets of certain animal species". Thrombosis et diathesis haemorrhagica. ج. 33 ع. 3: 501–07. PMID:1154309.
- ^ Michelson, pp. 117–18
- ^ Paulus JM (1975). "Platelet size in man". Blood. ج. 46 ع. 3: 321–36. PMID:1097000.
- ^ أ ب ت Michelson, p. 3
- ^ أ ب ت ث ج Yip J؛ Shen Y؛ Berndt MC؛ Andrews RK (2005). "Primary platelet adhesion receptors". IUBMB Life (International Union of Biochemistry and Molecular Biology: Life). ج. 57 ع. 2: 103–08. DOI:10.1080/15216540500078962. PMID:16036569.
- ^ Berridge, M.J. (2012) Cell Signalling Biology; دُوِي:10.1042/csb0001011
- ^ Lancet, 1882, ii. 916; Notes of Gulliver's Researches in Anatomy, Physiology, Pathology, and Botany, 1880; Carpenter's Physiology, ed. Power, 9th ed., see Index under 'Gulliver.'
- ^
Godlee، Sir Rickman (1917). Lord Lister. London: Macmillan & Co.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) - ^ Robb-Smith، A. H (1967). "Why the platelets were discovered". British Journal of Haematology. ج. 13 ع. 4: 618–37. DOI:10.1111/j.1365-2141.1967.tb00769.x. PMID:6029960.
- ^ Beale LS (1864). "On the Germinal Matter of the Blood, with Remarks upon the Formation of Fibrin". Transactions of the Microscopical Society & Journal. ج. 12: 47–63. DOI:10.1111/j.1365-2818.1864.tb01625.x.
- ^ Schultze M (1865). "Ein heizbarer Objecttisch und seine Verwendung bei Untersuchungen des Blutes". Arch Mikrosk Anat. ج. 1 ع. 1: 1–42. DOI:10.1007/BF02961404.
- ^ Bizzozero, J. (1882). "Über einen neuen Forrnbestandteil des Blutes und dessen Rolle bei der Thrombose und Blutgerinnung". Arch Pathol Anat Phys Klin Med. ج. 90 ع. 2: 261–332. DOI:10.1007/BF01931360.
- ^ Osler W (1886). "On certain problems in the physiology of the blood corpuscles". The Medical News. ج. 48: 421–25.
- ^ Wright JH (1906). "The Origin and Nature of the Blood Plates". The Boston Medical and Surgical Journal. ج. 154 ع. 23: 643–45. DOI:10.1056/NEJM190606071542301.
- ^ Wright JH (1910). "The histogenesis of blood platelets". J Morphology. ج. 21 ع. 2: 263–78. DOI:10.1002/jmor.1050210204.
- ^ Furie B؛ Furie BC (2008). "Mechanisms of thrombus formation". New England Journal of Medicine. ج. 359 ع. 9: 938–49. DOI:10.1056/NEJMra0801082. PMID:18753650.
- ^ Girling J.H. (1962). "An automatic platelet counting technique". The Journal of medical laboratory technology. ج. 19: 168–73. PMID:13898919.
- ^ Ross D.W.؛ Ayscue L.H.؛ Watson J.؛ Bentley S.A. (1988). "Stability of hematologic parameters in healthy subjects. Intraindividual versus interindividual variation". American journal of clinical pathology. ج. 90 ع. 3: 262–67. DOI:10.1093/ajcp/90.3.262. PMID:3414599.
- ^ Ruocco L.؛ Del Corso L.؛ Romanelli A.M.؛ Deri D.؛ وآخرون (2001). "New hematological indices in the healthy elderly". Minerva medica. ج. 92 ع. 2: 69–73. PMID:11323567.
- ^ Lozano M.؛ Narváez J.؛ Faúndez A.؛ Mazzara R.؛ وآخرون (1998). "Platelet count and mean platelet volume in the Spanish population". Medicina clinica. ج. 110 ع. 20: 774–77. PMID:9666418.
- ^ Murakawa M؛ Okamura T؛ Tsutsumi K؛ Tanoguchi S؛ وآخرون (1992). "Acquired von Willebrand's disease in association with essential thrombocythemia: Regression following treatment". Acta haematologica. ج. 87 ع. 1–2: 83–87. DOI:10.1159/000204725. PMID:1585777.
- ^ van Genderen PJ؛ Leenknegt H؛ Michiels JJ؛ Budde U (1996). "Acquired von Willebrand disease in myeloproliferative disorders". Leukemia and Lymphoma. 22 Suppl 1: 79–82. DOI:10.3109/10428199609074364. PMID:8951776.
- ^ Michelson, p. 815, Table 39-4
- ^ Harker LA؛ Roskos LK؛ Marzec UM؛ Carter RA؛ وآخرون (أبريل 2000). "Effects of megakaryocyte growth and development factor on platelet production, platelet life span, and platelet function in healthy human volunteers". Blood. ج. 95 ع. 8: 2514–22. PMID:10753829.
- ^ Mason KD؛ Carpinelli MR؛ Fletcher JI؛ Collinge JE؛ وآخرون (2007). "Programmed anuclear cell death delimits platelet life span". Cell. ج. 128 ع. 6: 1173–86. DOI:10.1016/j.cell.2007.01.037. PMID:17382885.
- ^ Palmer RM؛ Ferrige AG؛ Moncada S (1987). "Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor". Nature. ج. 327 ع. 6122: 524–26. Bibcode:1987Natur.327..524P. DOI:10.1038/327524a0. PMID:3495737.
- ^ Jones CI؛ Barrett NE؛ Moraes LA؛ Gibbins JM؛ وآخرون (2012). "Endogenous inhibitory mechanisms and the regulation of platelet function". Methods Mol. Biol. Methods in Molecular Biology. ج. 788: 341–66. DOI:10.1007/978-1-61779-307-3_23. ISBN:978-1-61779-306-6. PMID:22130718.
- ^ Marcus AJ؛ Broekman MJ؛ Drosopoulos JH؛ Olson KE؛ وآخرون (2005). "Role of CD39 (NTPDase-1) in thromboregulation, cerebroprotection, and cardioprotection". Seminars in Thrombosis and Hemostasis. ج. 31 ع. 2: 234–46. DOI:10.1055/s-2005-869528. PMID:15852226.
- ^ Dubois C؛ Panicot-Dubois L؛ Merrill-Skoloff G؛ Furie B؛ وآخرون (مايو 2006). "Glycoprotein VI-dependent and -independent pathways of thrombus formation in vivo". Blood. ج. 107 ع. 10: 3902–06. DOI:10.1182/blood-2005-09-3687. PMC:1895285. PMID:16455953.
- ^ Matarrese P؛ Straface E؛ Palumbo G؛ Anselmi M؛ وآخرون (2009). "Mitochondria regulate platelet metamorphosis induced by opsonized zymosan A—activation and long-term commitment to cell death". FEBS Journal. ج. 276 ع. 3: 845–56. DOI:10.1111/j.1742-4658.2008.06829.x. PMID:19143843.
- ^ Behnke O (1970). "The morphology of blood platelet membrane systems". Series haematologica. ج. 3 ع. 4: 3–16. PMID:4107203.
- ^ O'Halloran AM؛ Curtin R؛ O'Connor F (فبراير 2006). "The impact of genetic variation in the region of theGPIIIagene, on PlA2expression bias and GPIIb/IIIa receptor density inplatelets". British Journal of Haematology. ج. 132 ع. 4: 494–502. DOI:10.1111/j.1365-2141.2005.05897.x. PMID:16412022.
- ^ Coller BS؛ Cheresh DA؛ Asch E؛ Seligsohn U (1991). "Platelet vitronectin receptor expression differentiates Iraqi-Jewish from Arab patients with Glanzmann thrombasthenia in Israel". Blood. ج. 77 ع. 1: 75–83. PMID:1702031.
- ^ Nguyen, D.T., Orgill D.P., Murphy G.F. (2009). Chapter 4: The Pathophysiologic Basis for Wound Healing and Cutaneous Regeneration. Biomaterials For Treating Skin Loss. Woodhead Publishing (UK/Europe) & CRC Press (US), Cambridge/Boca Raton, pp. 25–57. ((ردمك 978-1-4200-9989-8) (ردمك 978-1-84569-363-3))
- ^ أ ب Bouchard BA؛ Mann KG؛ Butenas S (أغسطس 2010). "No evidence for tissue factor on platelets". Blood. ج. 116 ع. 5: 854–55. DOI:10.1182/blood-2010-05-285627. PMC:2918337. PMID:20688968.
- ^ Ahmad SS؛ Rawala-Sheikh R؛ Walsh PN (1992). "Components and assembly of the factor X activating complex". Semin. Thromb. Hemost. ج. 18 ع. 3: 311–23. DOI:10.1055/s-2007-1002570. PMID:1455249.
- ^ Tyagi، T؛ Ahmad، S؛ Gupta، N؛ Sahu، A؛ Ahmad، Y؛ Nair، V؛ Chatterjee، T؛ Bajaj، N؛ Sengupta، S؛ Ganju، L؛ Singh، S. B؛ Ashraf، M. Z (فبراير 2014). "Altered expression of platelet proteins and calpain activity mediate hypoxia-induced prothrombotic phenotype". Blood. ج. 123 ع. 8: 1250–60. DOI:10.1182/blood-2013-05-501924. PMID:24297866.
- ^ Weyrich AS؛ Zimmerman GA (2004). "Platelets: signaling cells in the immune continuum". Trends Immunol. ج. 25 ع. 9: 489–95. DOI:10.1016/j.it.2004.07.003. PMID:15324742.
- ^ Wagner DD؛ Burger PC (2003). "Platelets in inflammation and thrombosis". Arterioscler. Thromb. Vasc. Biol. ج. 23 ع. 12: 2131–37. DOI:10.1161/01.ATV.0000095974.95122.EC. PMID:14500287.
- ^ Diacovo TG؛ Puri KD؛ Warnock RA؛ Springer TA؛ وآخرون (1996). "Platelet-mediated lymphocyte delivery to high endothelial venules". Science. ج. 273 ع. 5272: 252–55. Bibcode:1996Sci...273..252D. DOI:10.1126/science.273.5272.252. PMID:8662511.
- ^ Iannacone M؛ Sitia G؛ Isogawa M؛ Marchese P؛ وآخرون (2005). "Platelets mediate cytotoxic T lymphocyte-induced liver damage". Nat. Med. ج. 11 ع. 11: 1167–69. DOI:10.1038/nm1317. PMC:2908083. PMID:16258538.
- ^ Schmaier AA؛ Stalker TJ؛ Runge JJ؛ Lee D؛ وآخرون (سبتمبر 2011). "Occlusive thrombi arise in mammals but not birds in response to arterial injury: evolutionary insight into human cardiovascular disease". Blood. ج. 118 ع. 13: 3661–69. DOI:10.1182/blood-2011-02-338244. PMC:3186337. PMID:21816834.
- ^ Belamarich FA؛ Shepro D؛ Kien M (نوفمبر 1968). "ADP is not involved in thrombin-induced aggregation of thrombocytes of a non-mammalian vertebrate". Nature. ج. 220 ع. 5166: 509–10. Bibcode:1968Natur.220..509B. DOI:10.1038/220509a0. PMID:5686175.
- ^ Duke WW (1910). "The relation of blood platelets to hemorrhagic disease". JAMA. ج. 55 ع. 14: 1185–92. DOI:10.1001/jama.1910.04330140029009.
- ^ "Platelet Function Assay FAQ" (PDF). Department of Pathology. Virginia Commonwealth University. مؤرشف من الأصل (PDF) في 2017-09-19. اطلع عليه بتاريخ 2017-03-27.
- ^ أ ب Michelson, p. vii
- ^ Geddis، AE (فبراير 2013). "Inherited thrombocytopenias: an approach to diagnosis and management". International journal of laboratory hematology. ج. 35 ع. 1: 14–25. DOI:10.1111/j.1751-553x.2012.01454.x. PMID:22846067.
- ^ Cure MC، Cure E، Kirbas A، Cicek AC، Yuce S (2013). "The effects of Gilbert's syndrome on the mean platelet volume and other hematological parameters". Blood Coagul. Fibrinolysis. ج. 24 ع. 5: 484–88. DOI:10.1097/MBC.0b013e32835e4230. PMID:23348429.
- ^ Kornerup KN؛ Page CP (2007). "The role of platelets in the pathophysiology of asthma". Platelets. ج. 18 ع. 5: 319–28. DOI:10.1080/09537100701230436. PMID:17654302.
- ^ Laidlaw TM؛ Kidder MS؛ Bhattacharyya N؛ Xing W؛ وآخرون (2012). "Cysteinyl leukotriene overproduction in aspirin-exacerbated respiratory disease is driven by platelet-adherent leukocytes". Blood. ج. 119 ع. 16: 3790–98. DOI:10.1182/blood-2011-10-384826. PMC:3335383. PMID:22262771.
- ^ Erpenbeck L؛ Schön MP (2010). "Deadly allies: the fatal interplay between platelets and metastasizing cancer cells". Blood. ج. 115 ع. 17: 3427–36. DOI:10.1182/blood-2009-10-247296. PMC:2867258. PMID:20194899.
- ^ Pleass RJ (2009). "Platelet power: sticky problems for sticky parasites?". Trends Parasitol. ج. 25 ع. 7: 296–99. DOI:10.1016/j.pt.2009.04.002. PMC:3116138. PMID:19539528.
- ^ "Platelet Function after Taking Ibuprofen for 1 Week". Annals of Internal Medicine. ج. 142 ع. 7: I54. 2005. DOI:10.7326/0003-4819-142-7-200504050-00004. PMID:15809457.
- ^ Rao GH؛ Johnson GG؛ Reddy KR؛ White JG (1983). "Ibuprofen protects platelet cyclooxygenase from irreversible inhibition by aspirin". Arteriosclerosis. ج. 3 ع. 4: 383–88. DOI:10.1161/01.ATV.3.4.383. PMID:6411052.
- ^ van Veen JJ؛ Nokes TJ؛ Makris M (2010). "The risk of spinal haematoma following neuraxial anaesthesia or lumbar puncture in thrombocytopenic individuals". Br. J. Haematol. ج. 148 ع. 1: 15–25. DOI:10.1111/j.1365-2141.2009.07899.x. PMID:19775301.
- ^ Roback، J.؛ Grossman، B.؛ Harris، T.؛ Hillyer، C.، المحررون (2011). Technical Manual (ط. 17th). Bethesda MD: AABB. ص. 580. ISBN:978-1-56395-315-6.
- ^ American Association of Blood Banks (2003). "5.1.5.1". Standards for Blood Banks and Transfusion Services (ط. 22nd). Bethesda MD: AABB.
- ^ AABB (2009). Standards for Blood Banks and Transfusion Services (ط. 26th). Bethesda MD: AABB.
- ^ Schoenfeld H؛ Spies C؛ Jakob C (2006). "Volume-reduced platelet concentrates". Curr. Hematol. Rep. ج. 5 ع. 1: 82–88. PMID:16537051.
- ^ Gawaz M؛ Vogel S (أكتوبر 2013). "Platelets in tissue repair: control of apoptosis and interactions with regenerative cells". Blood. ج. 122 ع. 15: 2550–54. DOI:10.1182/blood-2013-05-468694. PMID:23963043.
روابط خارجية
- Michelson، Alan D. (2013). Platelets (ط. 3rd). Academic. ISBN:0-12-387837-3. مؤرشف من الأصل في 2018-01-14. 1351 pages; 60,000 references. Excerpts free online.
| في كومنز صور وملفات عن: صفيحة دموية |
