|
تضامنًا مع حق الشعب الفلسطيني |
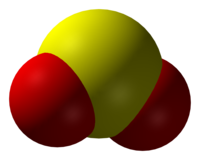
ثنائي أكسيد الكبريت
| ثنائي أكسيد الكبريت | |
|---|---|
| الاسم النظامي (IUPAC) | |
ثنائي أكسيد الكبريت |
|
| أسماء أخرى | |
ثاني أكسيد الكبريت، أكسيد الكبريت الرباعي |
|
| المعرفات | |
| رقم CAS | 7446-09-5 |
| الخواص | |
| الصيغة الجزيئية | SO2 |
| الكتلة المولية | 64.07 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 2.551 غ/ل (غاز) 1.46 غ/سم3 (سائل, −10 °س) |
| نقطة الانصهار | - 75.5 °س (198 K) |
| نقطة الغليان | - 10.0 °س (263 K) |
| الذوبانية في الماء | 9.4 غ/100 مل ماء عند 25 °س |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثنائي أكسيد الكبريت وهو أحد أكاسيد الكبريت، وهو مركب كيميائي له الصيغة SO2، ينتج طبيعياً من البراكين وصناعياً من العديد من العمليات الصناعية ومن حرق المشتقات النفطية التي تحوي على مركبات الكبريت. يعد ثنائي أكسيد الكبريت من الملوثات حيث يعد من أحد مسببات الأمطار الحامضية. [1]
التحضير
ينتج ثنائي أكسيد الكبريت من حرق فلز الكبريت :
- S8 + 8O2 → 8SO2
إن ناتج حرق كبريتيد الهيدروجين ومركبات الكبريت العضوية تعطي نفس النتيجة.
- 2H2S (g) + 3O2g) → 2H2O (g) + 2SO2 (g)
إن تحميص معادن الكبريتيدات مثل البيريت، السفاليريت وغيرها تنتج SO2 أيضاً:
- 4FeS2 (s) + 11O2 (g) → 2Fe2O3 (s) + 8SO2 (g)
- 2ZnS (s) + 3O2 (g) → 2ZnO (s) + 2SO2 (g)
- HgS (s) + O2 (g) → Hg (g) + SO2 (g)
يصدر ثنائي أكسيد الكبريت كناتج ثانوي من إنتاج إسمنت سيليكات الكالسيوم:
حيث تسخن CaSO4 مع فحم الكوك والرمل:
- 2CaSO4 (s) + 2SiO2 (s) + C (s) → 2CaSiO3 (s) + 2SO2 (g) + CO2 (g)
إن أثر حمض الكبريتيك الساخن على برادة النحاس تعطي غاز ثنائي أكسيد الكبريت.
- Cu (s) + 2H2SO4 (aq) → CuSO4 (aq) + SO2 (g) + 2H2O (l)
معرض صور
المراجع
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
| في كومنز صور وملفات عن: ثنائي أكسيد الكبريت |