|
تضامنًا مع حق الشعب الفلسطيني |
دالبافانسين
| دالبافانسين | |
|---|---|
| اعتبارات علاجية | |
| اسم تجاري | Dalvance |
| طرق إعطاء الدواء | علاج عن طريق الوريد |
| معرّفات | |
| CAS | 171500-79-1 |
| ك ع ت | J01J01XA04 XA04 |
| بوب كيم | CID 16134410 |
| كيم سبايدر | 23340937 |
| المكون الفريد | 808UI9MS5K |
| ChEBI | CHEBI:82721 |
| ChEMBL | CHEMBL527063 |
| بيانات كيميائية | |
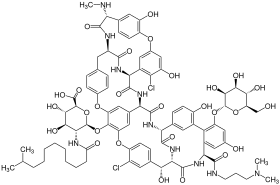
| الصيغة الكيميائية | C88H100Cl2N10O28 |
| الكتلة الجزيئية | 1816.7 g/mol |
| تعديل مصدري - تعديل | |
دالبافانسين Dalbavancin (الاسم بالتجارة زيفين) هو مضاد حيوي من الجيل الثاني لل lipoglycopeptide. ينتمي إلى نفس الفئة التي ينتمي لها الفانكومايسين، وهو شائع الاستخدام ويعد من العلاجات القليلة المتاحة للمرضى المصابين بالمكورات العنقودية الذهبية المقاومة للميثيسيلين (MRSA).[1]
Dalbavancin هو lipoglycopeptide شبه صنعي تم تصنيعه لتحسين طبيعة الglycopeptides المتاحة حاليا، الفانكومايسين والتيكوبلانين.[2]
الاستعمال العلاجي
يمتلك فعالية في الزجاج ضد طيف واسع من إيجابيات الغرام الممرضة، بما في ذلك المكورات العنقودية الذهبية المقاومة للميثيسيلين والمكورات العنقودية البشروية المقاومة للميثيسيلين MRSE . وهو يعطى مرة واحدة أسبوعيا.[3] لأن الدالبافانسين أثبتت فعالية ضد MRSA والكائنات الدقيقة الأخرى لعلاج التهابات خطيرة أو مهددة للحياة، وكان أول عقار اجيز لعلاج الأمراض المعدية الناتجة ضمن المحفزات المولدة من المضادات الحيوية الفعل الآن (GAIN) ، الذي هو جزء من سلامة FDA و قانون الابتكار.[4]
موانع الاستعمال
يمنع استعمال دالبافانسين في المرضى الذين يعانون من فرط الحساسية للدالبافانسين، مثل التفاعلات الجلدية أو الحساسية المفرطة، وينصح الحذر للمرضى الذين يعانون من فرط الحساسية المعروفة لجلكوببتيدات الأخرى. لا يوجد حاليا أي بيانات عن عبور - التفاعلية بين دالبافانسين وvancomyin.[5]
الآثار الجانبية
وكانت الآثار الجانبية الأكثر شيوعا التي صودفت في المرحلة الثانية وتجارب المرحلة الثالثة الغثيان (5.5٪)، والصداع (4.7٪)، والإسهال (4.4٪)، وكذلك الطفح الجلدي (2.7٪) والحكة (2.1٪). وشملت الآثار الجانبية أقل تكرارا ولكنها خطيرة كغيرها من الاضطرابات الدموية، heptatotoxicity، المطثية العسيرة التهاب القولون، التشنج القصبيتفاعلات ذات الصلة بما في ذلك التسريب متلازمة الرجل الأحمر، وصدمة فرط الحساسية.[5]
التاريخ
خضع دالبافانسين لتجربة إكلينيكية للمرحلة الثالثة للبالغين مع الالتهابات الجلدية المعقدة، ولكن في ديسمبر 2007فإنFDA. صرحت ان هناك حاجة إلى المزيد من البيانات قبل الموافقة[6] في سبتمبر 9، 2008، أعلنت شركة فايزر انها ستسحب جميع طلبات التسويق لإجراء التجارب السريرية المرحلة الثالثة مرة أخرى.[7]
مصادر
- ^ Vicuron Pharmaceuticals Submits New Drug Application for Dalbavancin to U.S. Food and Drug Administration نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- ^ Scheinfeld NS. (مايو 2006). "Dalbavancin: A review for dermatologists". Dermatology Online Journal. ج. 12 ع. 6. PMID:17083861.
- ^ Centers for Disease Control and Prevention - Methicillin-Resistant Staphylococcus aureus (MRSA) infections. http://www.cdc.gov/mrsa/ نسخة محفوظة 18 مارس 2021 على موقع واي باك مشين.
- ^ Dalbavancin: First I.V. antibiotic for acute bacterial skin infections. http://www.pharmacist.com/dalbavancin-first-iv-antibiotic-acute-bacterial-skin-infections نسخة محفوظة 14 فبراير 2018 على موقع واي باك مشين.
- ^ أ ب Dalvance (dalbavancin) for injection Full Prescribing Information. http://content.stockpr.com/duratatherapeutics/files/docs/Dalvance+APPROVED+USPI.PDF نسخة محفوظة 2021-01-24 على موقع واي باك مشين.
- ^ UPDATE 1-Pfizer says US FDA wants more data on antibiotic. Dec 2007 نسخة محفوظة 22 أبريل 2008 على موقع واي باك مشين.
- ^ "Pfizer Will Withdraw Global Marketing Applications for Dalbavancin to Conduct a New Trial" (Press release). فايزر. 9 سبتمبر 2008. مؤرشف من الأصل في 2019-08-01. اطلع عليه بتاريخ 2008-09-11.