|
تضامنًا مع حق الشعب الفلسطيني |
رنح نخاعي مخيخي
| الرنح النخاعي المخيخي | |
|---|---|
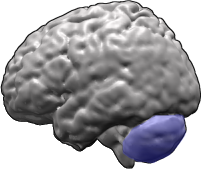
المخيخ (باللون الأزرق) في الدماغ البشري
| |
| تعديل مصدري - تعديل |
الرنح النخاعي المخيخي أو ضمور المخيخ والحبل الشوكي (بالإنجليزية: Spinocerebellar ataxai) هو مرض وراثي وهو إحدى أنواع الاضطرابات التي تصيب مناطق مختلفة من المخيخ وذلك بسبب خلل جيني مما يؤدي إلى ضمور المخيخ والحبل الشوكي.[1][2][3]
الأسباب
تصنف أنواع الرنح الوراثي حسب نمط التوريث والجين المسبب أو الموقع الكروموسومي. تنتقل أمراض الرنح الوراثية بصفة جسدية سائدة أو متنحية أو مرتبطة بالكروموسوم إكس.
- تتوفر اليوم معلومات وراثية نوعية حول عدة أنواع من الرنح المخيخي الجسدي السائد. استخدمت مرادفات الرنح المخيخ الجسدي السائد قبل الفهم الحالي لعلم الوراثة الجزيئية، وهي: رنح ماري والضمور الزيتوني الجسري المخيخي الموروث والضمور المخيخي الزيتوني -أو مصطلح التنكس النخاعي المخيخي الأكثر عمومية. يعتبر التنكس النخاعي المخيخي اضطراب عصبي وراثي نادر يؤثر على الجهاز العصبي المركزي، ويتميز بالتنكس البطيء لمناطق معينة من الدماغ. يوجد ثلاثة أشكال للتنكس النخاعي المخيخي، وأعراضه تبدأ خلال مرحلة البلوغ.
- توجد خمسة اضطرابات جسدية متنحية نموذجية يكون فيها الرنح سمة بارزة: رنح فريدريخ ورنح توسع الشعيرات والرنح المترافق بعوز فيتامين هـ والرنح المصحوب بتعذر الأداء الحركي للعين والرنح التشنجي. تتضمن التقسيمات الفرعية للاضطراب: رنح فريدريخ والرنح النخاعي المخيخي ورنح توسع الشعيرات والرنح الوعائي الحركي والرنح الدهليزي المخيخي والوهن الرنحي وفقد انتظام عضلات النطق والضمور الزيتوني الجسري المخيخي ومرض شاركو ماري توث.[4]
- في بعض الحالات، قد تتكرر عديدات الجلوتامين، وهذا يؤدي في كثير من الأحيان إلى بدء المرض في عمر مبكر، ويسبب نمط ظاهري أكثر شدة لدى من ورث الأليل. يندرج ذلك تحت ظاهرة الاستباق الجيني. تتميز عدة أنواع من الرنح النخاعي المخيخي بامتداد تكرر ثلاثي النكليوتيدات CAG (سايتوسين- أدينين- غوانين) في الحمض النووي الذي يشفر مسار تكرار عديدات الجلوتامين في البروتين. يبدو أن امتداد تكرار CAG على مدى الأجيال المتعاقبة يرجع إلى سوء اقتران السلسلة المنزلقة (أو طفرة انزلاق الاستنساخ) أثناء تضاعف الحمض النووي الريبوزي منقوص الأكسجين أو ترميمه.[5]
أعراض الإصابة
أهم أعراض الإصابة:
- اختلال التوازن عند المشي أو مايعرف بالترنح مما يؤدي إلى كثرة السقوط ومع تقدم المرض يحتاج المريض إلى استخدام الكرسي المتحرك ومن ثم فقد الحركة كليا ويصبح المريض طريح الفراش.
- انعدام تناسق الحركات العضلية للذراعين مما يؤدي إلى صعوبة الكتابة ومن ثم فقدها كليا.
- إصابة العينين ببطء الحركة ممايؤدي إلى عدم القدرة على تقدير المسافات.
- بعض المرضى يصابون بالتشنج وتعتبر من الأعراض المبكرة للضمور.
وتزداد الأعراض سوءاً مع تقدم المرض مثل:
- صعوبة الابتلاع.
- التحدث بطريقة غير واضحة.
- ضعف الذاكرة.
- الشلل الرعاشي.
وهناك أمراض مصاحبة مثل:
الفحوصات اللازمة
يجب القيام بتحاليل وراثية للمريض وأسرته وذلك عن طريق أخذ عينة من الدم والكشف عن الخريطة الجينية كما يجب معرفة مدى احتمالية إصابة فرد آخر من الأجيال القادمة بنفس المرض.
طرق العلاج
حتى الآن لايوجد علاج لضمور المخيخ والحبل الشوكي ولكن هناك علاجات لتخفيف الأعراض وليس لعلاج المرض نفسه مثل:
- بوسبيرون (buspiron):يقوم بتهدئة الأعصاب وتحسين القدرة على المشي.
- بريميدون (primidon):تقليل الحركات اللاإرادية.
وهناك مجموعة من الأجهزة التي تساعد المريض الاعتماد على نفسه في القيام بالمهمات اليومية، مثل:العكاز والكرسي المتحرك في حالة عدم القدرة على المشي، وهناك أجهزة تساعد على الكتابة وتناول الطعام والقيام بالعناية الشخصية في حالة عطوب اليد والذراع، وهناك أجهزة للتواصل مع الناس في حالة فقد القدرة على الكلام، وكذلك العلاج البدني مما يساعد على تقوية العضلات.
روابط خارجية
- http://www.ataxia.org - National Ataxia Foundation is dedicated to helping families with ataxia through research, education, and support.
- Cerebellar Degenerations at tchain.com
- http://leedsdna.info/tests/DRPLA.htm
- http://www.ataxiaforums.co.uk
- Bird، Thomas D (23 يناير 2014). Hereditary Ataxia Overview. PMID:20301317. NBK1138. مؤرشف من الأصل في 2019-10-18. In Pagon RA, Bird TD, Dolan CR؛ وآخرون، المحررون (1993). GeneReviews™ [Internet]. Seattle WA: University of Washington, Seattle. مؤرشف من الأصل في 2020-03-28.
{{استشهاد بكتاب}}: Explicit use of et al. in:|محرر=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المحررين (link) - Moreira، Maria-Ceu؛ Koenig، Michel (8 ديسمبر 2011). Ataxia with Oculomotor Apraxia Type 2. PMID:20301333. NBK1154. مؤرشف من الأصل في 2020-03-28. In GeneReviews
- Pulst، Stefan-M (1 مارس 2012). Spinocerebellar Ataxia Type 13. PMID:20301404. NBK1225. مؤرشف من الأصل في 2016-12-02. In GeneReviews
- Brussino، Alessandro؛ Brusco، Alfredo؛ Dürr، Alexandra (7 فبراير 2013). Spinocerebellar Ataxia Type 28. PMID:21595125. NBK54582. مؤرشف من الأصل في 2020-03-28. In GeneReviews
- الوراثة المندلية البشرية عبر الإنترنت (OMIM): Spinocerebellar Ataxia, Autosomal Recessive 1; SCAR1 -606002
- الوراثة المندلية البشرية عبر الإنترنت (OMIM): Senataxin; SETX -608465
- ataxia على موقع المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NINDS)
- msa على موقع المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NINDS)
- opca_doc على موقع المعهد الوطني للاضطرابات العصبية والسكتة الدماغية (NINDS)
- مدلاين بلس Olivopontocerebellar atrophy
- Spinocerebellar ataxia 27 في معاهد الصحة الوطنية الأمريكية للأمراض النادرة
- Spinocerebellar ataxia dysmorphism في معاهد الصحة الوطنية الأمريكية للأمراض النادرة
مراجع
- ^ "SCA2 information sheet from www.ataxia.org" (PDF). مؤرشف من الأصل (PDF) في 2016-03-03.
- ^ Veritas، Gene (17 أغسطس 2013). "RNA Interference for Treating Huntington's Disease: An Interview with Dr. Beverly Davidson". Vimeo. مؤرشف من الأصل في 2019-04-12. اطلع عليه بتاريخ 2017-10-14.
- ^ Rossi، M؛ Perez-Lloret، S؛ Doldan، L؛ Cerquetti، D؛ Balej، J؛ Millar Vernetti، P؛ Hawkes، H؛ Cammarota، A؛ Merello، M (2014). "Autosomal dominant cerebellar ataxias: A systematic review of clinical features". European Journal of Neurology. ج. 21 ع. 4: 607–15. DOI:10.1111/ene.12350. PMID:24765663.
- ^ Khristich AN، Mirkin SM (مارس 2020). "On the wrong DNA track: Molecular mechanisms of repeat-mediated genome instability". J. Biol. Chem. ج. 295 ع. 13: 4134–4170. DOI:10.1074/jbc.REV119.007678. PMC:7105313. PMID:32060097.
- ^ Usdin K، House NC، Freudenreich CH (2015). "Repeat instability during DNA repair: Insights from model systems". Crit. Rev. Biochem. Mol. Biol. ج. 50 ع. 2: 142–67. DOI:10.3109/10409238.2014.999192. PMC:4454471. PMID:25608779.