|
تضامنًا مع حق الشعب الفلسطيني |
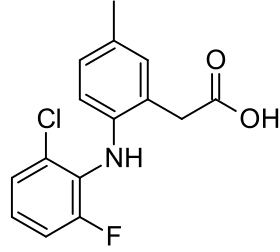
لوميراكوكسيب
| لوميراكوكسيب | |
|---|---|
| الاسم النظامي | |
| {2-[(2-chloro-6-fluorophenyl)amino]-5-methylphenyl} acetic acid |
|
| اعتبارات علاجية | |
| اسم تجاري | Prexige |
| ASHPDrugs.com | أسماء الدواء الدولية |
| فئة السلامة أثناء الحمل | C (أستراليا) |
| طرق إعطاء الدواء | Oral |
| بيانات دوائية | |
| توافر حيوي | 74-90%[1] |
| ربط بروتيني | >98%[1] |
| استقلاب (أيض) الدواء | Predominantly in the liver via تفاعلات أكسدة-اختزال and إضافة هيدروكسيل (CYP2C9)[1] |
| عمر النصف الحيوي | 5-8 hours[1] |
| إخراج (فسلجة) | Urine (54%) and faeces (43%)[1] |
| معرّفات | |
| CAS | 220991-20-8 |
| ك ع ت | M01M01AH06 AH06 |
| بوب كيم | CID 151166 |
| IUPHAR | 2897 |
| درغ بنك | DB01283 |
| كيم سبايدر | 133236 |
| المكون الفريد | V91T9204HU |
| كيوتو | D03714 |
| ChEBI | CHEBI:73044 |
| ChEMBL | CHEMBL404108 |
| بنك بيانات البروتين ligand ID | LUR (PDBe, RCSB PDB) |
| بيانات كيميائية | |
| الصيغة الكيميائية | C15H13ClFNO2 |
| الكتلة الجزيئية | 293.72 غرام/مول |
| تعديل مصدري - تعديل | |
لوميراكوكسيب (Lumiracoxib) (rINN) هو حمض كربوكسيلي مثبط انتقائي COX-2 ، صنع من قبل نوفارتيس ولا يزال يباع في عدد قليل من البلدان، بما في ذلك المكسيك، الإكوادور و جمهورية الدومينيكان، تحت الاسم التجاري 'Prexige' (يحرف في بعض الأحيان بأنه «برستيج» من قبل وسائل الإعلام).[1] مضادات الالتهاب اللاستيروئيدية، مثبط انتقائي لـCOXII، مسكن ألم.
التاريخ
إستهدفت الدراسة (T herapeutic Arthritis Research and Gastrointestinal Event Trial) التي أجريت على أكثر من 18,000 مريض ل اختبار سلامة الجهاز الهضمي والقلب والأوعية الدموية ضد نابروكسين وإيبوبروفين وكذلك دراسة كفاءتها ضد هذه المسكنات معا.
في نوفمبر 2006، تلقى Prexige الموافقة على التسويق لجميع دول الاتحاد الأوروبي من خلال إجراء شائع يسمى MRP. ومع ذلك، في أغسطس 2007، تم سحب Prexige من السوق في أستراليا بعد 8 أحداث سلبية خطيرة في الكبد، بما في ذلك 2 حالة وفاة و 2 عمليات زراعة كبد.[2] في 27 سبتمبر 2007، أصدرت إدارة الغذاء والدواء الأمريكية بريد إلكتروني لا يقبل الموافقة لللوميراكوكسيب، الذي يتطلب بيانات سلامة إضافية.[3] سحبت كندا Prexige (وافقت على الجرعة 100 & nbsp؛ ملجم فقط) في أكتوبر 2007.[4] حذت عدد من بلدان الاتحاد الأوروبي حذوها في نوفمبر 2007.[5]
الاستخدام الطبي
- التخفيف من آلام التهاب المفاصل.
- التهاب المفاصل الروماتويدي.
- الألم الحاد وعسر الطمث الأولي.
- ثبت أنه يكون فعال في حالات الألم الحاد مثل آلام الأسنان وآلام ما بعد الجراحة، بعد الجراحة العظمية.
الحركية الدوائية
- التوافر الحيوي جيد لدى الإعطاء الفموي.
- ويتم الوصول إلى تراكيز البلازما الأعظمي بعد ساعتين من تناوله عن طريق الفم.
- على الرغم من أن إطراحه قصيرة، العمر النصفي أربع ساعات من البلازما.
- ويتم توزيع الدواء في الجسم إلى الأنسجة الملتهبة ويتم الاحتفاظ به لمدة تصل إلى 24 ساعة.
- يتم استقلاب الدواء على نطاق واسع مع كمية صغيرة فقط تطرح في البول.
الجرعة
وُجد أنه يكون فعال في:
- جرعة من 100-400 ملغ مرة واحدة/يوم للألم المزمن.
- جرعة 400 ملغ/يوم للألم الحاد.
المشاركة الدوائية
يمكن إعطائه مع الوارفارين أو الاسبرين، ولا يلزم تعديل الجرعة.
المصادر
- ^ أ ب ت ث ج ح Shi، S؛ Klotz, U (مارس 2008). "Clinical use and pharmacological properties of selective COX-2 inhibitors". European Journal of Clinical Pharmacology. ج. 64 ع. 3: 233–52. DOI:10.1007/s00228-007-0400-7. PMID:17999057.
- ^ Urgent medicine recall - Lumiracoxib (PREXIGE)[وصلة مكسورة] نسخة محفوظة 27 يوليو 2011 على موقع واي باك مشين.
- ^ (PDF) https://web.archive.org/web/20120208072816/http://hugin.info/134323/R/1156327/223186.pdf. مؤرشف من الأصل (PDF) في 2012-02-08.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - ^ Withdrawal of Market Authorization for Prexige نسخة محفوظة 11 يناير 2013 على موقع واي باك مشين.
- ^ Media releases نسخة محفوظة 05 سبتمبر 2009 على موقع واي باك مشين.