|
تضامنًا مع حق الشعب الفلسطيني |
فورماميد
| فورماميد | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Methanamide |
|
| أسماء أخرى | |
أميد الميثان |
|
| المعرفات | |
| رقم CAS | 75-12-7 |
| بوب كيم (PubChem) | 713 |
| الخواص | |
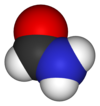
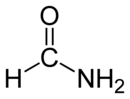
| الصيغة الجزيئية | CH3NO |
| الكتلة المولية | 45.04 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.13 غ/سم3 |
| نقطة الانصهار | 2 °س |
| نقطة الغليان | 210 °س |
| الذوبانية في الماء | يمتزج مع الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الفورماميد (ويعرف أيضاً باسم أميد الميثان) هو أميد حمض الفورميك، وهو بذلك أبسط أميدات الأحماض الكربوكسيلية. يكون الفورماميد في الشروط العادية من الضغط ودرجة الحرارة على شكل سائل عديم اللون، قابل للامتزاج مع الماء.
التحضير
كان الفورماميد يحضر في السابق من تفاعل حمص الفورميك مع الأمونياك ليشكل مركب فورمات الأمونيوم، والذي يعطي الفورماميد إبان التسخين:[1]
في وقت لاحق، كان الفورماميد يحصل عليه من التحلل الأميني لمركب فورمات الإيثيل، وحلّت بذلك كطريقة تحضبر بدل الطريقة السابقة.[2]
في الوقت الحالي، ينتج الفورماميد صناعياً من تفاعل أحادي أكسيد الكربون مع الأمونياك:[3][4]
أو بإجراء عملية التحلل الأميني لمركب فورمات الميثيل (الناتج من تفاعل أحادي أكسيد الكربون مع الميثانول):
الخصائص
إن الفورماميد عبارة عن سائل عديم اللون يمتزج مع الماء له رائحة خفيفة تشبه رائحة الأمونياك. عند التسخين إلى درجات حرارة تتجاوز 180 °س يبدأ الفورماميد بالتفكك إلى أحادي أكسيد الكربون وثنائي أكسيد الكربون والأمونياك.[5]
يعد الفورماميد مذيب للعديد من المركبات الأيونية.
الاستخدامات
يعد الفورماميد مادة أولية مهمة في الصناعة الكيميائية من أجل تصنيع عقاقير السلفا وغيرها من المستحضرات الدوائية، وفي مجال تحضير مبيدات الأعشاب ومبيدات الآفات.
يستخدم الفورماميد كمذيب للمواد الراتنجية وللملدنات.[3] كذلك الأمر مع رقائق البوليمرات الكهربائية الساكنة ذات التجميع الذاتي.[6]
المراجع
- ^ Lorin، M. (1864). "Preparation of Formamide by means of Formiates and Oxalates". The Chemical News and Journal of Physical Science. ج. IX: 291. مؤرشف من الأصل في 2020-04-20. اطلع عليه بتاريخ 2014-06-14.
- ^ Phelps، I.K.؛ Deming، C.D. (1908). "The Preparation of Formamide from Ethyl Formate and Ammonium Hydroxide". The Chemical News and Journal of Physical Science. ج. XCVII: 86–87. مؤرشف من الأصل في 2014-07-22. اطلع عليه بتاريخ 2014-06-14.
- ^ أ ب Hohn، A. (1999). "Formamide". في Kroschwitz، Jacqueline I. (المحرر). Kirk-Othmer Concise Encylclopedia of Chemical Technology (ط. 4th). New York: John Wiley & Sons, Inc. ص. 943–944. ISBN:978-0471419617.
- ^ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. ISBN 978-3-527-31540-6, S. 49.
- ^ F. Cataldo, E. Lilla, O. Usrini, G. Angelini: TGA-FT-IR Study of pyrolysis of poly(hydrogen cyanide) synthesized from thermal decomposition of formamide. Implications in cometary emissions. In: Journal of Analysis and Applied Pyrolysis. 87, 2010, S. 34–44, دُوِي:10.1016/j.jaap.2009.10.002.
- ^ Vimal K. Kamineni, Yuri M. Lvov, and Tabbetha A. Dobbins (2007). "Layer-by-Layer Nanoassembly of Polyelectrolytes Using Formamide as the Working Medium". Langmuir. ج. 23 ع. 14: 7423–7427. DOI:10.1021/la700465n. PMID:17536845.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
| في كومنز صور وملفات عن: فورماميد |
