|
تضامنًا مع حق الشعب الفلسطيني |
وتر (تشريح)
| وتر | |
|---|---|
| الاسم العلمي tendo |
|
وتر أخيل، أحد الأوتار في جسم الإنسان.
| |
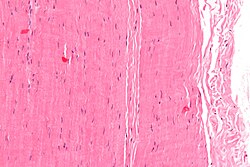 صورة مجهرية لقطعة من وتر. صبغة H&E.
| |
| تفاصيل | |
| دورلاند/إلزيفير | Tendon |
| تعديل مصدري - تعديل | |
الوتر (بالإنجليزية: Tendon) هو شريط متين من الأنسجة الضامة الليفية التي تربط عضلة معينة بجزء آخر من الجسم، عادة إلى عظم معين [1] (في حالات معينة يربط عضلة بعضلة أخرى)، ويمتاز الوتر بقدرته على تحمل الضغط. تتشابه الأوتار مع الأربطة والأسفقة من حيث مبناها. يقوم الوتر بنقل القوة الميكانيكية الناتجة عن تقلص العضلة إلى العظم، إذ يكون أحد أطراف الوتر متصلا بإحكام بألياف العضلة بينما يتصل الطرف الآخر بالعظم. تتركب الأوتار من أنسجة ضامة ليفية تتكون بالأساس من خلايا مغزلية الشكل تدعى الخلايا الليفية ومن ألياف كولاجينية. تلتصق الأوتار بالعظم بواسطة ألياف كولاجينية تستمر في مسندة العظم. وتعزى قوة الشد الكبيرة للأوتار إلى وفرة ألياف الكولاجين المعروفة بقوتها ومتانتها، وهي ضرورية لنقل وتحمل الشد الناتج من تقلص العضلة لآداء حركة.
التكوين
من ناحية علم الأنسجة، تتكون الأوتار من أحزمة منتظمة من نسيج ضام قوي مغطى بأغلفة من الأنسجة الضامة القوية غير المنتظمة. تتكون الأوتار الصحية الطبيعية في الغالب من مصفوفات متوازية من ألياف الكولاجين المكتظة بقرب بعضها البعض. تثبت على العظام بواسطة ألياف شاربي. تتكون الكتلة الجافة للأوتار الطبيعية، والتي تشكل حوالي 30٪ من كتلتها الكلية، من حوالي 86٪ كولاجين، و2٪ إيلاستين، وبروتيوجليكان 1-5٪، و 0.2٪ مكونات غير عضوية مثل النحاس والمنجنيز والكالسيوم.[2][3] يتكون جزء الكولاجين من 97-98٪ من النوع الأول من الكولاجين، مع كميات صغيرة من أنواع الكولاجين الأخرى. وتشمل هذه الأنواع: الكولاجين من النوع الثاني في المناطق الغضروفية، والكولاجين من النوع الثالث في ألياف الريتيكولين (بروتين في النسيج الضام) لجدران الأوعية الدموية، والكولاجين من النوع التاسع، والكولاجين من النوع الرابع في الأغشية القاعدية للشعيرات الدموية، والكولاجين من النوع الخامس في جدران الأوعية الدموية، والنوع العاشر من الكولاجين في الغضروف المُليف المحتوي على المعادن بالقرب من الواجهة مع العظام.[2][4]
تتجمع ألياف الكولاجين في مجاميع كبيرة. بعد إفرازها من الخلية، تتجمع الخلايا البروكولاجينية N- والبروتيناز C- ، وجزيئات التروبوكولاجين المتفسخة تلقائياً في ليفات غير قابلة للذوبان. يبلغ طول جزيء الكولاجين حوالي 300 نانومتر وعرضه 1–2 نانومتر، ويمكن أن يتراوح قطر الليفات المتكونة من 50-500 نانومتر. في الأوتار، تتجمع الليفات بعد ذلك لتكوين أحزمة، والتي يبلغ طولها حوالي 10 ملليمتر وقطرها 50-300 ميكرومتر، وأخيرا إلى ألياف وترية بقطر 100-500 ميكرومتر.[5] ترتبط الأحزمة بواسطة «باطنة الوتر»، وهو نسيج ضام رخو وحساس يحتوي على ليفات رقيقة من الكولاجين.[6] والألياف المرنة،[7][8] مجموعات من الحزم يحدها الإبيتينون. تملأ المادة الخلالية داخل اللفافة، حيث يوجد الوتر هو الباراتينون وهو نسيج هللي دهني.
يتماسك الكولاجين في الأوتار جنبا إلى جنب مع مكونات بروتيوجليكان مثل ديكورين، وفي المناطق المنضغطة من الأوتار، أجريكان، والتي تكون قادرة على الارتباط مع الألياف الكولاجينية في مواقع محددة.[9] تتشابك البروتينات البروتيوجلينية مع ليفات الكولاجين - سلاسل الجليكوسامينوجليكان الجانبية (GAG) لها العديد من التداخلات مع الألياف السطحية- مما يدل على أن البروتوجليكان له أهمية هيكلية في الترابط بين الألياف.[10] مكونات الجليكوسامينوجليكان (GAG) الرئيسية للأوتار هي كبريتات الدرماتان وكبريتات الكوندرويتين، التي ترتبط بالكولاجين وتدخل في عملية تركيب الليفات أثناء تطوير الأوتار. يُعتقد أن كبريتات الديرماتان مسؤولة عن تكوين الروابط بين الألياف، بينما يُعتقد أن كبريتات الكوندرويتين أكثر انخراطا في احتلال المساحة بين الليفات لإبقائها منفصلة والمساعدة في مقاومة التشوه الشكلي.[11] تتراكم السلاسل الجانبية من كبريتات الدرماتان للديكورين في السائل، وهذا السلوك يمكن أن يساعد في تجميع ليفات الكولاجين. عندما ترتبط جزيئات الديكورين بليفة كولاجين، قد تمتد سلاسل كبريتات الدرماتان وتلتصق بسلاسل كبريتات الدرماتان الأخرى في الديكورين المرتبط بليفات منفصلة، وبالتالي تنشأ جسور بين الليفات وتتسبب في النهاية في انتظام متوازي للألياف.[12]
تنتج الخلايا الوترية جزيئات الكولاجين، والتي تتراكم من طرف إلى طرف ومن جانب إلى جانب لإنتاج ألياف الكولاجين. تنتظم حزم اللييفات لتكوين الألياف مع خلايا وترية مستطيلة ممددة فيما بينها. توجد شبكة ثلاثية الأبعاد لعمليات الخلايا المرتبطة بالكولاجين في الوتر. تتواصل الخلايا مع بعضها البعض من خلال موصلات فجوية، ويعطيها هذا الإرسال للإشارات القدرة على اكتشاف الأحمال الميكانيكية والاستجابة لها.[13]
قد تظهر الأوعية الدموية داخل بطانة الوتر تجري متوازية مع ألياف الكولاجين، مع تشابكات عرضية متفرعة في بعض الأحيان.
يُعتقد أن الجزء الأكبر من الأوتار الداخلية لا يحتوي على ألياف عصبية، ولكن يحتوي كل من الإبيتينون والباراتينون على نهايات عصبية، في حين أن أعضاء جولجي الوترية تكون متواجدة عند التقاطع بين الوتر والعضلة.
يختلف طول الوتر في جميع المجموعات الرئيسية ومن شخص لآخر. طول الوتر، في الممارسة العملية، هو العامل الحاسم فيما يتعلق بحجم العضلات الفعلي والمحتمل. على سبيل المثال، عندما تكون جميع العوامل البيولوجية الأخرى ذات الصلة تكون متساوية، فإن رجلًا ذو أوتار أقصر وعضلة ذات رأسين أطول، سيكون لديه احتمالية أكبر لكتلة عضلية أكثر من الرجل ذي وتر أطول وعضلة أقصر. عموما سيمتلك لاعبي كمال الاجسام الناجحين أوتار أقصر. على النقيض، في الألعاب الرياضية التي تتطلب من الرياضيين التفوق في حركات مثل الجري أو القفز، سيكون من المفيد أن امتلاك وتر أخيل أطول من المتوسط وعضلة الساق أقصر.[14]
يتم تحديد طول الأوتار من خلال الاستعداد الوراثي، ولم يظهر أنها إما تزاداد أو تنقص كاستجابة للبيئة، على عكس العضلات، والتي يمكن أن تقصُر عن طريق الصدمات، واختلالات الاستخدام وعدم التعافي والتمدد.[15]
الوظائف

تقليديا، اعتبرت الأوتار آلية تتصل بها العضلات بالعظام وبالعضلات نفسها، وتعمل على نقل القوى. تسمح هذه الصلة للأوتار بضبط القوى سلبيا أثناء الحركة، مما يوفر ثباتًا إضافيًا بدون عمل نشط. على الرغم من ذلك، على مدى العقدين الماضيين، ركزت الكثير من الأبحاث على الخصائص المرنة لبعض الأوتار وقدرتها على العمل مثل الزنبركات. ليس مطلوبا من جميع الأوتار أن تؤدي نفس الدور الوظيفي، حيث أن بعض الأطراف تكون موضعية بالدرجة الأولى، مثل الأصابع عند الكتابة (الأوتار الموضعية) والبعض الآخر الذي يعمل كزنبركات لجعل الحركة أكثر كفاءة (الأوتار التي تخزن الطاقة).[16] يمكن للأوتارالمخزنة للطاقة تخزين واسترجاع الطاقة بكفاءة عالية. على سبيل المثال، خلال مشية الإنسان، يمتد وتر أخيل بينما ينثني مفصل الكاحل ظهرانيًا. خلال الجزء الأخير من الخطوة، حينما تنثني عوارض القدم (تشير أصابع القدم إلى الأسفل)، يتم إطلاق الطاقة المرنة المخزنة. وعلاوة على ذلك، ولأن الوتر يمتد، فإن العضلات تكون قادرة على العمل بأقل أو حتى بدون تغيير في الطول، مما يسمح للعضلة بتوليد قوة أكبر.
تعتمد الخواص الميكانيكية للوتر على قطر ألياف الكولاجين ومنحاها. تكون ليفات الكولاجين متوازية مع بعضها البعض ومتجمعة بشكل متقارب، ولكنها تظهر مظهرا يشبه الموجات بسبب التموجات السطحية، أو التجعيدات، على مقياس من عدة ميكرومترات.[17] في الأوتار، تمتلك ألياف الكولاجين بعض المرونة بسبب غياب رواسب الهيدروكسيبرولين والبرولين في مواقع محددة في تسلسل الحمض الأميني، مما يسمح بتكوين تعديلات أخرى مثل الانحناءات أو الحلقات الداخلية في اللولب الثلاثي ويتسبب في تطور تجعيدات.[18]تسمح التجعيدات في ليفات الكولاجين للأوتار بأن يكون لديها بعض المرونة وكذلك القليل من الصلابة الانضغاطية. بالإضافة إلى ذلك، ولأن الوتر عبارة عن بنية متعددة الجدْل متكون من العديد من اللفائف والحزم المستقلة جزئيًا، فإنه لا يتصرف كقصبة واحدة، وتساهم هذه الخاصية أيضًا في مرونته.[19]
مكونات البروتوجليكان في الأوتار مهمة أيضًا للخصائص الميكانيكية. بينما تسمح الليفات الكولاجينية للأوتار بمقاومة إجهاد الشد، فإن البروتيوجليكان يسمح لها بمقاومة الإجهاد الانضغاطي. هذه الجزيئات محبة جدا للماء، وهذا يعني أنها يمكن أن تمتص كمية كبيرة من الماء وبالتالي لديها نسبة تورم عالية. ولأنها مرتبطة بروابط غير تساهمية مع الألياف، فإنها يمكن أن ترتبط وتنفك بطريقة عكسية بحيث يمكن كسر الروابط بين الألياف وإعادة تكوينها. يمكن أن يكون لهذه العملية دورا في السماح للألياف بالاستطالة وتقليل القطر تحت التوتر.[20] ومع ذلك، قد يكون للبروتيوجليكان دورا أيضا في خصائص الشد في الأوتار. بنية الأوتار متجمعة من الألياف بشكل فعال، مبنية كسلسلة من المستويات الهرمية. في كل مستوى من مستويات التسلسل الهرمي، ترتبط وحدات الكولاجين معًا إما بروابط متشابكة من الكولاجين أو البروتيوجليكان، لإنشاء بنية عالية المقاومة لجهد الشد.[21]
أظهرت الاستطالة والشد في الألياف الليفية الكولاجينية وحدها أنها أقل بكثير من الاستطالة والشد الكلي للوتر الكامل تحت نفس القدر من الإجهاد، مما يدل على أن المصفوفة الغنية بالبروتوجليكان يجب أيضًا أن تتغير في الشكل وأنّ تصلب المصفوفة يحدث عند معدلات شد عالية.[22] يحدث هذا التغير الشكليفي المصفوفة غير الكولاجينية على جميع مستويات التسلسل الهرمي للوتر، ومن خلال تعديل انتظام وبنية هذه المصفوفة، يمكن تحقيق الخصائص الميكانيكية المختلفة التي تتطلبها الأوتار المختلفة.[23] من الظاهر أن الأوتار التي تخزن الطاقة تستخدم كميات كبيرة من الانزلاق بين الأحزمة لتمكينها من خصائص الشد العالية التي تحتاجها، بينما تعتمد الأوتار الموضعية بشكل أكبر على الانزلاق بين ألياف الكولاجين واللييفات.[24] مع ذلك، تقترح البيانات الحديثة أن الأوتار التي تخزن الطاقة قد تحتوي أيضًا على أحزمة ملتوية، أو حلزونية بطبيعتها - وهو ترتيب قد يكون مفيد للغاية في توفير السلوك الشبيه بالزنبرك المطلوب في هذه الأوتار.[25]
الميكانيكية
الأوتار هي هياكل لزجةـ مرنة، مما يعني أنها تُظهر على حد سواء سلوكيّ المرونة واللزوجة. عندما تتمدد، تظهر الأوتار سلوك نموذجي «كأنسجة لينة». يبدأ منحنى القوة والتمديد أو الإجهاد والشد بمنطقة تصلب منخفضة للغاية، مع استقامة بنية التجعيد واصطفاف ألياف الكولاجين مما يشير إلى نسبة «بواسون» سلبية في ألياف الوتر.[26] في الآونة الأخيرة، أظهرت الاختبارات التي أجريت داخل الجسم الحي (من خلال التصوير بالرنين المغناطيسي) وخارج الجسم الحي (من خلال الاختبار الميكانيكي لمختلف الأنسجة الوترية للجثث) أن الأوتار السليمة ذات تباين شديد وتظهر نسبة بواسون سلبية (مُنمّي الحجم) في بعض المستويات عندما تتمدد إلى 2% على مدى طولها، أي في النطاق الطبيعي لحركتها.[27] بعد منطقة «إصبع القدم» هذه، تصبح البنية أكثر صلابة بشكل ملحوظ، وتمتلك منحنى إجهاد وشد خطي حتى تبدأ في الانهيار. تختلف الخواص الميكانيكية للأوتار اختلافًا كبيرًا، بحيث تتطابق مع المتطلبات الوظيفية للأوتار. تميل أوتار تخزين الطاقة إلى أن تكون أكثر مرونة أو أقل صلابة، بحيث يمكنها تخزين الطاقة بسهولة أكبر، بينما تميل الأوتار الموضعية الأكثر صلابة إلى أن تكون أكثر لزوجة ـ مرونة، وأقل مرونة، حتى يمكنها توفير تحكم أكثر دقة للحركة. سينهار الوتر النموذجي لتخزين الطاقة عند حوالي 12-15٪ من الشد، ويحدث إجهاد في المنطقة من 100 إلى 150 ميجا باسكال، على الرغم من أن بعض الأوتار تكون لديها قابلية للتوسع بشكل ملحوظ أكثر من ذلك، على سبيل المثال العضلة المثنية السطحية للأصابع في الحصان، والتي تتمدد بنسبة زيادة 20 ٪ عند الركض.[28] يمكن للأوتار الموضعية أن تنهار عند شد منخفض يصل إلى 6-8 ٪، ولكن يمكن أن يكون لها معاملات في المنطقة من 700-1000ميجا باسكال.[29]
أظهرت العديد من الدراسات أن الأوتار تستجيب للتغيرات في التحميل الميكانيكي بعمليات من النمو وإعادة التشكيل، مشابهة كثيرا للعظام. على وجه الخصوص، أظهرت إحدى الدراسات أن عدم استخدام وتر أخيل في الفئران أدى إلى نقص في متوسط سماكة حزم ألياف الكولاجين المكونة للأوتار.[30] في البشر، وجدت التجربة التي خضع فيها الناس لبيئة محاكية للجاذبية الدقيقة أن صلابة الأوتار انخفضت بشكل كبير، حتى عندما طُلِب من الأفراد الخاضعين للتجرية القيام بتمارين الارتداد.[31] هذه الآثار لها مقتضيات في مجالات تتراوح بين علاج المرضى طريحي الفراش إلى تصميم تمارين أكثر فعالية لرواد الفضاء.
الشفاء
الأوتار الموجودة في القدم معقدة للغاية ومتشابكة. لذلك تكون عملية شفاء وتر مكسور طويلة ومؤلمة. معظم الأشخاص الذين لا يتلقون رعاية طبية خلال أول 48 ساعة من الإصابة سيعانون من تورم شديد وألم وإحساس بالحرقة في مكان حدوث الإصابة.
كان يعتقد أن الأوتار لا يمكنها أن تخضع لعملية دوران المصفوفة وأن الخلايا الوترية غير قادرة على الإصلاح. ومع ذلك، فقد تبين منذ ذلك الحين أنه على مدى عمر الإنسان، يمكن أن تقوم الخلايا الوترية الموجودة في الوتر بتصنيع مكونات المصفوفة بشكل فعال وكذلك الإنزيمات مثل ميتالوبروتياز المادة الخلالية يمكنه أن يؤدي إلى عيوب بالمصفوفة.[32] الأوتار قادرة على الشفاء والتعافي من الإصابات في عملية تتحكم بها الخلايا الوترية والمصفوفة المحيطة بها خارج الخلايا.
المراحل الثلاث الرئيسية لشفاء الأوتار هي الالتهاب، والإصلاح أو التزايد، وإعادة التشكيل، والتي يمكن تقسيمها بعد ذلك إلى اندماج ونضج. هذه المراحل يمكن أن تتداخل مع بعضها البعض. في المرحلة الأولى، يتم تعيين الخلايا الالتهابية مثل الخلايا المتعادلة في موقع الإصابة، إلى جانب كريات الدم الحمراء. بينما يتم تعيين الخلايا الأحادية وخلايا البلعمة خلال أول 24 ساعة، وتحدث بلعمة المواد الميتة في موقع الإصابة. بعد إفراز العوامل الفعالة في الأوعية ومواد الانجذاب الكيميائي، يبدأ تكوين الأوعية الدموية وتتزايد الخلايا الوترية. تنتقل بعد ذلك الخلايا الوترية إلى الموقع وتبدأ في تصنيع الكولاجين III.[33][34] [35] بعد بضعة أيام، تبدأ مرحلة الإصلاح أو التزايد. في هذه المرحلة ، تدخل الخلايا الوترية في عملية تصنيع كميات كبيرة من الكولاجين والبروتيوجليكان في موقع الإصابة، وتكون مستويات الجليكوسامينوجليكان (GAG) والماء مرتفعة. بعد حوالي ستة أسابيع ، تبدأ مرحلة إعادة البناء. الجزء الأول من هذه المرحلة هو الاندماج، والذي يستمر من حوالي ستة إلى عشرة أسابيع بعد الإصابة. خلال هذا الوقت، يتم تقليل تخليق الكولاجين والجليكوسامينوجليكان، وتنخفض كذلك الخلوية لأن النسيج يصبح أكثر ليفية نتيجة لزيادة إنتاج الكولاجين I، وتصطف اللييفات في اتجاه الإجهاد الميكانيكي.[34] تحدث مرحلة النضج الأخيرة بعد عشرة أسابيع، وخلال هذه الفترة تكون هناك زيادة في تشابك الألياف الكولاجينية، مما يجعل الأنسجة أكثر صلابة. تدريجيا، وعلى مدى عام واحد، سوف تتحول الأنسجة من ليفية إلى شبيهة بالندوب.[35]
يلعب ميتالوبروتياز المادة الخلالية دوراً هاماً للغاية في الانحلال وإعادة تشكيل الـمصفوفة المحيطة بالخلايا خلال عملية الشفاء بعد إصابة الأوتار. بعض ميتالوبروتياز المادة الخلالية (MMPs) بما في ذلك MMP-1، و MMP-2، و MMP-8، و MMP-13، و MMP-14 لها نشاط كولاجيناز، مما يعني أنه، على عكس العديد من الإنزيمات الأخرى، تكون قادرة على تكسير ليفات الكولاجين. يعتبر تحلل ليفات الكولاجين بواسطة MMP-1 مع وجود الكولاجين المتمسّخ من العوامل التي يُعتقد أنها تسبب ضعف الـمصفوفة المحيطة بالخلايا في الوتر وزيادة احتمال حدوث تمزق آخر.[36] كرد فعل للتحميل الميكانيكي المتكرر أو الإصابة، قد يتم إفراز السيتوكينات بواسطة الخلايا الوترية ويمكن أن تحفز إفراز ميتالوبروتياز المادة الخلالية، مما يتسبب في انحلال المصفوفة المحيطة بالخلايا ويؤدي إلى تكرار الإصابة وأمراض الأوتار المزمنة.[34]
تشارك العديد من الجزيئات الأخرى في إصلاح وإعادة بناء الأوتار. هناك خمسة عوامل نمو أظهرت ارتفاعا ونشاطا خلال عملية شفاء الأوتار: عامل النمو الشبيه بالأنسولين 1 (IGF-I)، وعامل النمو المشتق من الصفيحات (PDGF)، وعامل نمو بطانة الأوعية الدموية (VEGF)، وعامل نمو الأرومة الليفية الأساسية (bFGF)، وعامل النمو المحول بيتا (TGF-β). عوامل النمو هذه جميعا لها أدوار مختلفة أثناء عملية الشفاء. يزيد عامل النمو الشبيه بالانسولين (IGF-1) من إنتاج الكولاجين والبروتيوجليكان خلال المرحلة الأولى من الالتهاب، وعامل النمو المشتق من الصفيحات (PDGF) موجود أيضًا في المراحل المبكرة بعد الإصابة ويعزز تصنيع عوامل النمو الأخرى جنبًا إلى جنب مع تخليق الحمض النووي وزيادة خلايا الأوتار. [35] من المعروف أن الأشكال الإسوية الثلاثة من عامل النمو المحول بيتا (TGF-β1 ، TGF-β2، TGF-β3) تلعب دورًا في التئام الجروح وتشكيل الندبة.[37][38] ومن المعروف أيضا أن عامل نمو بطانة الأوعية الدموية يقوم بتعزيز نمو الأوعية الدموية والحث على تكاثر الخلايا البطانية والهجرة، وقد تبين أن رنا عامل نمو باطنة الأوعية الدموية الرسول يكشف عن نفسه في موقع إصابات الأوتار مع رنا الكولاجين الرسول. بروتينات العظام التخلقية (BMPs) هي مجموعة فرعية من فصيلة عامل النمو المحول التي يمكن أن تحفز تكوين العظام والغضروف بالإضافة إلى تمايز الأنسجة، وأظهرت BMP-12 على وجه التحديد تأثيرا في تكوين وتمايز نسيج الأوتار وتعزيز التكوُّن الليفي.
تأثير النشاط على التعافي
في النماذج الحيوانية ، أجريت دراسات مكثفة للتحقيق في آثار الإجهاد الميكانيكي في شكل مستوى النشاط على إصابات الأوتار والشفاء منها. في حين يمكن للتمدد أن يعيق الشفاء خلال المرحلة الالتهابية الأولية، فقد تبين أن الحركة المتحكم بها للأوتار بعد حوالي أسبوع من الإصابة الحادة يمكن أن تساعد في تعزيز تصنيع الكولاجين بواسطة الخلايا الوترية، مما يؤدي إلى زيادة قوة الشد وقطر الأوتار الملتئمة وعدد أقل من الالتصاقات منها في الأوتار التي تمنع عن الحركة. في إصابات الأوتار المزمنة، أظهر التحميل الميكانيكي أيضًا تحفيز لتزايد الخلايا الليفية وإعادة اصطفاف الكولاجين، وكل ذلك يعزز الإصلاح وإعادة البناء.[35] لزيادة تدعيم النظرية القائلة بأن الحركة والنشاط يساعدان في شفاء الأوتار، فقد ظهر أن عدم حركة الأوتار بعد الإصابة غالبا ما يكون له تأثير سلبي على الشفاء. في الأرانب ، أظهرت حزم الكولاجين التي منعت من الحركة أنها عانت من نقص قوة الشد، كما يؤدي عدم الحركة إلى انخفاض كميات الماء والبروتيوجليكان وتجميعات الكولاجين في الأوتار.[33]
تم افتراض العديد من آليات النقل الميكانيكي كأسباب لاستجابة الخلايا الوترية إلى القوة الميكانيكية التي تمكنها من تغيير تعبيرها الجيني، تخليق البروتين، والنمط الظاهري للخلية، وتسبب في النهاية تغيرات في بنية الأوتار. يعد كعامل رئيسي التشوه الميكانيكي للمصفوفة خارج الخلايا، والتي يمكنها أن تؤثر على الهيكل الخلوي للأكتين، وبالتالي تؤثر على شكل الخلية، والحركة، والوظيفة. يمكن للقوى الميكانيكية أن تنتقل عن طريق مواقع التصاق موضعية، وإنتجرينات، وتقاطعات الخلايا الخلوية. يمكن للتغيرات في الهيكل الخلوي الأكتيني أن تنشط الانتجرينات، التي تتوسط الإشارات «الخارج إلى الداخل» و «الداخل إلى الخارج» بين الخلية والمصفوفة. يمكن أن تكون بروتينات G، التي تحرض سلاسل الإشارات داخل الخلايا مهمة أيضًا، ويتم تنشيط القنوات الأيونية من خلال التمدد للسماح للأيونات مثل الكالسيوم والصوديوم والبوتاسيوم بالدخول إلى الخلية.[35]
المجتمع والثقافة
كانت الأوتار (الدعامة) تستخدم على نطاق واسع عبر العصور ما قبل الصناعية باعتبارها ألياف متينة ودائمة. تضمنت بعض الاستخدامات المحددة كاستخدام الوتر كمؤشر للخياطة، وإرفاق الريش بالسهام (قذة)، أداة ربط النصال بالرماح، إلخ. كما أنها تفضل كوسائل للبقاء على قيد الحياة كأداة يمكن من خلالها صنع حبال قوية لعناصر مثل المصائد أو الهياكل الحية. يجب معاملة الأوتار بطرق محددة لتؤدي هذه الأغراض بشكل مفيد. استخدم شعب الإنويت وغيره من الناس في المناطق القطبية الأوتار كحبال وحيدة لجميع الأغراض المنزلية بسبب نقص مصادر الألياف المناسبة الأخرى في بيئتهم السكنية. كما تم استخدام خصائص المرونة الخاصة بأوتار معينة في الأقواس المتعرجة المركبة التي يفضلها البدو الرحل في أوراسيا. استخدمت المدفعية الأولى لإطلاق الحجارة أيضًا الخصائص المرنة للوتر.
يقدم الوتر مادة ممتازة لحبال السفن لثلاثة أسباب: كونه قوي للغاية، ويحتوي على مواد لاصقة طبيعية، وينكمش عند تجفيفه، مما يلغي الحاجة إلى عقده.
استخدامات مطبخية
يتم استخدام الوتر (على وجه الخصوص، وتر لحم البقر) كطعام في بعض المأكولات الآسيوية. إحدى الأطباق الشهيرة هو (سوان باو نيو جين)، الذي ينقع فيه الوتر في الثوم. كما يتواجد أحيانًا في طبق المعكرونة الفيتنامية.
أهمية إكلينكية
الإصابة
تتعرض الأوتار للعديد من أنواع الإصابات. هناك أشكال مختلفة من اعتلال الأوتار أو إصابات الأوتار بسبب فرط الاستخدام. تؤدي هذه الأنواع من الإصابات بصفة عامة إلى التهاب والتدهور أو إضعاف الأوتار، مما قد يؤدي في النهاية إلى تمزق الأوتار.[33] يمكن أن تنتج اعتلالات الوتر عن العديد من العوامل المتعلقة بمصفوفة الأوتار خارج الخلية، كان من الصعب تصنيفها لأن أعراضها وصفات المرض النسيجي لها متشابهة في الغالب.
الفئة الأولى من اعتلال الأوتار هي التهاب الباراتينون ، والذي يشير إلى التهاب في الباراتينون، أو في رقيقة جانبي الوتر التي تقع بين الوتر وغلافه. يشير اعتلال الوتر إلى الإصابة غير الالتهابية للأوتار على المستوى الخلوي. يحدث التدهور بسبب تلف الكولاجين، والخلايا، ومكونات الأوعية الدموية في الوتر، ومن المعروف أنه يؤدي إلى تمزق.[39] أظهرت الملاحظات على الأوتار التي تعرضت للتمزق التلقائي وجود ليفات كولاجينية ليست في الاتجاه المتوازي الصحيح أو غير منتظمة في الطول أو القطر، جنبا إلى جنب مع الخلايا الوترية المستديرة، وتشوهات أخرى في الخلايا ، والنمو الداخلي للأوعية الدموية. [33] أظهرت الأشكال الأخرى من اعتلال الوتر التي لم تؤد إلى تمزق، اضمحلال واضطراب في الاتجاه وترقق ألياف الكولاجين، بالإضافة إلى زيادة في كمية الجلايكوزامينوجليكان بين الألياف.[34]والثالث هو التهاب الباراتينون مع اعتلال الوتر ، حيث توجد مجموعات من التهاب الباراتينون واضمحلال الأوتار معا. والأخير هو التهاب الأوتار، والذي يشير إلى اضمحلال مع التهاب الأوتار وكذلك اختلال الأوعية الدموية.[2]
قد يحدث اعتلال الأوتار نتيجة العديد من العوامل الداخلية بما في ذلك العمر ووزن الجسم والتغذية. غالبًا ما ترتبط العوامل الخارجية بالرياضة وتشمل القوى المفرطة أو التحميل، وتقنيات التدريب السيئة والظروف البيئية.[32]
في الحيوانات الأخرى
في بعض الكائنات الحية، أبرزها الطيور [40]والديناصورات طيريات الحوض [41] ، يمكن أن تكون أجزاء من الوتر متصلبة. في هذه العملية، تترسب الخلايا العظمية في الوتر وتضع العظم كما تفعل في العظم السمسماني (عظم صغير) مثل الرضفة. في الطيور، يحدث تصلب الأوتار في المقام الأول في الأطراف الخلفية، بينما في الديناصورات طيريات الحوض، تشكل الأوتار العضلية المحورية المتصلبة نسيج شبكي على طول العمود الفقري العصبي والدموي على الذيل، من أجل التدعيم المفترض.
انظر أيضًا
مراجع
- ^ eMedicine/Stedman Medical Dictionary Lookup![وصلة مكسورة] نسخة محفوظة 13 أكتوبر 2020 على موقع واي باك مشين.
- ^ أ ب ت Jozsa, L., and Kannus, P., Human Tendons: Anatomy, Physiology, and Pathology. Human Kinetics: Champaign, IL, 1997.
- ^ Lin, T. W.؛ Cardenas, L.؛ Soslowsky, L. J. (2004). "Biomechanics of tendon injury and repair". Journal of Biomechanics. ج. 37 ع. 6: 865–877. DOI:10.1016/j.jbiomech.2003.11.005. PMID:15111074.
- ^ Fukuta, S.؛ Oyama, M.؛ Kavalkovich, K.؛ Fu, F. H.؛ Niyibizi, C. (1998). "Identification of types II, IX and X collagens at the insertion site of the bovine achilles tendon". Matrix Biology. ج. 17 ع. 1: 65–73. DOI:10.1016/S0945-053X(98)90125-1. PMID:9628253.
- ^ Fratzl, P. (2009). "Cellulose and collagen: from fibres to tissues". Current Opinion in Colloid & Interface Science. ج. 8 ع. 1: 32–39. DOI:10.1016/S1359-0294(03)00011-6.
- ^ Grant, T. M.؛ Thompson, M. S.؛ Urban, J.؛ Yu, J. (2013). "Elastic fibres are broadly distributed in tendon and highly localized around tenocytes". Journal of Anatomy. ج. 222 ع. 6: 573–579. DOI:10.1111/joa.12048. PMC:3666236. PMID:23587025.
- ^ Dorlands Medical Dictionary, page 602
- ^ Caldini, E. G.؛ Caldini, N.؛ De-Pasquale, V.؛ Strocchi, R.؛ Guizzardi, S.؛ Ruggeri, A.؛ Montes, G. S. (1990). "Distribution of elastic system fibres in the rat tail tendon and its associated sheaths". Cells Tissues Organs. ج. 139 ع. 4: 341–348. DOI:10.1159/000147022. PMID:1706129.
- ^ Zhang, G. E., Y.؛ Chervoneva, I.؛ Robinson, P. S.؛ Beason, D. P.؛ Carine, E. T.؛ Soslowsky, L. J.؛ Iozzo, R. V.؛ Birk, D. E. (2006). "Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development". Journal of Cellular Biochemistry. ج. 98 ع. 6: 1436–1449. DOI:10.1002/jcb.20776. PMID:16518859.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Raspanti, M.؛ Congiu, T.؛ Guizzardi, S. (2002). "Structural Aspects of the Extracellular Matrix of the Tendon : An Atomic Force and Scanning Electron Microscopy Study". Archives of Histology and Cytology. ج. 65 ع. 1: 37–43. DOI:10.1679/aohc.65.37. PMID:12002609.
- ^ Scott, J. E. O., C. R.; Hughes, E. W., (1981). "Proteoglycan-collagen arrangements in developing rat tail tendon. An electron microscopical and biochemical investigation". Biochemical Journal. ج. 195 ع. 3: 573–581. PMC:1162928. PMID:6459082.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|lastauthoramp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Scott, J. E., (2003). "Elasticity in extracellular matrix 'shape modules' of tendon, cartilage, etc. A sliding proteoglycan-filament model". Journal of Physiology. ج. 553 ع. 2: 335–343. DOI:10.1113/jphysiol.2003.050179. PMC:2343561. PMID:12923209.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ McNeilly, C. M.؛ Banes, A. J.؛ Benjamin, M.؛ Ralphs, J. R. (1996). "Tendon cells in vivo form a three dimensional network of cell processes linked by gap junctions". Journal of Anatomy. ج. 189 ع. Pt 3: 593–600. PMC:1167702. PMID:8982835.
- ^ "Having a short Achilles tendon may be an athlete's Achilles heel". مؤرشف من الأصل في 2017-10-26. اطلع عليه بتاريخ 2007-10-26.
- ^ Young، Michael. "A Review on Postural Realignment and its Muscular and Neural Components" (PDF). مؤرشف من الأصل (PDF) في 2019-04-06.
- ^ Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). The role of the non-collagenous matrix in tendon function. Int J ExpPathol. 94;4: 248-59.
- ^ Hulmes, D. J. S., (2002). "Building Collagen Molecules, Fibrils, and Suprafibrillar Structures". Journal of Structural Biology. ج. 137 ع. 1–2: 2–10. DOI:10.1006/jsbi.2002.4450. PMID:12064927.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Silver, F. H.؛ Freeman, J. W.؛ Seehra, G. P. (2003). "Collagen self-assembly and the development of tendon mechanical properties". Journal of Biomechanics. ج. 36 ع. 10: 1529–1553. DOI:10.1016/S0021-9290(03)00135-0. PMID:14499302.
- ^ Ker, R. F., (2002). "The implications of the adaptable fatigue quality of tendons for their construction, repair and function". Comparative Biochemistry and Physiology A. ج. 133 ع. 4: 987–1000. DOI:10.1016/S1095-6433(02)00171-X. PMID:12485688.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Cribb, A. M.; Scott, J.E. (1995). In Tendon response to tensile-stress - an ultrastructural investigation of collagen - proteoglycan interactions in stressed tendon,1995; Cambridge Univ Press.pp 423-428.
- ^ Screen H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). "An investigation into the effects of the hierarchical structure of tendon fascicles on micromechanical properties". Proc Inst Mech Eng H. ج. 218: 109–119.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Puxkandl, R.؛ Zizak, I.؛ Paris, O.؛ Keckes, J.؛ Tesch, W.؛ Bernstorff, S.؛ Purslow, P.؛ Fratzl, P. (2002). "Viscoelastic properties of collagen: synchrotron radiation investigations and structural model". Philosophical Transactions of the Royal Society B. ج. 357 ع. 1418: 191–197. DOI:10.1098/rstb.2001.1033. PMC:1692933. PMID:11911776.
- ^ Gupta H.S., Seto J., Krauss S., Boesecke P.& Screen H.R.C. (2010). In situ multi-level analysis of viscoelastic deformation mechanisms in tendon collagen. J. Struct. Biol. 169(2):183-191.
- ^ Thorpe C.T؛ Udeze C.P؛ Birch H.L.؛ Clegg P.D.؛ Screen H.R.C. (2012). "Specialisation of tendon mechanical properties results from inter-fascicular differences". J Roy Soc Int. ج. 76: 3108–3117.
- ^ Thorpe C.T.؛ Klemt C؛ Riley G.P.؛ Birch H.L.؛ Clegg P.D.؛ Screen H.R.C. (2013). "Helical sub-structures in energy-storing tendons provide a possible mechanism for efficient energy storage and return". Acta Biomater. ج. 8: 7948–56.
- ^ Herchenhan، Andreas؛ Kalson، Nicholas S.؛ Holmes، David F.؛ Hill، Patrick؛ Kadler، Karl E.؛ Margetts، Lee (7 يوليو 2011). "Tenocyte contraction induces crimp formation in tendon-like tissue". Biomechanics and Modeling in Mechanobiology. ج. 11 ع. 3–4: 449–459. DOI:10.1007/s10237-011-0324-0. ISSN:1617-7959. PMC:3822867. PMID:21735243. مؤرشف من الأصل في 2018-08-02.
- ^ Gatt R، Vella Wood M، Gatt A، Zarb F، Formosa C، Azzopardi KM، Casha A، Agius TP، Schembri-Wismayer P، Attard L، Chockalingam N، Grima JN (2015). "Negative Poisson's ratios in tendons: An unexpected mechanical response". Acta Biomater. ج. 24: 201–208. DOI:10.1016/j.actbio.2015.06.018.
- ^ Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). Equine Vet J. |volume=35 |issue=3 |pages=314-8. Are the material properties and matrix composition of equine flexor and extensor tendons determined by their functions?
- ^ ScreenH.R.C., Tanner, K.E. (2012). Structure & Biomechanics of Biological Composites. In: Encyclopaedia of Composites 2nd Ed. Nicolais & Borzacchiello.Pub. John Wiley & Sons, Inc. (ردمك 978-0-470-12828-2) (pages 2928-39)
- ^ Nakagawa، Y. (1989). "Effect of disuse on the ultra structure of the Achilles tendon in rats". European Journal of Applied Physiology. ج. 59: 239–242. DOI:10.1007/bf02386194.
- ^ Reeves، N. D. (2005). "Influence of 90-day simulated micro-gravity on human tendon mechanical properties and the effect of restiveness countermeasures". Applied Physiology. ج. 98 ع. 6: 2278–2286. DOI:10.1152/japplphysiol.01266.2004. PMID:15705722.
- ^ أ ب Riley، G. (2004). "The pathogenesis of tendinopathy. A molecular perspective". Rheumatology. ج. 43 ع. 2: 131–142. DOI:10.1093/rheumatology/keg448. PMID:12867575.
- ^ أ ب ت ث Sharma, P. M., N., (2006). "Biology of tendon injury: healing, modeling and remodeling". Journal of Musculoskeletal and Neuronal Interactions. ج. 6 ع. 2: 181–190. PMID:16849830.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ أ ب ت ث Sharma, P.؛ Maffulli, N. (2005). "Tendon injury and tendinopathy: Healing and repair". Journal of Bone and Joint Surgery. American Volume. ج. 87A ع. 1: 187–202. DOI:10.2106/JBJS.D.01850. PMID:15634833.
- ^ أ ب ت ث ج Wang, J. H. C., (2006). "Mechanobiology of tendon". Journal of Biomechanics. ج. 39 ع. 9: 1563–1582. DOI:10.1016/j.jbiomech.2005.05.011. PMID:16000201.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Riley, G. P.؛ Curry, V.؛ DeGroot, J.؛ van El, B.؛ Verzijl, N.؛ Hazleman, B. L.؛ Bank, R. A. (2002). "Matrix metalloproteinase activities and their relationship with collagen remodelling in tendon pathology". Matrix Biology. ج. 21 ع. 2: 185–195. DOI:10.1016/S0945-053X(01)00196-2. PMID:11852234.
- ^ Moulin, V.؛ Tam, B. Y. Y.؛ Castilloux, G.؛ Auger, F. A.؛ O'Connor-McCourt, M. D.؛ Philip, A.؛ Germain, L. (2001). "Fetal and adult human skin fibroblasts display intrinsic differences in contractile capacity". Journal of Cellular Physiology. ج. 188 ع. 2: 211–222. DOI:10.1002/jcp.1110. PMID:11424088.
- ^ Boyer, M. I. W., J. T.; Lou, J.; Manske, P. R.; Gelberman, R. H.; Cai, S. R., (2001). "Quantitative variation in vascular endothelial growth factor mRNA expression during early flexor tendon healing: an investigation in a canine model". Journal of Orthopaedic Research. ج. 19 ع. 5: 869–872. DOI:10.1016/S0736-0266(01)00017-1. PMID:11562135.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|lastauthoramp=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Astrom, M.؛ Rausing, A. (1995). "Chronic Achilles Tendinopathy - A survey of Surgical and Histopathologic findings". Clinical Orthopaedics and Related Research. ج. 316 ع. 316: 151–164. DOI:10.1097/00003086-199507000-00021. PMID:7634699.
- ^ Berge، James C. Vanden؛ Storer، Robert W. (1995). "Intratendinous ossification in birds: A review". Journal of Morphology. ج. 226: 47–77. DOI:10.1002/jmor.1052260105.
- ^ Organ، Chris L. (2006). "Biomechanics of ossified tendons in ornithopod dinosaurs". Paleobiology. ج. 32 ع. 4: 652–665. DOI:10.1666/05039.1.
| في كومنز صور وملفات عن: وتر |
