|
تضامنًا مع حق الشعب الفلسطيني |
عضلة القلب
| عضلة القلب | |
|---|---|
| تفاصيل | |
| تعديل مصدري - تعديل |
عضلة القلب[1] (بالإنجليزية: Heart muscle) أو (Myocardium) هي واحدة من ثلاثة أنواع من عضلات الفقاريات، مع اثنين آخرين وهما العضلات الهيكلية والعضلات الملساء. العضلة لا إرادية مخططة وتشكل النسيج الرئيسي لجدران القلب. تشكل عضلة القلب طبقة وسطية سميكة بين الطبقة الخارجية لجدار القلب (التامور) والطبقة الداخلية (الشغاف)، مع توفير الدم عبر الدورة الدموية التاجية. وهي تتألف من خلايا القلب العضلية الفردية (خلايا القلب العضلية) المرتبطة ببعضها عن طريق أقراص مقحمة، مغلفة بألياف الكولاجين وغيرها من المواد التي تشكل النسيج البيني خارج الخلية.
تنقبض عضلة القلب بطريقة مماثلة للعضلة الهيكلية، على الرغم من بعض الاختلافات الهامة. يؤدي التحفيز الكهربائي في شكل جهد فعل قلبي إلى إطلاق الكالسيوم من مخزن الكالسيوم الداخلي للخلية (الشبكة الهيولية العضلية). يؤدي ارتفاع الكالسيوم إلى انزلاق الخيوط العضلية للخلية عبر بعضها البعض في عملية تسمى انقباض عضلي.
أمراض عضلة القلب هي ذات أهمية كبيرة. وتشمل هذه الحالات التي تتسبب في تقييد جريان الدم في العضلات الذبحة الصدرية والنوبة القلبية، وأمراض عضلة القلب الأخرى المعروفة باسم اعتلال عضلة القلب.
بناء
تشريح وصفي
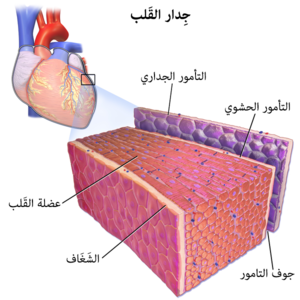
تشكل عضلة القلب الجزء الأكبر من القلب. جدار القلب هو بنية ثلاثية الطبقات بطبقة سميكة من عضلة القلب تقع بين الشغاف الداخلي والتامور الخارجي (المعروف أيضًا باسم التامور الحشوي). يبطِّن الشغاف الداخلي غرف القلب، ويغطي الصمامات القلبية، ويتصل بالبطانة الغشائية التي تبطن الأوعية الدموية التي تتصل بالقلب. على الجانب الخارجي من عضلة القلب، يوجد غشاء النخاب الذي يشكل جزءًا من التامور، الكيس الذي يحيط ويحمي ويشحم القلب. [2] داخل عضلة القلب هناك صفائح عديدة من خلايا عضلة القلب. يتم توجيه صفائح العضلات التي تلتف حول البطين الأيسر الأقرب إلى الشغاف بشكل عمودي إلى الأقرب من الغشاء. عندما تنقبض هذه الصفائح بطريقة منسقة، فإنها تسمح للبطين بالضغط في عدة اتجاهات في وقت واحد - طولياً (يصبح أقصر من القمة إلى القاعدة)، قطريًا (يصبح أضيق من جانب إلى آخر)، مع حركة التوائية (تشبه حركة عصر قطعة قماش مبللة) للضغط على أقصى كمية من الدم خارج القلب مع كل نبضة قلب. [3]
يستهلك انقباض عضلة القلب الكثير من الطاقة، وبالتالي يتطلب تدفق مستمر للدم لتوفير الأكسجين والمواد المغذية. يصل الدم إلى عضلة القلب عن طريق الشرايين التاجية. تنشأ هذه من تفرعات الأبهر وتقع على السطح الخارجي أو النخابي للقلب. يتم بعد ذلك صرف الدم عن طريق الأوردة التاجية إلى الأذين الأيمن. [2]
علم الأنسجة
عندما ينظر إليها تحت المجهر، تشبه عضلة القلب شكل جدار المنزل. يبني معظم الجدار بالطوب، وهم الخلايا العضلية القلبية الفردية في عضلة القلب. يُعرف الملاط الذي يحيط بالطوب باسم النسيج البيني خارج الخلية، الذي ينتجه خلايا داعمة تُعرف باسم الخلايا الليفية اليافعة. بنفس الطريقة التي تحتوي بها جدران المنزل على أسلاك كهربائية وسباكة، تحتوي عضلة القلب أيضًا على خلايا متخصصة لتوصيل الإشارات الكهربائية بسرعة (نظام التوصيل القلبي)، والأوعية الدموية لجلب العناصر الغذائية إلى خلايا العضلات والتخلص من النفايات (الشرايين التاجية والأوردة والشعيرات الدموية). [4]

خلايا عضلة القلب
خلايا عضلة القلب هي الخلايا المنقبضة التي تسمح للقلب بالضخ. تحتاج كل خلية عضلية قلبية إلى الانقباض بالتنسيق مع الخلايا المجاورة لها للعمل على ضخ الدم بكفاءة من القلب، وإذا تعطل هذا التنسيق - على الرغم من انقباض الخلايا الفردية - قد لا يضخ القلب على الإطلاق، مثل ما قد يحدث أثناء ضربات القلب غير المنتظمة كالرجفان البطيني. [5]
تحت المجهر، تكون خلايا عضلة القلب مستطيلة تقريبًا، حيث يتراوح حجمها بين 100 و 150 ميكرون في 30-40 ميكرون. [6] تضم خلايا عضلة القلب الفردية معًا عند نهاياتها بواسطة الأقراص المقحمة لتشكيل ألياف طويلة. تحتوي كل خلية على ألياف عضلية ليفية، وهي ألياف بروتينية متخصصة تمر عبر بعضها البعض. تنظم هذه في ساركوميرات، الوحدات الأساسية لانقباض خلايا العضلات. يعطي التنظيم المنتظم للألياف العضلية في الساركومير خلايا عضلة القلب شكل مخطط عندما تتم رؤيتها تحت المجهر، على غرار الهيكل العظمي والعضلات. تنجم هذه الاضطرابات عن شريط I أفتح يتكون أساسًا من بروتين يسمى الأكتين، وشريط A الأغمق يتكون أساسًا من الميوسين. [4]
تحتوي عضلات القلب على نبيبات مستعرضة، أكياس من الغشاء الذي يمتد من السطح إلى داخل الخلية مما يساعد على تحسين كفاءة الانقباض. تحتوي غالبية هذه الخلايا على نواة واحدة فقط (على الرغم من أنها قد تحتوي على ما يصل إلى أربعة)، على عكس خلايا العضلات الهيكلية التي تحتوي عادة على العديد من النويات. تحتوي خلايا عضلة القلب على العديد من الميتوكوندريون التي توفر الطاقة اللازمة للخلية في شكل أدينوسين ثلاثي الفوسفات (ATP)، مما يجعلها شديدة المقاومة للتعب. [6] [4]
نبيبات مستعرضة
النبيبات المستعرضة هي نبيبات مجهرية تمتد من سطح الخلية إلى عمق الخلية. هي مستمرة مع غشاء الخلية، وتتكون من نفس الليبيد ثنائي الطبقة، وهي مفتوحة على سطح الخلية أمام السائل خارج الخلوي الذي يحيط بالخلية. تكون النبيبات المستعرضة في عضلة القلب أكبر وأوسع من تلك الموجودة في العضلات الهيكلية، ولكنها أقل في العدد. [6]ينضمون معًا في وسط الخلية، ويمتدون داخل الخلية وعلى طولها كشبكة عرضية محورية. تقع بالقرب من مخزن الكالسيوم الداخلي للخلية (الشبكة الهيولية العضلية). هنا يزوج نبيب واحد مع جزء من الشبكة الهيولية تسمى صهريج طرفي في تركيبة تعرف باسم الثنائية. [7]
تشمل وظائف النبيبات التائية النبضات الكهربائية المرسلة بسرعة والتي تُعرف باسم إمكانات الحركة من سطح الخلية إلى قلب الخلية، والمساعدة في تنظيم تركيز الكالسيوم داخل الخلية في عملية تُعرف باسم اقتران الإثارة-الانكماش. [6]
الأقراص المقحمة

الملتحمات الخلوية القلبية هي عبارة عن شبكة من خلايا عضلية القلب متصلة ببعضها البعض عن طريق الأقراص المقربة التي تتيح الانتقال السريع للنبضات الكهربائية من خلال الشبكة، مما يتيح بانقباض منسق لعضلة القلب. هناك ملتحم أذيني وملتحام بطيني متصلين عبر ألياف وصل قلبية. [8] المقاومة الكهربائية من خلال الأقراص المقحمة منخفضة للغاية، مما يسمح بالانتشار الحر للأيونات. إن سهولة الحركة الأيونية على طول محاور ألياف عضلة القلب تجعل إمكانات الحركة قادرة على الانتقال من خلية عضلية قلبية إلى أخرى، وتواجه فقط مقاومة بسيطة. يطيع كل ملتحم قانون «الكل أو لا شيء» (إما تعطي الخلية العصبية استجابة قصوي أو لا تعطي استجابة مطلقًا). [9]
الأقراص المقحمة هي عبارة عن هياكل معقدة تربط عضلات القلب الفردية بملتحم خلوي كهروكيميائي (على عكس العضلات الهيكلية، والتي تصبح خليوي متعدد الخلايا أثناء النمو الجنيني للثدييات). الأقراص هي المسؤولة أساسًا عن انتقال القوة أثناء انقباض العضلات. تتألف الأقراص المقربة من ثلاثة أنواع مختلفة من الوصلات الخلوية الخلوية: الخيوط الأكتينية الملتصقة بالوصلات، والرابطات الخيطية المتوسطة التي تلتصق بالجسيمات الرابطة، وموصلات فجوية. يسمحون جميعهم بإمكانية الحركة في الانتشار بين خلايا القلب عن طريق السماح بمرور الأيونات بين الخلايا، مما ينتج عنه استقطاب لعضلة القلب. ومع ذلك، فقد أظهرت الدراسات البيولوجية الشاملة والجزيئية الجديدة بشكل لا لبس فيه أن الأقراص المقربة تتألف معظمها من الوصلات الملتصقة من النوع المختلط المسماة مفصل مركب (pl. areae compositae) التي تمثل مزيجًا من بروتينات ديسموسومال ولفافة أدهارينز النموذجية (على عكس مختلف الظهارة) . [10][11][12] يناقش المؤلفون الأهمية البالغة لهذه النتائج لفهم اعتلال عضلة القلب الوراثي (مثل خلل تنسج البطين الأيمن المحدث لاضطراب النظم).
تحت المجهر الضوئي، تظهر الأقراص المقحمة كخطوط رفيعة عادة مصبوغة بلون داكن يقسم خلايا عضلة القلب المجاورة. تعمل الأقراص المقحمة بشكل عمودي على اتجاه ألياف العضلات. تحت المجهر الإلكتروني، يبدو مسار القرص المقحم أكثر تعقيدًا. عند التكبير المنخفض، قد يظهر هذا كهيكل كثيف للإلكترون معقد يطل على موقع الخط Z المحجب. عند التكبير العالي، يظهر مسار القرص المقحمة أكثر تعقيدًا، مع ظهور كل من المناطق الطولية والعرضية في المقطع الطولي. [13]

الأرومات الليفية
الأرومات الليفية القلبية هي خلايا داعمة حيوية داخل عضلة القلب. إنها غير قادرة على توفير انقباضات قوية مثل خلايا القلب العضلية، ولكن بدلاً من ذلك هم المسؤولون إلى حد كبير عن إنشاء المصفوفة خارج الخلية والمحافظة عليها والتي تشكل الملاط الذي يتم فيه ضم أحجار عضلة القلب. [4] تلعب الخلايا الليفية دورًا مهمًا في الاستجابة للإصابة، مثل النوبة القلبية. بعد الإصابة، يمكن أن تصبح الخلايا الليفية نشطة وتتحول إلى myofibroblasts - الخلايا التي تظهر سلوكًا في مكان ما بين الخلايا الليفية (توليد المصفوفة خارج الخلية) والخلايا العضلية الملساء (القدرة على الانقباض). في هذه السعة، يمكن للأرومات الليفية إصلاح أي إصابة عن طريق إنشاء الكولاجين بينما تنقبض بلطف لسحب حواف المنطقة المصابة معًا. [14]
الأرومات الليفية أصغر ولكنها أكثر عددًا من الخلايا العضلية القلبية، ويمكن ربط العديد من الأرومات الليفية بخلية عضلية في آن واحد. عند الالتصاق بخلية عضلية يمكن أن تؤثر على التيارات الكهربائية التي تمر عبر الغشاء السطحي للخلية العضلية، ويشار إليها في السياق على أنها مقترنة كهربائياً. [15] تشمل الأدوار الأخرى المحتملة للخلايا الليفية العزل الكهربائي لنظام التوصيل الكهربائي القلبي، والقدرة على التحول إلى أنواع أخرى من الخلايا بما في ذلك الخلايا العضلية القلبية والخلايا الشحمية. [14]
المصفوفة خارج الخلية
واستنادًا إلى تشبيه عضلة القلب على أنها تشبه الجدار، فإن المصفوفة خارج الخلية هي الملاط الذي يحيط بالطوب العضلي القلبي والأرومات الليفية. تتكون المصفوفة من بروتينات مثل الكولاجين والإيلاستين إلى جانب السكاريد (سلاسل السكر) المعروفة باسم الغليكوز أمينوغليكان. [4] توفر هذه المواد معًا الدعم والقوة لخلايا العضلات، وتخلق مرونة في عضلة القلب، وتحافظ على ترطيب خلايا العضلات بجزيئات الماء الملزمة.
يشار إلى المصفوفة في اتصال مباشر مع خلايا العضلات باسم الغشاء القاعدي، تتكون أساسًا من الكولاجين من النوع الرابع ولامين. ترتبط الخلايا العضلية القلبية بغشاء القاعدي من خلال البروتينات السكرية المتخصصة التي تدعى إنتغرين. [16]
علم وظائف الأعضاء

يشارك فسيولوجيا عضلة القلب العديد من أوجه التشابه مع فسيولوجيا العضلات الهيكلية. تتمثل الوظيفة الأساسية لكلا النوعين العضليين في الانقباض، وفي كلتا الحالتين يبدأ الانقباض بتدفق مميز للأيونات عبر غشاء الخلية المعروف باسم جهد الفعل القلبي. يعمل جهد فعل الحركة لاحقًا على إحداث انقباض في العضلات عن طريق زيادة تركيز الكالسيوم داخل العصارة الخلوية.
ومع ذلك، فإن الآلية التي بها تركيزات الكالسيوم داخل السيتوسول تختلف بين الهيكل العظمي والعضلات القلبية. في عضلة القلب، تشتمل احتمالية الحركة على تدفق داخلي لأيونات الصوديوم والكالسيوم. يكون تدفق أيونات الصوديوم سريعًا ولكنه قصير الأجل جدًا، بينما يستمر تدفق الكالسيوم ويمنح مرحلة الهضبة ميزة جهد عمل عضلة القلب. يؤدي التدفق الصغير نسبياً للكالسيوم عبر قنوات الكالسيوم من النوع L إلى إطلاق أكبر بكثير من الكالسيوم من شبكية الساركوبلازم في ظاهرة تعرف باسم إطلاق الكالسيوم المستحث بالكالسيوم. في المقابل، في العضلات الهيكلية، يتدفق الحد الأدنى من الكالسيوم إلى الخلية أثناء جهد العمل المحتمل وبدلاً من ذلك، فإن الشبكة الساركوبلازمية في هذه الخلايا تقترن مباشرة بالغشاء السطحي. يمكن توضيح هذا الاختلاف من خلال ملاحظة أن ألياف عضلة القلب تتطلب وجود الكالسيوم في المحلول المحيط بالخلية من أجل الانقباض، في حين أن ألياف العضلات الهيكلية سوف تتقلص دون الكالسيوم خارج الخلية.
أثناء انقباض خلايا عضلة القلب، تتجه البروتينات العضلية الطويلة بطول الشريحة فوق بعضها البعض فيما يعرف بفرضية الخيوط المنزلقة. هناك نوعان من الخيوط العضلية، خيوط سميكة مكونة من بروتين الميوسين، وخيوط رقيقة تتكون من بروتينات أكتين، وتروبونين وتروبوميوسين. لأن شريحة خيوط السميكة والرقيقة ينزلقون بعد بعضهم البعض تصبح الخلية أقصر وأسمن. في آلية تُعرف باسم ركوب الدراجات عبر الجسر، تلتصق أيونات الكالسيوم ببروتين البروبونين، الذي يكتشف مع التروبوموسين بعد ذلك مواقع الربط الرئيسية على الأكتين. يمكن للميوسين، في الشعيرة السميكة، أن يرتبط بالأكتين، وسحب الخيوط السميكة على طول الشعيرات الرقيقة. عندما ينخفض تركيز الكالسيوم داخل الخلية، يقوم التروبونين والتروبوميوسين مرة أخرى بتغطية مواقع الارتباط في الأكتين، مما يؤدي إلى استرخاء الخلية.
التجديد

حتى وقت قريب، كان هناك اعتقاد شائع بأنه لا يمكن تجديد خلايا عضلة القلب. ومع ذلك، فإن دراسة نشرت في عدد 3 أبريل 2009 من مجلة Science تتناقض مع هذا الاعتقاد. [17] قام أولاف بيرجمان وزملاؤه في معهد كارولنسكا في ستوكهولم باختبار عينات من عضلات القلب من الأشخاص الذين ولدوا قبل عام 1955 وكان لديهم عضلة قلبية قليلة جدًا حول قلوبهم، وقد أظهر العديد منهم إعاقات من هذه الحالة غير الطبيعية. باستخدام عينات من الحمض النووي من العديد من القلوب، قدر الباحثون أن طفل يبلغ من العمر 4 سنوات يجدد حوالي 20 ٪ من خلايا عضلة القلب في السنة، وحوالي 69٪ من خلايا عضلة القلب لشخص عمره 50 سنة تم إنشاؤها بعدما ولد أو ولدت.
إحدى الطرق التي يحدث بها تجديد خلايا عضلة القلب هي تقسيم خلايا عضلة القلب الموجودة مسبقًا أثناء عملية الشيخوخة الطبيعية. [18] كما تبين أن عملية تقسيم خلايا عضلة القلب الموجودة مسبقًا تزداد في المناطق المجاورة لمواقع إصابة عضلة القلب. بالإضافة إلى ذلك، هناك عوامل نمو معينة تعزز التجديد الذاتي للخلايا العضلية القلبية والخلايا الجذعية القلبية. على سبيل المثال، عامل النمو الشبيه بالأنسولين 1، وعامل نمو خلايا الكبد، وبروتين المجموعة B1 عالي الحركة يزيد من هجرة الخلايا الجذعية القلبية إلى المنطقة المصابة، وكذلك تكاثر هذه الخلايا وبقائها. [19] بعض أعضاء عائلة عامل نمو الخلايا الليفية يحرضون أيضًا على إعادة الدورة الخلوية لخلايا عضلية القلب الصغيرة. يلعب عامل نمو بطانة الأوعية الدموية أيضًا دورًا مهمًا في توظيف خلايا القلب الأصلية في موقع الاحتشاء بالإضافة إلى تأثيره الوعائي.
بناءً على الدور الطبيعي للخلايا الجذعية في تجديد الخلايا العضلية للقلب، يهتم الباحثون والأطباء بشكل متزايد باستخدام هذه الخلايا للحث على تجديد الأنسجة التالفة. تبين أن سلالات الخلايا الجذعية المختلفة قادرة على التفريق إلى خلايا عضلية قلبية، بما في ذلك الخلايا الجذعية لنخاع العظام. على سبيل المثال، في إحدى الدراسات، زرع الباحثون خلايا نخاع العظم، والتي شملت مجموعة من الخلايا الجذعية، المتاخمة لموقع احتشاء في نموذج فأر. بعد تسعة أيام من الجراحة، وجد الباحثون فرقة جديدة من عضلة القلب المتجددة. [20] ومع ذلك، لم يلاحظ هذا التجديد عندما كان تعداد الخلايا المحقونة مخلية من الخلايا الجذعية، مما يوحي بقوة أن تعداد الخلية الجذعية كان هو الذي ساهم في تجديد عضلة القلب. أظهرت تجارب سريرية أخرى أن عمليات زرع خلايا نخاع العظم الذاتية التي يتم توصيلها عبر الشريان المرتبط بالاحتشاء تقلل من منطقة الاحتشاء مقارنة بالمرضى الذين لم يتلقوا العلاج بالخلايا. [21]
الاختلافات بين الأذينين والبطينين
تشكل عضلة القلب الأذينين والبطينين. على الرغم من أن هذا النسيج العضلي مشابه جدًا بين غرف القلب، إلا أن هناك بعض الاختلافات. عضلة القلب الموجودة في البطينين سميكة للسماح بانقباضات قوية، في حين أن عضلة القلب في الأذينين أرق بكثير. تختلف الخلايا العضلية الفردية التي تشكل عضلة القلب أيضًا بين غرف القلب. تعد عضلات القلب البطينية أطول وأوسع، مع شبكة أنابيب مستعرض الأكثر كثافة. على الرغم من أن الآليات الأساسية للتعامل مع الكالسيوم متشابهة بين خلايا عضلة القلب البطينية والأذينية، فإن عابرة الكالسيوم أصغر وتتحلل بسرعة أكبر في الخلايا العضلية الأذينية، مع زيادة مقابلة في قدرة تخزين الكالسيوم المؤقت. [22] يختلف مكمل القنوات الأيونية بين الغرف، مما يؤدي إلى فترات عمل محتملة أطول وفترات حرارية فعالة في البطينين. بعض التيارات الأيونية، مثل I K (UR)، محددة بشكل خاص لخلايا عضلية القلب الأذينية، مما يجعلها هدفًا محتملًا لعلاجات الرجفان الأذيني. [23]
الأهمية السريرية
الأمراض التي تصيب عضلة القلب لها أهمية سريرية هائلة، وهي السبب الرئيسي للوفاة في الدول المتقدمة. [24] أكثر الحالات شيوعًا التي تؤثر على عضلة القلب هي أمراض القلب الإقفارية، حيث يتم تقليل تدفق الدم إلى القلب. في أمراض القلب الإقفارية، تضيق الشرايين التاجية بسبب تصلب الشرايين. [25] إذا أصبحت هذه الضيقات أشد تدريجيًا بدرجة كافية لتقييد تدفق الدم جزئيًا، فقد تحدث متلازمة الذبحة الصدرية. [25] هذا عادة ما يسبب ألم في الصدر أثناء المجهود الذي يريح بالراحة. إذا أصبح الشريان التاجي فجأة ضيقًا جدًا أو مسدودًا تمامًا، أو يقطع تدفق الدم عبر الأوعية أو يقلل بشدة منه، تحدث النوبة القلبية أو الأزمة القلبية. [26] إذا لم يتم تخفيف الانسداد بسرعة عن طريق الدواء، أو التدخل التاجي عن طريق الجلد، أو الجراحة، فقد تصبح منطقة عضلة القلب مندبة ومتضررة بشكل دائم. [27]
يمكن أن تتضرر عضلة القلب أيضًا على الرغم من الإمداد الطبيعي بالدم. قد تصبح عضلة القلب ملتهبة في حالة تسمى بالتهاب عضلة القلب، [28] المسببه من العدوى الفيروسية في غالب الأحيان [29] ولكن في بعض الأحيان يكون سببها الجهاز المناعي للجسم. [30] يمكن أن تتضرر أيضًا عضلة القلب بسبب المخدرات مثل الكحول أو ارتفاع ضغط الدم طويل الأمد أو ارتفاع ضغط الدم في القلب. [31] يمكن أن تسبب أمراض معينة في عضلة القلب تسمى اعتلال عضلة القلب أن تصبح عضلة القلب سميكة بشكل غير طبيعي (اعتلال عضلة القلب الضخامي)، [32] كبيرة بشكل غير طبيعي (اعتلال عضلة القلب المتوسع)، [33] أو قاسية بشكل غير طبيعي (اعتلال عضلة القلب التقييدي). [34] بعض هذه الحالات ناتجة عن طفرات جينية ويمكن توريثها. [35]
العديد من هذه الحالات، إذا كانت قاسية بما فيه الكفاية، يمكن أن تلحق الضرر بالقلب لدرجة أن وظيفة ضخ القلب تقل. إذا لم يعد القلب قادرًا على ضخ ما يكفي من الدم لتلبية احتياجات الجسم، فسيتم وصفه بأنه قصور القلب. [31]
انظر أيضًا
المراجع
- ^ Q114972534، ص. 70، QID:Q114972534
- ^ أ ب S.، Sinnatamby, Chummy (2006). Last's anatomy : regional and applied. Last, R. J. (Raymond Jack). (ط. 11th). Edinburgh: Elsevier/Churchill Livingstone. ISBN:978-0-443-10032-1. OCLC:61692701.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Stöhr، Eric J.؛ Shave، Rob E.؛ Baggish، Aaron L.؛ Weiner، Rory B. (1 سبتمبر 2016). "Left ventricular twist mechanics in the context of normal physiology and cardiovascular disease: a review of studies using speckle tracking echocardiography". American Journal of Physiology. Heart and Circulatory Physiology. ج. 311 ع. 3: H633–644. DOI:10.1152/ajpheart.00104.2016. ISSN:1522-1539. PMID:27402663.
- ^ أ ب ت ث ج (Pathologist)، Stevens, Alan (1997). Human histology. Lowe, J. S. (James Steven), Stevens, Alan (Pathologist). (ط. 2nd). London: Mosby. ISBN:978-0723424857. OCLC:35652355.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ The ESC textbook of cardiovascular medicine. Camm, A. John., Lüscher, Thomas F. (Thomas Felix), Serruys, P. W., European Society of Cardiology. (ط. 2nd). Oxford: Oxford University Press. 2009. ISBN:9780199566990. OCLC:321015206.
{{استشهاد بكتاب}}: صيانة الاستشهاد: آخرون (link) - ^ أ ب ت ث M.، Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (ط. 2nd). Dordrecht: Kluwer Academic Publishers. ISBN:978-0792371588. OCLC:47659382.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Hong، TingTing؛ Shaw، Robin M. (يناير 2017). "Cardiac T-Tubule Microanatomy and Function". Physiological Reviews. ج. 97 ع. 1: 227–252. DOI:10.1152/physrev.00037.2015. ISSN:1522-1210. PMID:27881552.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Jahangir Moini؛ Professor of Allied Health Everest University Indialantic Florida Jahangir Moini (4 أبريل 2011). Anatomy and Physiology for Health Professionals. Jones & Bartlett Publishers. ص. 213–. ISBN:978-1-4496-3414-8. مؤرشف من الأصل في 2017-01-13.
- ^ Khurana (1 يناير 2005). Textbook Of Medical Physiology. Elsevier India. ص. 247. ISBN:978-81-8147-850-4. مؤرشف من الأصل في 2017-01-13.
- ^ "The area composita of adhering junctions connecting heart muscle cells of vertebrates. I. Molecular definition in intercalated disks of cardiomyocytes by immunoelectron microscopy of desmosomal proteins". Eur. J. Cell Biol. ج. 85 ع. 2: 69–82. فبراير 2006. DOI:10.1016/j.ejcb.2005.11.003. PMID:16406610. مؤرشف من الأصل في 2019-09-12.
- ^ "A unique and specific interaction between alphaT-catenin and plakophilin-2 in the area composita, the mixed-type junctional structure of cardiac intercalated discs". J. Cell Sci. ج. 120 ع. Pt 12: 2126–36. يونيو 2007. DOI:10.1242/jcs.004713. PMID:17535849.
- ^ "Desmosomes and Desmosomal Cadherin Function in Skin and Heart Diseases-Advancements in Basic and Clinical Research". Dermatol Res Pract. ج. 2010: 1–3. 2010. DOI:10.1155/2010/725647. PMID:20885972.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ صور نسيجية: 22501loa — نظام تعلم علم الأنسجة في جامعة بوسطن
- ^ أ ب Ivey، Malina J.؛ Tallquist، Michelle D. (25 أكتوبر 2016). "Defining the Cardiac Fibroblast". Circulation Journal: Official Journal of the Japanese Circulation Society. ج. 80 ع. 11: 2269–2276. DOI:10.1253/circj.CJ-16-1003. ISSN:1347-4820. PMID:27746422.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Rohr، Stephan (يونيو 2009). "Myofibroblasts in diseased hearts: new players in cardiac arrhythmias?". Heart Rhythm. ج. 6 ع. 6: 848–856. DOI:10.1016/j.hrthm.2009.02.038. ISSN:1556-3871. PMID:19467515.
- ^ Horn، Margaux A.؛ Trafford، Andrew W. (أبريل 2016). "Aging and the cardiac collagen matrix: Novel mediators of fibrotic remodelling". Journal of Molecular and Cellular Cardiology. ج. 93: 175–185. DOI:10.1016/j.yjmcc.2015.11.005. ISSN:1095-8584. PMID:26578393.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Evidence for cardiomyocyte renewal in humans". Science. ج. 324 ع. 5923: 98–102. أبريل 2009. DOI:10.1126/science.1164680. PMID:19342590.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Mammalian heart renewal by pre-existing cardiomyocytes". Nature. ج. 493 ع. 7432: 433–6. يناير 2013. DOI:10.1038/nature11682. PMID:23222518.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Molecular mechanisms of cardiomyocyte regenerate and therapeutic outlook". Trends Mol Med. ج. 13 ع. 3: 125–33. مارس 2007. DOI:10.1016/j.molmed.2007.01.002. PMID:17257896. مؤرشف من الأصل في 2013-11-12.
- ^ "Bone marrow cells regenerate infarcted myocardium". Nature. ج. 410 ع. 6829: 701–5. أبريل 2001. DOI:10.1038/35070587. PMID:11287958.
- ^ "Stem cells for myocardial regeneration". Circ Res. ج. 91 ع. 12: 1092–102. ديسمبر 2002. DOI:10.1161/01.RES.0000046045.00846.B0. PMID:12480809. مؤرشف من الأصل في 2014-09-05.
- ^ Walden، A. P.؛ Dibb، K. M.؛ Trafford، A. W. (أبريل 2009). "Differences in intracellular calcium homeostasis between atrial and ventricular myocytes". Journal of Molecular and Cellular Cardiology. ج. 46 ع. 4: 463–473. DOI:10.1016/j.yjmcc.2008.11.003. ISSN:1095-8584. PMID:19059414.
- ^ Ravens، Ursula؛ Wettwer، Erich (1 مارس 2011). "Ultra-rapid delayed rectifier channels: molecular basis and therapeutic implications". Cardiovascular Research. ج. 89 ع. 4: 776–785. DOI:10.1093/cvr/cvq398. ISSN:1755-3245. PMID:21159668.
- ^ Lozano، Rafael؛ Naghavi، Mohsen؛ Foreman، Kyle؛ Lim، Stephen؛ Shibuya، Kenji؛ Aboyans، Victor؛ Abraham، Jerry؛ Adair، Timothy؛ Aggarwal، Rakesh (15 ديسمبر 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. ج. 380 ع. 9859: 2095–2128. DOI:10.1016/S0140-6736(12)61728-0. ISSN:1474-547X. PMID:23245604.
- ^ أ ب Kolh، Philippe؛ Windecker، Stephan؛ Alfonso، Fernando؛ Collet، Jean-Philippe؛ Cremer، Jochen؛ Falk، Volkmar؛ Filippatos، Gerasimos؛ Hamm، Christian؛ Head، Stuart J. (أكتوبر 2014). "2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)". European Journal of Cardio-Thoracic Surgery. ج. 46 ع. 4: 517–592. DOI:10.1093/ejcts/ezu366. ISSN:1873-734X. PMID:25173601.
- ^ Smith، Jennifer N.؛ Negrelli، Jenna M.؛ Manek، Megha B.؛ Hawes، Emily M.؛ Viera، Anthony J. (مارس 2015). "Diagnosis and management of acute coronary syndrome: an evidence-based update". Journal of the American Board of Family Medicine: JABFM. ج. 28 ع. 2: 283–293. DOI:10.3122/jabfm.2015.02.140189. ISSN:1558-7118. PMID:25748771.
- ^ Roffi، Marco؛ Patrono، Carlo؛ Collet، Jean-Philippe؛ Mueller، Christian؛ Valgimigli، Marco؛ Andreotti، Felicita؛ Bax، Jeroen J.؛ Borger، Michael A.؛ Brotons، Carlos (14 يناير 2016). "2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC)". European Heart Journal. ج. 37 ع. 3: 267–315. DOI:10.1093/eurheartj/ehv320. ISSN:1522-9645. PMID:26320110.
- ^ Cooper، Leslie T. (9 أبريل 2009). "Myocarditis". The New England Journal of Medicine. ج. 360 ع. 15: 1526–1538. DOI:10.1056/NEJMra0800028. ISSN:1533-4406. PMID:19357408.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Rose، Noel R. (يوليو 2016). "Viral myocarditis". Current Opinion in Rheumatology. ج. 28 ع. 4: 383–389. DOI:10.1097/BOR.0000000000000303. ISSN:1531-6963. PMID:27166925.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Bracamonte-Baran، William؛ Čiháková، Daniela (2017). Cardiac Autoimmunity: Myocarditis. ص. 187–221. DOI:10.1007/978-3-319-57613-8_10. ISBN:978-3-319-57611-4. ISSN:0065-2598. PMID:28667560.
{{استشهاد بكتاب}}:|عمل=تُجوهل (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب Ponikowski، Piotr؛ Voors، Adriaan A.؛ Anker، Stefan D.؛ Bueno، Héctor؛ Cleland، John G. F.؛ Coats، Andrew J. S.؛ Falk، Volkmar؛ González-Juanatey، José Ramón؛ Harjola، Veli-Pekka (أغسطس 2016). "2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC". European Journal of Heart Failure. ج. 18 ع. 8: 891–975. DOI:10.1002/ejhf.592. ISSN:1879-0844. PMID:27207191.
- ^ Liew، Alphonsus C.؛ Vassiliou، Vassilios S.؛ Cooper، Robert؛ Raphael، Claire E. (12 ديسمبر 2017). "Hypertrophic Cardiomyopathy-Past, Present and Future". Journal of Clinical Medicine. ج. 6 ع. 12: 118. DOI:10.3390/jcm6120118. ISSN:2077-0383. PMID:29231893.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Japp، Alan G.؛ Gulati، Ankur؛ Cook، Stuart A.؛ Cowie، Martin R.؛ Prasad، Sanjay K. (28 يونيو 2016). "The Diagnosis and Evaluation of Dilated Cardiomyopathy". Journal of the American College of Cardiology. ج. 67 ع. 25: 2996–3010. DOI:10.1016/j.jacc.2016.03.590. ISSN:1558-3597. PMID:27339497.
- ^ Garcia، Mario J. (3 مايو 2016). "Constrictive Pericarditis Versus Restrictive Cardiomyopathy?". Journal of the American College of Cardiology. ج. 67 ع. 17: 2061–2076. DOI:10.1016/j.jacc.2016.01.076. ISSN:1558-3597. PMID:27126534.
- ^ Towbin، Jeffrey A. (2014). "Inherited cardiomyopathies". Circulation Journal: Official Journal of the Japanese Circulation Society. ج. 78 ع. 10: 2347–2356. DOI:10.1253/circj.CJ-14-0893. ISSN:1347-4820. PMID:25186923.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)
روابط خارجية
| في كومنز صور وملفات عن: عضلة القلب |

