سينثيز بيتا-كيتوأسيل-ACP
في البيولوجيا الجزيئية ، بيتا-كيتوأسيل-ACP سينثيز
ر.ت.إ
2.3.1.41
| 3-oxoacyl-ACP synthase, mitochondrial | |
|---|---|
| المعرفات | |
| الرمز | OXSM |
| أنتريه | 54995 |
| HUGO | 26063 |
| أوميم | 610324 |
| RefSeq | NM_017897 |
| يونيبروت | Q9NWU1 |
| بيانات أخرى | |
| رقم التصنيف الإنزيمي | 2.3.1.41 |
| الموقع الكروموسومي | Chr. 3 p24.2 |
| تعديل مصدري - تعديل | |
| Beta-ketoacyl synthase, N-terminal domain | |
|---|---|
| |
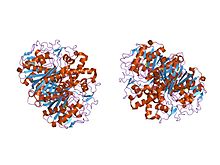
| the crystal structure of beta-ketoacyl-[acyl carrier protein] synthase ii from streptococcus pneumoniae, triclinic form | |
| معرف | |
| رمز | ketoacyl-synt |
| Beta-ketoacyl synthase, C-terminal domain | |
|---|---|

| |
| arabidopsis thaliana mitochondrial beta-ketoacyl acp synthase hexanoic acid complex | |
| معرف | |
| رمز | Ketoacyl-synt_C |
| قاعدة بيانات عوائل البروتينات | PF02801 |
| قاعدة بيانات عوائل البروتينات clan | CL0046 |
| إنتربرو | IPR014031 |
| بروسايت | PDOC00529 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1kas |
هو إنزيم يشارك في تخليق الأحماض الدهنية في الجسم . يتعامل عادةً مع مالونيل-CoA كمصدر للكربون لإطالة أنواع الأسيل المرتبطة بـالبروتين حامل الأسيل ACP ، مما يؤدي إلى تكوين أنواع بيتا-كيتوأسيل مرتبطة بـ ACP مثل أسيتوأسيتيل-ACP . [1]
ACP هو بروتين حامل الأسيل:
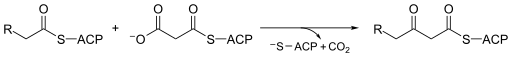
سينثيز بيتا كيتوأسيل-ACP هو عبارة عن إنزيم محفوظ للغاية يوجد في جميع أشكال الحياة على الأرض تقريبًا كمجال في سينسيز الأحماض الدهنية (FAS). يوجد سينسيز الأحماض الدهنية في نوعين ، مسمى على نحو مناسب من النوع الأول والثاني. في الحيوانات والفطريات وحقيقيات النوى السفلية ، تشكل تركيبات بيتا كيتوأسيل-ACP أحد المجالات التحفيزية للبروتينات الكبيرة متعددة الوظائف (النوع الأول) ، بينما في معظم بدائيات النوى وكذلك في البلاستيدات والميتوكوندريا ، تكون تركيبات بيتا كيتوأسيل-ACP عبارة عن سلاسل بروتينية منفصلة تتكون عادةً من النوع الثاني. [2] [3] يحفز بيتا- كيتوأسيل-ACPI سينثاز III ، ربما الأكثر شهرة بين عائلة الإنزيمات هذه ، تكاثف كلايسين بين أسيتيل-CoA ومالونيل-ACP . توضح الصورة أدناه كيفية احتواء مساعد الأنزيم-أ في الموقع النشط كركيزة من سينثيز III.

تحفز تركيبات سينثيز بيتا-كيتوأسيل- أيه سي بي I ، و II فقط تفاعلات أسيل-ACP مع مالونيل-ACP. المركب المركب الأول والثاني قادران على إنتاج سلسلة طويلة من ACPs (بروتين حامل الأسيل). كلاهما فعال حتى أسيل-ACPs ذو 14 سلسلة كربون ، وعند هذه النقطة يكون سينثيز بيتا-كيتواسيل- إيه سي بي II هو الخيار الأكثر كفاءة لمزيد من إضافات الكربون. يحفز النوع الأول تركيب الأحماض الدهنية جميع التفاعلات اللازمة لتكوين حمض البالمتيك ، وهي وظيفة ضرورية في الحيوانات لعمليات التمثيل الغذائي ، والتي تتضمن إحداها تكوين السفينغوزينات (العمليات الهضمية). [2]
تم العثور على سينسيز بيتا-كيتوأسيل-ACP كمكون في عدد من الأنظمة الأنزيمية ، بما في ذلك إنزيم الحمض الدهني (FAS) ؛ سينثاس حمض 6 ميثيساليسيليك متعدد الوظائف (MSAS) من سلالة البنسليوم ، [4] والذي يشارك في التخليق الحيوي لمضاد حيوي متعدد الكيتيدات ؛ أنظمة إنزيم بوليكيتيد المضاد الحيوي سينثيز ؛ بروتين Emericella nidulans متعدد الوظائف (دبليو أيه) ، الذي يشارك في التخليق الحيوي للصباغ الأخضر كونيدال ؛ عقدة بروتين عقدة ريزوبيوم ، والتي من المحتمل أن تعمل بمثابة سينسيز بيتا كيتواسيل في تخليق سلسلة عقدة الأسيل الدهنية لعامل العقدة ؛ وبروتين الميتوكوندريا في الخميرة CEM1.
البنية
يحتوي سينثيز بيتا-كيتواسيل على مجالين من البروتين . يقع الموقع النشط بين المجالات N- وC- النهايتين . يحتوي مجال النهاية N- على معظم الهياكل المشاركة في تكوين ديمر وأيضًا موقع سيستاين النشط . تساهم الأطراف الباقية من كلا المجالين في ربط الركيزة والتحفيز [5]
في الحيوانات وفي بدائيات النوى ، بيتا-كيتوأسيل-ACP سينثيز هو مجال على النوع الأول لتركيب الأحماض الدهنية ، وهو مركب إنزيمي كبير يحتوي على مجالات متعددة لتحفيز تفاعلات مختلفة متعددة. بشكل مشابه ، تم العثور على سينثيز بيتا-كيتواسيل- أيه سي بي في النباتات من النوع تخليق الأحماض الدهنية II ؛ لاحظ أنه تم توثيق التركيبات في النباتات بحيث تحتوي على مجموعة من خصائص الركيزة . [2] يشير وجود تركيبات كيتوأسيل مماثلة موجودة في جميع الكائنات الحية إلى سلف مشترك . [6] أظهر الفحص الإضافي لتخليق بيتا كيتواسيل- إيه سي بي الأول والثاني للإشريكية القولونية أن كلاهما متماثل ، لكن سينثيز II أكبر قليلاً. ومع ذلك ، على الرغم من أن كلاهما يشارك في استقلاب الأحماض الدهنية ، إلا أنهما يمتلكان أيضًا بنية أولية شديدة التباين. [7] في سينثاز II ، تتكون كل وحدة فرعية من ورقة مطوية بيتا خماسية الجديلة محاطة بعدة حلزونات ألفا ، كما هو موضح في الصورة على اليسار. المواقع النشطة قريبة نسبيًا ، متباعدة فقط بمسافة 25 أنجستروم ، وتتكون في الغالب من جيب كاره للماء . [8] اقترحت بعض التجارب أيضًا وجود "أنفاق نقل الأحماض الدهنية" داخل مجال سينسيز بيتا-كيتوأسيل- ACP والتي تؤدي إلى واحد من العديد من "تجاويف الأحماض الدهنية" ، والتي تعمل أساسًا كموقع نشط. [9]
الآلية
آلية بيتا-كيلوأسيل-سينثاز هي موضوع نقاش بين الكيميائيين. يتفق الكثيرون على أن Cys171 من الموقع النشط يهاجم كربونيل أسيتيل- ACP ، ومثل معظم الإنزيمات ، يثبّت الوسيط مع الأطراف الأخرى في الموقع النشط. يتم التخلص من ACP في وقت لاحق ، ويقوم بإخراج His311 في هذه العملية. ثم يتم تجديد ثيوستر مع السيستين في الموقع النشط. يؤدي نزع الكربوكسيل عن مالونيل-CoA الموجود أيضًا في الموقع النشط إلى إنشاء انولات ، والذي تم تثبيته بواسطة His311 و His345. يتحول أنولات إلى كاربأنيون يهاجم ثيواستر من مجمع إنزيم الأسيتيل. [10] تتكهن بعض المصادر بأن جزيء الماء المنشط يكون موجودا أيضًا في الموقع النشط كوسيلة لترطيب ثاني أكسيد الكربون المنطلق أو لمهاجمة الكربون C3 لـ مالونيل-CoA . هناك آلية مقترحة أخرى تنظر في إنشاء حالة انتقال رباعي السطوح . [2] تأتي القوة الدافعة للتفاعل من نزع الكربوكسيل من مالونيل-ACP ؛ تأتي الطاقة الملتقطة في هذه الرابطة تقنيًا من ATP ، وهو ما يستخدم في البداية لكربوكسيلات أسيتيل-CoA لتحويلها إلي مالونيل-CoA. [11]
الوظيفة البيولوجية
تتمثل الوظيفة الرئيسية لـ بيتا-كيتوأسيل-ACP سينثيز في إنتاج الأحماض الدهنية بأطوال مختلفة لاستخدامها من قبل الكائن الحي. وتشمل هذه الاستخدامات تخزين الطاقة وإنشاء أغشية الخلايا . يمكن أيضًا استخدام الأحماض الدهنية في تصنيع البروستاجلاندين ، والفوسفوليبيد ، والفيتامينات ، من بين أشياء أخرى كثيرة. علاوة على ذلك ، يستخدم حمض البالمتيك ، الذي يتم تكوينه بواسطة بيتا كيتوأسيل سينثاز على النوع الأول لتركيب أحماض دهنية ، في عدد من الإمكانات البيولوجية. وهو مقدمة لكل من الأحماض الدهنية والبالميتوليك. يمكن استخدام البالميتوليك لاحقًا لإنشاء عدد من الأحماض الدهنية الأخرى. [12] يستخدم حمض البالمتيك أيضًا في تصنيع السفينجوزينات التي تلعب دورًا في أغشية الخلايا. [2]
الأهمية السريرية
الأنواع المختلفة من تركيبات بيتا-كيتوأسيل-ACP في النوع الثاني من تخليق الأحماض الدهنية FAS ، التي تسمى تركيبات FabB و FabF و FabH. يحفز FabH تفاعل كيتوأسيل سنثاز الجوهري مع مالونيل- ACP و أسيتيل-CoA. كما تحفز FabB و FabF التفاعلات الأخرى ذات الصلة. نظرًا لأن وظيفتها ضرورية للوظيفة البيولوجية المناسبة المحيطة بتخليق البروتين الدهني والفوسفوليبيد وعديد من السكاريد الدهني ، فقد أصبحوا هدفًا في تطوير الأدوية المضادة للبكتيريا. من أجل التكيف مع بيئتها ، تقوم البكتيريا بتغيير تكوين الفوسفوليبيد لأغشيتها. وبالتالي قد يكون تثبيط هذا المسار نقطة قوة في تعطيل تكاثر البكتيريا . [13] من خلال دراسة اليرسينيا الطاعونية ، التي تسبب الطاعون الدبلي والالتهاب الرئوي وتسمم الدم ، أظهر الباحثون أن FabB و FabF و FabH يمكن نظريًا تثبيطها بواسطة نفس الدواء بسبب أوجه التشابه في مواقع الارتباط الخاصة بهم. ومع ذلك لم يتم تطوير هذا الدواء بعد. [14] سيرولين ، وهو جزيء يبدو أنه يثبط عن طريق محاكاة "حالة انتقال التكثيف" يمكنه فقط تثبيط B أو F ، ولكن ليس H. جزيء آخر ، وهو ثيولاكتومايسين thiolactomycin ، الذي يشابه مالونيل- ACP في الموقع النشط ، يمكنه فقط تثبيط FabB. [15] وأخيرًا يمكن استخدام بلاتنسيميسين أيضًا للمضادات الحيوية بسبب تثبيطه لـ FabF. [16]
هذه الأنواع من الأدوية وثيقة الصلة بالموضوع. على سبيل المثال ، كان "واي. بستيس" العامل الرئيسي في طاعون جستنيان ، والموت الأسود ، والطاعون الحديث. حتى خلال السنوات الخمس الماضية ، شهدت كل من الصين وبيرو ومدغشقر تفشي عدوى بكتيريا واي. بستيس Y. pestis . إذا لم يتم علاجه في غضون 24 ساعة ، فإنه عادة ما يؤدي إلى الوفاة. علاوة على ذلك ، هناك قلق من إمكانية استخدامه الآن كسلاح حرب بيولوجية محتمل. [17]
لسوء الحظ فإن العديد من الأدوية التي تستهدف مركبات بيتا-كيتوأسيل-سينثاز في بدائيات النواة تحمل العديد من الآثار الجانبية . بالنظر إلى أوجه التشابه بين التركيبات الكيتونية لبدائيات النواة وتلك الموجودة في الميتوكوندريا ، فإن هذه الأنواع من الأدوية تميل أيضًا إلى العمل عن غير قصد (أعراض جانبية) على تركيبات الميتوكوندريا ، مما يؤدي إلى العديد من العواقب البيولوجية للبشر. [18]
التطبيقات الصناعية
تشمل الجهود الأخيرة في الهندسة الحيوية هندسة بروتينات تخليق الأحماض الدهنية FAS ، والتي تشمل مجالات سينثيز- بيتا-كيتواسيل-ACP ، من أجل تفضيل توليف سلاسل الكربون المتفرعة كمصدر للطاقة المتجددة . تحتوي سلاسل الكربون المتفرعة على قدر أكبر من الطاقة ويمكن استخدامها في درجات الحرارة الباردة بسبب انخفاض نقطة التجمد لها. باستخدام الإشريكية كولي E. coli ككائن مفضل ، استبدل المهندسون مجال FabH الداخلي على FAS ، والذي يفضل السلاسل غير المتفرعة ، مع إصدارات FabH التي تفضل التفرع نظرًا لخصوصية ركائزها العالية لـجزيئات أسيل-ACP المتفرعة. [19]
أنظر أيضا
مراجع
- ^ Witkowski، Andrzej؛ Joshi، Anil K.؛ Smith، Stuart (2002). "Mechanism of the β-Ketoacyl Synthase Reaction Catalyzed by the Animal Fatty Acid Synthase †". Biochemistry. ج. 41 ع. 35: 10877–10887. DOI:10.1021/bi0259047. PMID:12196027.
- ^ أ ب ت ث ج Witkowski، Andrzej؛ Joshi، Anil K.؛ Smith، Stuart (2002). "Mechanism of the β-Ketoacyl Synthase Reaction Catalyzed by the Animal Fatty Acid Synthase †". Biochemistry. ج. 41 ع. 35: 10877–10887. DOI:10.1021/bi0259047. PMID:12196027.Witkowski, Andrzej; Joshi, Anil K.; Smith, Stuart (2002). "Mechanism of the β-Ketoacyl Synthase Reaction Catalyzed by the Animal Fatty Acid Synthase †". Biochemistry. 41 (35): 10877–10887. doi:10.1021/bi0259047. PMID 12196027.
- ^ Christensen، Caspar Elo؛ Kragelund، Birthe B.؛ von Wettstein-Knowles، Penny؛ Henriksen، Anette (1 فبراير 2007). "Structure of the human β-ketoacyl [ACP] synthase from the mitochondrial type II fatty acid synthase". Protein Science. ج. 16 ع. 2: 261–272. DOI:10.1110/ps.062473707. ISSN:0961-8368. PMID:17242430.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "The multifunctional 6-methylsalicylic acid synthase gene of Penicillium patulum. Its gene structure relative to that of other polyketide synthases". European Journal of Biochemistry. ج. 192 ع. 2: 487–98. سبتمبر 1990. DOI:10.1111/j.1432-1033.1990.tb19252.x. PMID:2209605.
- ^ "Crystal structure of beta-ketoacyl-acyl carrier protein synthase II from E.coli reveals the molecular architecture of condensing enzymes". The EMBO Journal. ج. 17 ع. 5: 1183–91. مارس 1998. DOI:10.1093/emboj/17.5.1183. PMID:9482715.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Beld، Joris؛ Blatti، Jillian L.؛ Behnke، Craig؛ Mendez، Michael؛ Burkart، Michael D. (1 أغسطس 2014). "Evolution of acyl-ACP-thioesterases and β-ketoacyl-ACP-synthases revealed by protein-protein interactions". Journal of Applied Phycology. ج. 26 ع. 4: 1619–1629. DOI:10.1007/s10811-013-0203-4. ISSN:0921-8971. PMID:25110394.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Garwin, J. L.; Klages, A. L.; Cronan, J. E. (25 Dec 1980). "Structural, enzymatic, and genetic studies of beta-ketoacyl-acyl carrier protein synthases I and II of Escherichia coli". Journal of Biological Chemistry (بEnglish). 255 (24): 11949–11956. DOI:10.1016/S0021-9258(19)70226-9. ISSN:0021-9258. PMID:7002930. Archived from the original on 2019-05-05.
- ^ "Crystal structure of beta-ketoacyl-acyl carrier protein synthase II from E.coli reveals the molecular architecture of condensing enzymes". The EMBO Journal. ج. 17 ع. 5: 1183–91. مارس 1998. DOI:10.1093/emboj/17.5.1183. PMID:9482715.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Huang W, Jia J, Edwards P, Dehesh K, Schneider G, Lindqvist Y (Mar 1998). "Crystal structure of beta-ketoacyl-acyl carrier protein synthase II from E.coli reveals the molecular architecture of condensing enzymes". The EMBO Journal. 17 (5): 1183–91. doi:10.1093/emboj/17.5.1183. PMC 1170466. PMID 9482715. - ^ Cui، Wei؛ Liang، Yan؛ Tian، Weixi؛ Ji، Mingjuan؛ Ma، Xiaofeng (1 مارس 2016). "Regulating effect of β-ketoacyl synthase domain of fatty acid synthase on fatty acyl chain length in de novo fatty acid synthesis". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. ج. 1861 ع. 3: 149–155. DOI:10.1016/j.bbalip.2015.12.002. PMID:26680361. مؤرشف من الأصل في 2023-07-25.
- ^ Lee، Wook؛ Engels، Bernd (2014). "The Protonation State of Catalytic Residues in the Resting State of KasA Revisited: Detailed Mechanism for the Activation of KasA by Its Own Substrate". Biochemistry. ج. 53 ع. 5: 919–931. DOI:10.1021/bi401308j. PMID:24479625.
- ^ Tymoczko، John؛ Berg؛ Stryer (2013). Biochemistry A Short Course. United States of America: W.H. Freeman and Company. ISBN:978-1-4292-8360-1.
- ^ "Palmitic acid, a saturated fatty acid, in Cell Culture". Sigma-Aldrich. مؤرشف من الأصل في 2022-04-07. اطلع عليه بتاريخ 2016-02-29.
- ^ Zhang, Yong-Mei; Rock, Charles O. (1 Mar 2008). "Membrane lipid homeostasis in bacteria". Nature Reviews Microbiology (بEnglish). 6 (3): 222–233. DOI:10.1038/nrmicro1839. ISSN:1740-1526. PMID:18264115.
- ^ Nanson, Jeffrey D.; Himiari, Zainab; Swarbrick, Crystall M. D.; Forwood, Jade K. (15 Oct 2015). "Structural Characterisation of the Beta-Ketoacyl-Acyl Carrier Protein Synthases, FabF and FabH, of Yersinia pestis". Scientific Reports (بEnglish). 5: 14797. Bibcode:2015NatSR...514797N. DOI:10.1038/srep14797. PMID:26469877.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help) - ^ Price, Allen C.; Choi, Keum-Hwa; Heath, Richard J.; Li, Zhenmei; White, Stephen W.; Rock, Charles O. (2 Mar 2001). "Inhibition of β-Ketoacyl-Acyl Carrier Protein Synthases by Thiolactomycin and Cerulenin STRUCTURE AND MECHANISM". Journal of Biological Chemistry (بEnglish). 276 (9): 6551–6559. DOI:10.1074/jbc.M007101200. ISSN:0021-9258. PMID:11050088.
- ^ Wright، H Tonie؛ Reynolds، Kevin A (1 أكتوبر 2007). "Antibacterial targets in fatty acid biosynthesis". Current Opinion in Microbiology. Antimicrobials/Genomics. ج. 10 ع. 5: 447–453. DOI:10.1016/j.mib.2007.07.001. PMID:17707686.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Nanson, Jeffrey D.; Himiari, Zainab; Swarbrick, Crystall M. D.; Forwood, Jade K. (15 Oct 2015). "Structural Characterisation of the Beta-Ketoacyl-Acyl Carrier Protein Synthases, FabF and FabH, of Yersinia pestis". Scientific Reports (بEnglish). 5: 14797. Bibcode:2015NatSR...514797N. DOI:10.1038/srep14797. PMID:26469877.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(help)Nanson, Jeffrey D.; Himiari, Zainab; Swarbrick, Crystall M. D.; Forwood, Jade K. (2015-10-15). "Structural Characterisation of the Beta-Ketoacyl-Acyl Carrier Protein Synthases, FabF and FabH, of Yersinia pestis". Scientific Reports. 5: 14797. Bibcode:2015NatSR...514797N. doi:10.1038/srep14797. PMC 4606726. PMID 26469877. - ^ Christensen، Caspar Elo؛ Kragelund، Birthe B.؛ von Wettstein-Knowles، Penny؛ Henriksen، Anette (1 فبراير 2007). "Structure of the human β-ketoacyl [ACP] synthase from the mitochondrial type II fatty acid synthase". Protein Science. ج. 16 ع. 2: 261–272. DOI:10.1110/ps.062473707. ISSN:0961-8368. PMID:17242430.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة)Christensen, Caspar Elo; Kragelund, Birthe B.; von Wettstein-Knowles, Penny; Henriksen, Anette (2007-02-01). "Structure of the human β-ketoacyl [ACP] synthase from the mitochondrial type II fatty acid synthase". Protein Science. 16 (2): 261–272. doi:10.1110/ps.062473707. ISSN 0961-8368. PMC 2203288. PMID 17242430. - ^ Jiang, Wen; Jiang, Yanfang; Bentley, Gayle J.; Liu, Di; Xiao, Yi; Zhang, Fuzhong (1 Aug 2015). "Enhanced production of branched-chain fatty acids by replacing β-ketoacyl-(acyl-carrier-protein) synthase III (FabH)". Biotechnology and Bioengineering (بEnglish). 112 (8): 1613–1622. DOI:10.1002/bit.25583. ISSN:1097-0290. PMID:25788017.