|
تضامنًا مع حق الشعب الفلسطيني |
تخليق الأحماض الدهنية
في الكيمياء الحيوية ، تخليق الأحماض الدهنية fatty acid synthesis هو تكوين الأحماض الدهنية من أسيتيل-CoA وNADPH بواسطة إنزيمات تسمى تركيبات الأحماض الدهنية . تحدث هذه العملية في سيتوبلازم الخلية . يتم اشتقاق معظم أسيتيل- CoA من الكربوهيدرات عبر مسار التحلل السكري ، ثم يتم تحويله إلى أحماض دهنية . كذلك يوفر مسار التحلل الجليكولي أيضًا الجلسرين الذي يمكن أن تتحد به ثلاثة أحماض دهنية (عن طريق روابط الإستر ) لتكوين الدهون الثلاثية (المعروفة أيضًا باسم "ثلاثي الجليسيرول" - لتمييزها عن "الأحماض" الدهنية ) ، وهو المنتج النهائي لعملية تكوين الدهون . عندما يتحد اثنان فقط من الأحماض الدهنية مع الجلسرين وتكون مجموعة الكحول الثالثة مفسفرة بمجموعة مثل الفوسفاتيديل كولين ، فبذلك يتم تكوين الفوسفوليبيد . تشكل الفسفوليبيدات الجزء الأكبر من طبقات الدهون الثنائية التي تكوّن أغشية الخلايا - التي تحيط بالعضيات داخل الخلايا (مثل نواة الخلية ، والميتوكوندريا ، والشبكة الإندوبلازمية ، وجهاز جولجي ، إلخ. ).
أحماض دهنية مستقيمة السلسلة
توجد الأحماض الدهنية ذات السلسلة المستقيمة في نوعين: حمض دهني مشبع وحمض دهني غير مشبع.
أحماض دهنية مستقيمة السلسلة مشبعة

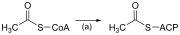
يحدث تخليق الأحماض الدهنية ذات السلسلة المستقيمة من خلال التفاعلات الست المتكررة الموضحة أدناه ، تمامًا مثل أكسدة بيتا ، حتى يتم إنتاج حمض البالمتيك المكون من 16 ذرة كربون . [1] [2]
يوضح الرسم البياني أعلاه كيف يتم تخليق الأحماض الدهنية في الكائنات الحية الدقيقة ، كما تذكر الإنزيمات الموجودة في الإشريكية القولونية . [3] يتم تنفيذ هذه التفاعلات بواسطة إنزيم الحمض الدهني II (ويختصر FASII )، وهو يحتوي بشكل عام على إنزيمات متعددة تعمل كمركب واحد. يوجد إنزيم الحمض الدهني II في بدائيات النوى ، والنباتات والفطريات ، والطفيليات ، وكذلك في المتقدرات (ميتوكوندريا) . [4]
في الحيوانات ، وكذلك في بعض الفطريات مثل الخميرة ، تحدث هذه التفاعلات نفسها على إنزيم الحمض الدهني (FAS I) ، وهو بروتين كبير ذو نويتين يحتوي على جميع الأنشطة الأنزيمية اللازمة لتكوين حمض دهني. إنزيم الحمض الدهني FASII أقل كفاءة من إنزيم الحمض الدهني FAS I ؛ ومع ذلك ، فإنه يسمح بتكوين المزيد من الجزيئات ، بما في ذلك الأحماض الدهنية "متوسطة السلسلة" عن طريق إنهاء السلسلة مبكرا. [5]
بمجرد تكوين حمض دهني كربوني بطول سلسلة 16 ذرة كربون ، يمكن أن يخضع لعدد من التعديلات ، مما يؤدي إلى إزالة التشبع و / أو زيادة الاستطالة. يتم إجراء الاستطالة ، بدءًا من الإستيرات (ذات 18 ذرة كربون ) ، بشكل أساسي في ER بواسطة عدة إنزيمات مرتبطة بالغشاء. الخطوات الأنزيمية المتضمنة في عملية الاستطالة هي في الأساس نفس الخطوات التي يقوم بها تخليق الحمض الدهني ، ولكن يتم تنفيذ الخطوات الأربع الرئيسية المتتالية للاستطالة بواسطة بروتينات فردية ، والتي قد تكون مرتبطة بعضها البعض. [6] [7]
| خطوة | إنزيم | رد فعل | وصف |
|---|---|---|---|
| (أ) | أسيتيل CoA: ترانساسيلاز ACP | ينشط acetyl CoA للتفاعل مع malonyl-ACP | |
| (ب) | Malonyl CoA: ترانساسيلاز ACP | ينشط malonyl CoA للتفاعل مع acetyl-ACP | |
| (ج) | 3-ketoacyl-ACP سينسيز | 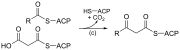 |
يتفاعل سلسلة أسيل المرتبطة بـ ACP مع سلسلة malonyl-ACP الممتدة |
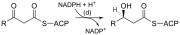
| (د) | اختزال 3-ketoacyl-ACP | يخفض كيتون الكربون 3 إلى مجموعة الهيدروكسيل | |
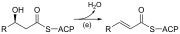
| (هـ) | 3-هيدروكسي أسيل إيه سي بي ديهيدراز | يزيل الماء | |
| (F) | اختزال Enoyl-ACP | يقلل الرابطة المزدوجة C2-C3. | |
| الاختصارات: ACP - بروتين ناقل الأسيل ، CoA - الإنزيم المساعد أ , و NADP - فوسفات نيكوتيناميد الأدينين ثنائي النوكليوتيد . | |||
لاحظ أنه أثناء التخليق الدهني ، يكون العامل المختزل هو NADPH ، بينما NAD هو العامل المؤكسد في أكسدة بيتا (تحلل الأحماض الدهنية إلى أسيتيل-CoA). يمثل هذا الاختلاف مثالًا على مبدأ عام يُستهلك NADPH أثناء تفاعلات التخليق الحيوية ، بينما يتم تكوين NADH من خلال تفاعلات منتجة للطاقة (إنتاج أدينوسين ثلاثي الفوسفات). [8] (وبالتالي ، فإن جزيء NADPH مطلوب أيضًا لتخليق الكوليسترول من أسيتيل-CoA ؛ بينما يتم تكوين NADH أثناء تحلل السكر.). مصادر جزيئات NADPH هي عن طريقين: . عندما يتم نزع الكربوكسيل من المالات بواسطة "إنزيم ماليك المرتبط بـ +NADP " لتكوين البيروفات ، يتم تكوين ثاني أكسيد الكربون CO2 و NADPH. المصدر الثاني ؛ يتكون NADPH أيضًا من مسار فوسفات البنتوز الذي يحول الجلوكوز إلى ريبوز ، والذي يعمل على تخليق النيوكليوتيدات والأحماض النووية ، أو يمكن أن يتقوضه إلى البيروفات. [8] (تلك جزيئات البروفات يمكن أن تنتج طاقة في حالة قيام العضلة بالحركة، فتتحول طاقة البيروفات مباشرة إلى طاقة حركة.)
تحويل الكربوهيدرات إلى أحماض دهنية
في البشر تتكون الأحماض الدهنية من الكربوهيدرات في الغالب في الكبد والأنسجة الدهنية ، وكذلك في الغدد الثديية أثناء الرضاعة.
تعتبر البيروفات الناتجة عن التحلل السكري (ينقسم الجلوكوز إلى أثنين من البيروفات) وسيطًا مهمًا في تحويل الكربوهيدرات إلى أحماض دهنية وكوليسترول. [9] يحدث هذا من خلال تحويل البيروفات إلى أسيتيل-CoA في الميتوكوندريا. ومع ذلك ، يجب نقل مادة الأسيتيل-CoA إلى العصارة الخلوية حيث يحدث تخليق الأحماض الدهنية والكوليسترول. هذا لا يمكن أن يحدث مباشرة. للحصول على أسيتيل-CoA عصاري خلوي ، تتم إزالة السترات (الناتجة عن تكثيف أسيتيل-CoA مع أوكسالأسيتات) من دورة حمض الستريك وتنتقل عبر الغشاء الداخلي للميتوكوندريا إلى العصارة الخلوية. [8] هناك يتم شقها بواسطة ATP-سترات لياز إلى أسيتيل-CoA و أوكسالوأسيتات . يمكن استخدام أوكسالوأسيتات لتكوين السكر (في الكبد) ، أو يمكن إعادتها إلى الميتوكوندريا على شكل مالات. [10] أسيتيل-CoA الموجود في العصارة الخلوية يتم تحويله إلى كربوكسيل بواسطة أسيتيل-CoA كربوكسيلاز ثم إلى مالونيل-كو-أ ، وهي الخطوة الأولى اللازمة لتخليق الأحماض الدهنية. [10] [11]
لا تستطيع الحيوانات إعادة تصنيع الكربوهيدرات من الأحماض الدهنية
الوقود الرئيسي المخزن في أجسام الحيوانات هو الدهون. يبلغ متوسط مخزون الدهون لدى الشاب البالغ حوالي 15–20 كـغ (33–44 رطل) ، ولكنها تختلف اختلافًا كبيرًا حسب العمر والجنس والميراث من الأبوين . [12] في المقابل ، يخزن جسم الإنسان حوالي 400 غ (0.88 رطل) فقط من الجليكوجين ( وهو كربوهيدرات جسمي) ، منها 300 غ (0.66 رطل) مغلق داخل عضلات الهيكل العظمي وغير متوفر للجسم ككل. وكمية 100 غ (0.22 رطل) أو نحو ذلك من الجليكوجين المخزن في الكبد يستهلك خلال يوم واحد عند الجوع. [13] وبعد ذلك يجب تصنيع الجلوكوز الذي يتم إطلاقه في الدم عن طريق الكبد للاستخدام العام من قبل أنسجة الجسم ( وعلى الأخص لعمل الدماغ والكلى) ، من الأحماض الأمينية للجلوكوجينيك وعدد قليل من ركائز الجلوكوز الأخرى ، والتي لا تشمل الأحماض الدهنية. [14]
يتم تقسيم الأحماض الدهنية إلى أسيتيل-CoA عن طريق أكسدة بيتا داخل الميتوكوندريا ، بينما يتم تصنيع الأحماض الدهنية من أسيتيل-CoA خارج الميتوكوندريا في العصارة الخلوية. المساران مختلفان ، ليس فقط في مكان حدوثهما ، ولكن أيضًا في التفاعلات التي تحدث والركائز المستخدمة. المساران مثبطان بشكل متبادل ، ويمنعان أسيتيل-CoA الناتج عن أكسدة بيتا من دخول المسار التوليفي عبر تفاعل أسيتيل-CoA كربوكسيلاز . [15] كما لا يمكن تحويله إلى بيروفات لأن تفاعل إزالة الكربوكسيل من البيروفات لا رجوع فيه. [16] بدلا من ذلك يتكثف مع أوكسالوأسيتات ليدخل في دورة حامض الستريك . خلال كل دورة من الدورة ، تترك ذرتان من الكربون الدورة في صورة ثاني أكسيد الكربون CO2 في تفاعلات نزع الكربوكسيل المحفزة بواسطة نازعة هيدروجين الأيزوسيترات وألفا كيتوجلوتارات ديهيدروجينيز . وبالتالي فإن كل دورة من دورة حمض الستريك تؤكسد وحدة أسيتيل-CoA أثناء تجديد جزيء أوكسالو أسيتات الذي تم دمج أسيتيل-CoA معه في الأصل لتكوين حمض الستريك . تحدث تفاعلات نزع الكربوكسيل قبل تكوين مالات في الدورة. مالات هي المادة الوحيدة التي يمكن إزالتها من الميتوكوندريون لدخول مسار تكوين الجلوكوز لتكوين الجلوكوز أو الجليكوجين في الكبد أو أي نسيج آخر. [14] لذلك لا يمكن أن يكون هناك تحويل صافٍ للأحماض الدهنية إلى جلوكوز.
تمتلك النباتات فقط الإنزيمات اللازمة لتحويل أسيتيل-CoA إلى أوكسالو أسيتات والتي يمكن من خلالها تكوين مالات ليتم تحويلها في النهاية إلى جلوكوز. [15]
- التنظيم
يتم تشكيل أسيتيل-CoA إلى مالونيل-CoA بواسطة أسيتيل-CoA كربوكسيلاز ، وعند هذه النقطة يتم توجيه مالونيل-CoA للتغذية في مسار تخليق الأحماض الدهنية. إن أسيتيل- CoA كاربوكسيلاز هو نقطة التنظيم في تخليق الأحماض الدهنية المشبعة ذات السلسلة المستقيمة ، ويخضع لكل من الفسفرة والتنظيم الخيفي . يحدث التنظيم عن طريق الفسفرة في الغالب في الثدييات ، بينما يحدث التنظيم الخيفي في معظم الكائنات الحية. يحدث التحكم الخيفي كتثبيط التغذية المرتدة بواسطة بالميتويل-CoA والتنشيط بواسطة السترات. عندما تكون هناك مستويات عالية من بالميتويل-CoA ، المنتج النهائي لتخليق الأحماض الدهنية المشبعة ، فإنه يعمل على تعطيل نشاط أسيتيل-CoA كربوكسيلاز لمنع تراكم الأحماض الدهنية في الخلايا. تعمل السيترات على تنشيط أسيتيل-CoA كربوكسيلاز تحت مستويات عالية ، لأن المستويات العالية تشير إلى وجود ما يكفي من أسيتيل-CoA لتغذية دورة كريبس والحفاظ على الطاقة. [17]
تؤدي المستويات العالية من الأنسولين في بلازما الدم (على سبيل المثال بعد الوجبات) إلى إزالة الفسفرة من أسيتيل-CoA كربوكسيلاز ، وبالتالي تعزيز تكوين مالونيل-CoA من أسيتيل-CoA ، وبالتالي تحويل الكربوهيدرات إلى أحماض دهنية ، بينما يتسبب الإيبينيفرين والجلوكاجون (الذي يتم إطلاقه في الدم أثناء الجوع والتمارين الرياضية) في تثبيط تكوين الدهون من خلال الأكسدة بيتا . [9] [18]
الأحماض الدهنية ذات السلسلة المستقيمة غير المشبعة
إزالة التشبع اللاهوائي
تستخدم العديد من البكتيريا المسار اللاهوائي (لا تحتاج الأكسجين) لتصنيع الأحماض الدهنية غير المشبعة. لا يستخدم هذا المسار الأكسجين ويعتمد على الإنزيمات لإدخال الرابطة المزدوجة قبل استطالة السلسلة باستخدام آلية تصنيع الأحماض الدهنية العادية. في الإشريكية القولونية ، هذا المسار مفهوم جيدًا.

تخليق الأحماض الدهنية غير المشبعة عن طريق إزالة التشبع اللاهوائي:
- FabA عبارة عن 3-هيدروكسي ديكانويل- (أسيل-ناقل-بروتين) ديهيدراتاز - وهو خاص بالوسيط لتخليق الأحماض الدهنية المشبعة بـ 10 كربون (β-hydroxydecanoyl-ACP).
- يحفز FabA تجفيف 3-هيدروكسي ديكانويل- (أسيل-ناقل-بروتين) ديهيدراتاز ، مما يتسبب في إطلاق الماء وإدخال الرابطة المزدوجة بين الكربونين C7 و C8 من نهاية الميثيل. هذا يخلق وسيط trans-2-decenoyl.
- يمكن تحويل إما الوسيط trans-2-decenoyl إلى مسار تخليق الأحماض الدهنية المشبعة الطبيعي بواسطة FabB ، حيث يتم تحلل الرابطة المزدوجة ويكون المنتج النهائي عبارة عن حمض دهني مشبع ، أو FabA سوف يحفز الأزمرة في رابطة cis-3-ديسينويل وسيط.
- FabB هو سينثيز بيتا-كيتوأسيل-ACP الذي يطول ويتوسط القنوات في مسار تخليق الأحماض الدهنية السائدة. عندما يتفاعل FabB مع وسيط cis-decenoyl ، فإن المنتج النهائي بعد الاستطالة سيكون حمض دهني غير مشبع.[19]
- الأحماض الدهنية الرئيسية غير المشبعة المصنعة هما Palmitoleoyl-ACP (16: 1ω7) و cis-Vacenoyl-ACP (18: 1ω7)[20]
تحتوي معظم البكتيريا التي تخضع لإزالة التشبع اللاهوائي على متماثلات من FabA و FabB.[20] الكلوستريديا هي الاستثناء الرئيسي ؛ لديهم إنزيم جديد ، لم يتم تحديده بعد ، يحفز تكوين الرابطة المزدوجة cis .[21]
التنظيم
يخضع هذا المسار تنظيم النسخ بواسطة فاد آر الذي هو منظم استقلاب الأحماض الدهنية البروتين فاد آر FadR و فاد آر و FabR. فاد آر هو البروتين الذي تمت دراسته على نطاق واسع ويعزى إلى خصائص ثنائية الوظيفة. يعمل كمنشط لنسخ "فابا" و "فاب" و مثبط لأكسدة بيتا ريجولون. في المقابل ، يعمل FabR كمثبط لنسخ fabA و fabB. [19]
إزالة التشبع الهوائية
إزالة التشبع الهوائية هو المسار الأكثر انتشارًا لتخليق الأحماض الدهنية غير المشبعة. يتم استخدامه في جميع حقيقيات النوى وبعض بدائيات النوى. يستخدم هذا المسار ازالة التشبع لتصنيع الأحماض الدهنية غير المشبعة من ركائز الأحماض الدهنية المشبعة كاملة الطول.[22] تتطلب جميع وسائل إزالة التشبع الأكسجين وتستهلك في النهاية الـ NADH على الرغم من أن إزالة التشبع هي عملية مؤكسدة. تعتبر عمليات ازالة التشبع Desaturases خاصة بالرابطة المزدوجة التي تحفزها في الركيزة. في العصوية الرقيقة فإن ديستيوريو Δ5-Des [10][22]، خاص بإحداث رابطة ثنائية من نوع cis في الموضع Δ5. تحتوي خميرة الجعة على واحد ديستيوريز ، Ole1p ، والذي يحفز الرابطة المزدوجة cis عند Δ9.
في الثدييات ، يتم تحفيز إزالة التشبع الهوائية عن طريق مركب من ثلاثة إنزيمات مرتبطة بالغشاء (اختزال NADH-سيتوكروم b5 ،و سيتوكروم b5 ، و ديساتيوريز desaturase). تسمح هذه الإنزيمات للأكسجين الجزيئي ، O 2 ، للتفاعل مع سلسلة أسيل كو-أ أسيل-CoA الدهنية المشبعة ، وتشكيل رابطة مزدوجة واثنين من جزيئات الماء ، H 2O. يأتي إلكترونان من NADH + H +
واثنان من الرابطة المفردة في سلسلة الأحماض الدهنية. [8] ومع ذلك ، فإن إنزيمات الثدييات هذه غير قادرة على إدخال روابط مزدوجة بين ذرات الكربون بعد ذرة الكربون C-9 في سلسلة الأحماض الدهنية. Δ12) ، أو C-12 و C-15 (= 12 و 15) ، على التوالي ، وكذلك في الموضع Δ9) ، ولا حمض الأراكيدونيك متعدد غير المشبع ، 20 كربون المشتق من لينوليت. هذه كلها تسمى الأحماض الدهنية الأساسية ، مما يعني أنها مطلوبة من قبل الكائن الحي للقيام بعملياته الحيوية ، ولكن لا يمكن توفيرها إلا من خلال النظام الغذائي. (حمض الأراكيدونيك هو مقدمة البروستاجلاندين التي تؤدي مجموعة متنوعة من الوظائف مثل الهرمونات المحلية.[8]
سلسلة الأحماض الدهنية الفردية
الأحماض الدهنية ذات السلسلة الفردية هي تلك الأحماض الدهنية التي تحتوي على عدد فردي من ذرات الكربون. أكثر تلك الأحماض شيوعًا هي مشتقات C15 و C17 المشبعة ، على التوالي حمض البنتاديكانويك وحمض هيبتاديكانويك.[23] يتم توليف الأحماض الدهنية ذات السلاسل الزوجية عن طريق تجميع سلائف أسيتيل-CoA ، ومع ذلك ، يتم استخدام بروبيونيل-CoA بدلاً من أسيتيل-CoA كأساس للتخليق الحيوي للأحماض الدهنية طويلة السلسلة مع عدد فردي من ذرات الكربون. [24]
التنظيم
في العصوية الرقيقة يتم تنظيم هذا المسار بواسطة نظام مكون من عنصرين: DesK و DesK. DesR هو كيناز مرتبط بالغشاء و DesR هو منظم نسخي لجين des. [7] [16] اللائحة تستجيب لدرجة الحرارة ؛ عندما يكون هناك انخفاض في درجة الحرارة ، يتم تنظيم هذا الجين. تعمل الأحماض الدهنية غير المشبعة على زيادة سيولة الغشاء وتثبيته في درجات حرارة منخفضة. DesK هو بروتين المستشعر الذي ، عندما يكون هناك انخفاض في درجة الحرارة ، سوف يتفسف تلقائيًا. سيقوم DesK-P بنقل مجموعة الفوسفوريل الخاصة به إلى DesR. اثنين من بروتينات DesR-P سوف يتناقصان ويربطان بمحفزات الحمض النووي لجين des وتجنيد بوليميراز الحمض النووي الريبوزي لبدء النسخ.[10][22]
اقرأ أيضا
- سينثيز بيتا-كيتوأسيل-ACP
- مرافق الإنزيم-أ
- بروتين حامل الأسيل
- أسيتيل كو-أ
- مالونيل كو-أ
- فاد آر
- ريجولون
- إنزيم الحمض الدهني (FAS I)
- إنزيم الحمض الدهني (FAS II)
- أسيتيل كو-أ كربوكسيليز
مراجع
- ^ Dijkstra، Albert J.؛ Hamilton، R. J.؛ Hamm، Wolf (2008). "§1.4 Fatty Acid Biosynthesis". Trans Fatty Acids. Blackwell. ص. 12. ISBN:9780470698075.
- ^ "MetaCyc pathway: superpathway of fatty acids biosynthesis (E. coli)". biocyc.org. مؤرشف من الأصل في 2023-05-16.
- ^ Dijkstra، Albert J.؛ Hamilton، R. J.؛ Hamm، Wolf (2008). "§1.4 Fatty Acid Biosynthesis". Trans Fatty Acids. Blackwell. ص. 12. ISBN:9780470698075.Dijkstra, Albert J.; Hamilton, R. J.; Hamm, Wolf (2008). "§1.4 Fatty Acid Biosynthesis". Trans Fatty Acids. Blackwell. p. 12. ISBN 9780470698075.
- ^ "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. 30 أبريل 2011. مؤرشف من الأصل في 2011-07-21.
- ^ "Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. 30 أبريل 2011. مؤرشف من الأصل في 2011-07-21."Fatty Acids: Straight-chain Saturated, Structure, Occurrence and Biosynthesis". lipidlibrary.aocs.org. Lipid Library, The American Oil Chemists' Society. 30 April 2011. Archived from the original نسخة محفوظة 21 يوليو 2011 على موقع واي باك مشين. on 21 July 2011.
- ^ "MetaCyc pathway: stearate biosynthesis I (animals)". biocyc.org. مؤرشف من الأصل في 2023-05-16.
- ^ "MetaCyc pathway: very long chain fatty acid biosynthesis II". biocyc.org. مؤرشف من الأصل في 2023-05-16.
- ^ أ ب ت ث ج Stryer، Lubert (1995). Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 559–565, 614–623. ISBN:0-7167-2009-4.
- ^ أ ب Stryer، Lubert (1995). Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 559–565, 614–623. ISBN:0-7167-2009-4.Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 559–565, 614–623. ISBN 0-7167-2009-4.
- ^ أ ب ت ث Ferre، P.؛ Foufelle، F. (2007). "SREBP-1c Transcription Factor and Lipid Homeostasis: Clinical Perspective". Hormone Research. ج. 68 ع. 2: 72–82. DOI:10.1159/000100426. PMID:17344645. مؤرشف من الأصل في 2023-05-16. اطلع عليه بتاريخ 2010-08-30.
this process is outlined graphically in page 73
- ^ Voet، Donald؛ Voet، Judith G.؛ Pratt، Charlotte W. (2006). Fundamentals of Biochemistry (ط. 2nd). John Wiley and Sons, Inc. ص. 547, 556. ISBN:0-471-21495-7.
- ^ Sloan، A.W؛ Koeslag، J.H.؛ Bredell، G.A.G. (1973). "Body composition work capacity and work efficiency of active and inactive young men". European Journal of Applied Physiology. ج. 32: 17–24. DOI:10.1007/bf00422426.
- ^ Stryer، Lubert (1995). Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 581–602, 613, 775–778. ISBN:0-7167-2009-4.
- ^ أ ب Stryer، Lubert (1995). "Fatty acid metabolism". Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 603–628. ISBN:0-7167-2009-4.
- ^ أ ب Stryer، Lubert (1995). "Fatty acid metabolism". Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 603–628. ISBN:0-7167-2009-4.Stryer, Lubert (1995). "Fatty acid metabolism". Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 603–628. ISBN 0-7167-2009-4.
- ^ Stryer، Lubert (1995). Biochemistry (ط. Fourth). New York: W.H. Freeman and Company. ص. 581–602, 613, 775–778. ISBN:0-7167-2009-4.Stryer, Lubert (1995). Biochemistry (Fourth ed.). New York: W.H. Freeman and Company. pp. 581–602, 613, 775–778. ISBN 0-7167-2009-4.
- ^ Diwan، Joyce J. (30 أبريل 2011). "Fatty Acid Synthesis". Rensselaer Polytechnic Institute. مؤرشف من الأصل في 2011-06-07.
- ^ Voet، Donald؛ Voet، Judith G.؛ Pratt، Charlotte W. (2006). Fundamentals of Biochemistry (ط. 2nd). John Wiley and Sons, Inc. ص. 547, 556. ISBN:0-471-21495-7.Voet, Donald; Voet, Judith G.; Pratt, Charlotte W. (2006). Fundamentals of Biochemistry (2nd ed.). John Wiley and Sons, Inc. pp. 547, 556. ISBN 0-471-21495-7.
- ^ أ ب Feng، Youjun؛ ECronan، John (2011). "Complex binding of the FabR repressor of bacterial unsaturated fatty acid biosynthesis to its cognate promoters". Molecular Microbiology. ج. 80 ع. 1: 195–218. DOI:10.1111/j.1365-2958.2011.07564.x. PMC:4072462. PMID:21276098.
- ^ أ ب Wang، Haihong؛ ECronan، John (2004). "Functional replacement of the FabA and FabB proteins of Escherichia coli fatty acid synthesis by Enterococcus faecalis FabZ and FabF homologues". Journal of Biological Chemistry. ج. 279 ع. 33: 34489–95. DOI:10.1074/jbc.M403874200. PMID:15194690.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعClostridium - ^ أ ب ت Mansilla MC، de Mendoza D (مايو 2005). "The Bacillus subtilis desaturase: a model to understand phospholipid modification and temperature sensing". Arch Microbiol. ج. 183 ع. 4: 229–35. DOI:10.1007/s00203-005-0759-8. PMID:15711796. S2CID:26880038.
- ^ Pfeuffer، Maria؛ Jaudszus، Anke (2016). "Pentadecanoic and Heptadecanoic Acids: Multifaceted Odd-Chain Fatty Acids". Advances in Nutrition. ج. 7 ع. 4: 730–734. DOI:10.3945/an.115.011387. PMC:4942867. PMID:27422507.
- ^ Smith، S. (1994). "The Animal Fatty Acid Synthase: One Gene, One Polypeptide, Seven Enzymes". The FASEB Journal. ج. 8 ع. 15: 1248–1259. DOI:10.1096/fasebj.8.15.8001737. PMID:8001737. S2CID:22853095.
| تخليق الأحماض الدهنية في المشاريع الشقيقة: | |