|
تضامنًا مع حق الشعب الفلسطيني |
مزرين
| مزرين | |
|---|---|
| اعتبارات علاجية | |
| معرّفات | |
| CAS | 34807-41-5 |
| بوب كيم | CID 248997019 |
| كيم سبايدر | 21242853 |
| بيانات كيميائية | |
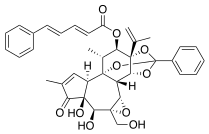
| الصيغة الكيميائية | C38H38O10 |
| الكتلة الجزيئية | غرام لكل مول |
| تعديل مصدري - تعديل | |
مزرين هو مركّب عضوي سام من إستر الديتيربين موجود بشكل طبيعيّ في عصارة نبات المازريون، والنباتات المثنانية الأخرى. تمتلك نباتات الفصيلة الفربيونية والفصيلة المثنانية مجموعة متنوعة من إسترات الفوربول المختلفة، والتي تتميّز جميعها بقدرتها على محاكاة مركّب ثنائي الغليسريد، ومن ثمّ تنشيط الأشكال الإسوية المختلفة من كيناز البروتين سي.
عُزل مُركّب المزرين لأول مرة في عام 1975. تحتوي جميع أجزاء النباتات على عصارة لاذعة ومهيجة تتضمّن مادة المزرين، والتي يُعتقد أنها المادة السامة الرئيسية في عصارة النبات. يكون النسغ أكثر انتشاراً في اللحاء والثمار.
الخصائص
يمتلك مُركّب المزرين خصائصاً مضادة لابيضاض الدم في الفئران، ولكنه أيضًا محفزاً ضعيفاً لسرطان الجلد في الفئران.[1]
مُركّب المزرين شديد الذوبان في الدهون ويمكن أن يسبب ابتلاعه القيء والإسهال، وحرق الفم، وعند تناول جرعة كبيرة منه، يمكن أن يسبّب مجموعة أعراض من بينها الارتعاد، واتساع حدقة العين، وتلف الممرات الفموية والأمعاء، والتي قد تفضي في النهاية إلى الموت. يمكن أن يسبّب مُركّب المزرين أيضًا تهيجاً الجلد، وقد يؤدي إلى حدوث تلف طفيف في الأوردة يسبب احمرار لون الجلد. وبسبب هذا الاحمرار، استخدمت عصارة النبات قديماً كمحمّر للشفاه.[1]
التاريخ والاستخدامات
يوجد مُركّب المزرين في نبات المازريون.[1] استخدم هذا النبات قديماً في صناعة الأصباغ، وعلاج الروماتيزم، والقرح البطيئة، واستخدم كمادة للتجميل.[2][3] استخدم النبات في المعالجة المثلية في المقام الأول لعلاج اضطرابات الجلد ولكنه وُصف أيضًا لعلاج القلق المرتبط باضطرابات الجهاز الهضمي والاحتقان.[4] توقّفت جميع هذه الاستخدامات بمجرد اكتشاف سمّية النبات، كما أدت هذه السمّية أيضًا إلى ظهور استخدامات جديدة للنبات مثل استخدام ثماره للانتحار.[5]
المزرين والدافنيتوكسين
توجد سموم المزرين والدافنيتوكسين في جنس نباتات الدفنة. يحتوي مُركّب الدافنيتوكسين على هيكل مشابه للميزرين، مع فقدان جزء الفينيل-بنتادينويل الموجود في أعلى يسار البنية الجزيئيّة للميزرين. يُعتبر كل من المزرين والدافنيتوكسين مُركّباً منشطاً لكيناز البروتين سي ولكن بطريقة مختلفة، كما يظهر المزرين خصائص مضادة لسرطان الدم، بينما لا يظهرها الدافنيتوكسين.[6]
آلية العمل
يندرج مُركّب المزرين ضمن فئة مرّكبات المرحلة الثانية من محفزات الأورام. تتكوّن الأورام السرطانيّة على ثلاثة مراحل، وهي مرحلة بدء الورم، ثم مرحلة تعزيز الورم، وأخيراً مرحلة تقدّم الورم. تحدث في المرحلة الأولى طفرة جينية مصحوبة بتغيّر وظيفيّ، وغالبًا ما تحدث هذه الطفرات في الجينات الورمية، أو التسلسلات التنظيمية. وفي مرحلة التعزيز، تتفاعل هذه الطفرات مع مسارات الإشارات الخلوية، ممّا يؤدّي إلى نمو الخلايا المبتدئة. وفي المرحلة الأخيرة، وهي مرحلة تقدّم الورم، تحدث طفرات إضافية فيصبح الورم غير مستقر من حيث النمط النووي، وتحدث تغيرات مورفولوجية في التركيب الصبغي الطبيعي. تؤدي هذه المراحل الثلاث إلى تكوّن ورماً خبيثاً مفرط الانتشار، وتفقد البيئة الخلوية قدرتها على السيطرة عليه، ويكون هناك خطراً متزايداً من أن تحوّر الخلايا السرطانية جينات أخرى. لا تمتلك محفزات الأورام في المرحلة الثانية مثل مُركّب المزرين القدرة على بدء الأورام، ولكن يمكنها أن تخلق ظروفًا تكون فيها الخلايا المبتدئة أكثر عرضة لطفرات إضافية، أو تجعل الخلايا المبتدئة قادرة على النمو.[7] ومن ثمّ لا يسبّب مُركّب المزرين طفرات بحد ذاته، ولكنه يعزّز نمو الورم من خلال التداخل مع مسارات الإشارات الخلوية.
يتفاعل مُركّب المزرين، وإسترات الفوربول الأخرى مع كيناز البروتين سي، ويتحكم كيناز البروتين سي في دورة الخلية، لذا فإن المواد الكيميائية التي تتفاعل معها يمكن أن يكون لها تأثيرات تكاثرية أو مضادة للتكاثر. عادة ما يعمل ثنائي الغليسريد على تنشيط كيناز البروتين سي. عند ارتباط ثنائي الغليسريد بكيناز البروتين سي، يزداد تقارب كيناز البروتين سي لأيونات الكالسيوم الثنائي، وتزداد إينوزيتولات الفوسفور الغشائية. وعندما ترتبط أيونات الكالسيوم الثنائي، ترتبط مجموعة أيونات الكالسيوم الثنائي وثنائي الغليسريد وكيناز البروتين سي جميعها بغشاء البلازما عن طريق الارتباط بغشاء إينوزيتولات الفوسفور. يُمكن لكيناز البروتين سي الآن أن يفسفر ركائز مختلفة، ممّا يؤثر على نشاط العديد من المسارات داخل الخلايا التي تنظم دورة الخلية وموت الخلايا المبرمج من بين أمور أخرى. يكون ارتباط كيناز البروتين سي بغشاء البلازما قابلاً للانعكاس، حيث يتحلّل مركب ثنائي الغليسريد إنزيميّاً بعد فترة قصيرة من الوقت، مما يتسبب في تغيّر تكوين كيناز البروتين سي، وفصله من الغشاء البلازمي، وتوقّف فسفرة الركائز.
يرتبط مُركّب المزرين بكيناز البروتين سي بدلاً من مُركّب ثنائي الغليسريد، نظراً لأن تجاذب كيناز البروتين سي مع المزرين أعلى من تجاذبه مع ثنائي الغليسريد، ولا يمكن أن يتحلل بسهولة مثل ثنائي الغليسريد. لذا يظل كيناز البروتين سي نشط التكوينعندما يكون مرتبطاً بالمزرين لفترة أطول بكثير مما يحدث عادةً، كما أنّه لا يكون بحاجة إلى أيونات الكالسيوم الثنائية لتنشيطه. يسبّب هذا تحفيزًا مفرطًا للمسارات التي يبدأها كيناز البروتين سي، ممّا يؤدّي إلى مزيد من الانتشار الخلوي، ويقلّ موت الخلايا المبرمج.[8] وعلى العكس، يؤدي التنشيط المزمن لكيناز البروتين سي إلى تأثير سلبي، وهو أي موت الخلايا المبرمج.
يمكن أن يكون لمُركّب المزرين خصائص مسرطنة وأخرى غير مسرطنة، فعادةً ما تسبّب الجرعات المنخفضة منه تأثيرًا مفيدًا، بينما تسبّب الجرعات العالية تأثيرًا سامًا. تُستخدم جرعات عالية من مُركّب المزرين في بعض الأحيان لتمييز الخلايا السرطانية بشكل نهائي، ولمنع نموها.[9][10]
المراجع
- ^ أ ب ت Robertson، John. "The Poison Garden". The Poison Garden website. Robbo Services Ltd. مؤرشف من الأصل في 2020-02-10. اطلع عليه بتاريخ 2013-03-28.
- ^ Plants، Practical (12 سبتمبر 2012). "Practical Plants". Daphne mezereum. مؤرشف من الأصل في 2015-01-08. اطلع عليه بتاريخ 2013-03-28.
- ^ "Daphne mezereum - L." Plants For A Future. Plants For A Future. 2012. مؤرشف من الأصل في 2011-06-04. اطلع عليه بتاريخ 2013-03-28.
- ^ "Mezereum Homeopathy Information". Beneforce. مؤرشف من الأصل في 2018-10-10. اطلع عليه بتاريخ 2013-03-28.
- ^ Dybedahl، Calle. "Suicide Faq". مؤرشف من الأصل في 2021-10-07. اطلع عليه بتاريخ 2013-03-27.
- ^ Saraiva L.؛ Fresco، Paula؛ Pinto، Eugénia؛ Portugal، Helena؛ Gonçalves، Jorge (2001). "Differential Activation oby Daphnetoxin and Mezerein of PKC-Isotypes α, βI, δ and ζ". Planta Medica. ج. 67 ع. 9: 787–790. DOI:10.1055/s-2001-18843. PMID:11745011.
- ^ Koenderink، Jan (2013). "Chemical carcinogenesis" (PDF). مؤرشف من الأصل (PDF) في 2017-05-10. اطلع عليه بتاريخ 2013-04-01.
- ^ Black A، Black J (2013). "Protein kinase C signaling and cell cycle regulation. Review". Front Immunol. ج. 3 ع. 423: 423. DOI:10.3389/fimmu.2012.00423. PMC:3547298. PMID:23335926.
- ^ Huynh KM، Soh JW، Dash R، Sarkar D، Fisher PB، Kang D (2010). "FOXM1 Expression Mediates Growth Suppression During Terminal Differentiation of HO-1 Human Metastatic Melanoma Cells". J. Cell. Physiol. ج. 226 ع. 1: 194–204. DOI:10.1002/jcp.22326. PMID:20658516. S2CID:206049407.
- ^ Bögi K، Lorenzo PS، Szállázsi Z، Ács P، Wagner GS، Blumberg PM (1998). "Differential Selectivity of Ligands for the Cla and Clb Phorbol Ester Binding Domains of Protein Kinase Co: Possible Correlation with Tumor promoting Activity". Cancer Research. ج. 58 ع. 7: 1423–1428. PMID:9537243.
| مزرين في المشاريع الشقيقة: | |