|
تضامنًا مع حق الشعب الفلسطيني |
ابيضاض الدم
| ابْيِضَاضُ الدَّم؛ لوكيميا | |
|---|---|
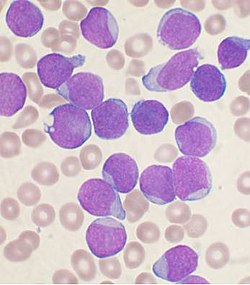 لُطاخَةُ من نخاع العظم مصبوغة بصبغة رايت "Wright's" لشخص يعاني من ابْيِضاضُ الأَرُوْمَاتِ اللِّمْفَاوِيَّة الحاد مع السلائف الخلايا البائية.
| |
| النطق | /luːˈkiːmiːə/ |
| معلومات عامة | |
| الاختصاص | علم الدم وعلم الأورام |
| تعديل مصدري - تعديل | |
ابيضاض الدَّم[1] أو اللوكيميا (بالإنجليزية: Leukemia) هو مرض سرطان يُصيب الأنسجة التي تشكِّل الدم في الجسم، بما في ذلك نخاع العظم والجهاز اللِّمفي.[2] واللوكيميا ضمن مجموعة من سرطانات أورام الأنسجة المولدة للدم والأنسجة اللمفاوية التي تبدأ عادةً في نخاع العظام وتؤدي إلى ارتفاع عدد خلايا الدم غير الطبيعية.[3] خلايا الدم هذهِ بدائية أي غير ناضجة وغير متمايزة تُسمى «خلايا أرومية».[4] قَد تشمل أعراض اللوكيميا النزيف والرَّضات وآلام العظام والإعياء والحمى وزيادة خطر الإصابة بالالتهابات. تحدث هذه الأعراض بسبب نقص خلايا الدم الطبيعية، يتم التشخيص الإصابة باللوكيميا عادةً عن طريق تحليل الدم أو بفحص نخاع العظم.[4] السبب الدقيق للإصابة بابيضاض الدَّم مازال غير معروف. ومن الممكن أن تلعب العوامل الوراثية والظروف البيئية دوراً في الإصابة بسرطان الدم.[5][6] العوامل التي تزيد فرصة حدوث سرطان الدم هي التدخين والإشعاع الأيوني وبعض المواد الكيميائية مثل حلقة البنزين أو في حال الخضوع لعلاج كيميائي مسبق ومتلازمة داون.[5] الأشخاص الذين لديهم تاريخ عائلي بمرض سرطان الدم تزداد نسبة إصابتهم.[6] يوجد أربعة أنواع رئيسية لسرطان الدم وهي سرطان الدم الليمفاوي المزمن، سرطان الدم النخاعي الحاد، سرطان الدم الليمفاوي الحاد، سرطان الدم النخاعي المزمن وهنالكَ أنواع أخرى ولكن غير شائعة.[6][7] سرطان الدم وسرطان الغدد الليمفاوية يندرجان تحت نوع السرطان الذي يؤثر على الدم ونخاع العظم ونظام الغدد الليمفاوية وتسمى بأورام مكونات الدم والأنسجة الليمفاوية.[8][9] علاج سرطان الدم يتضمَّن مزيج من العلاج الكيميائي والإشعاعي والعلاج المُستهدف وزرع نخاع العظم والرعاية المساندة والمسكنة للآلام. بعض أنواع سرطان الدم الانتظار اليقظ.[6] نجاح العلاج يعتمد على نوع سرطان الدم وعمر المصاب. نتائج العلاج متطورة في البلدان المتقدمة.[7] معدل عيش المصابين لمدة 5-سنوات هو 57% بالولايات المتحدة.[10] الأطفال الذينَ يقلُّ عمرهم عن 15 سنة معدل النجاة لمدة 5-سنوات يقاس 60-85% بالاعتماد على نوع السرطان.[11] إنَّ الأطفال الذين أُصيبوا بسرطان الدم الحاد ثم تعالجوا وبقوا أصحَّاء لمدة 5-سنوات هم في الأغلب لن يعانوا من عودة السرطان مرة أخرى.[7] عام 2012 ,352 ألف شخص أُصيبوا بسرطان الدم حول العالم وأدَّى ذلك إلى وفاة 265 ألف حالة.[7] يعتبر سرطان الدم هو الأكثر شيوعاً بين الأطفال، ثلاثة أرباع الأطفال المصابينَ مصابينَ بنوع سرطان الدم الحاد.[6] ومع ذلك، فإنَّ 90% من سرطان الدم يتم تشخيصه بالبالغينَ وغالباً يكون النوع سرطان الدم المزمن أو سرطان الغدد الليمفاوية الحاد.[6] وأعلى نسب تكون في البلدان المتقدمة.[7]
في دراسة أجرتها مجموعة الشرق الأوسط لأبحاث السرطان أظهرت إصابة 515 شخص في مصر ما بين العامين 1999-2001 و 1354 شخص في الأردن بابيضاض الدم ما بين عامي 1996-2001. ويسمَّى أيضاً باللوكيميا أو سرطان الدم يبدأ هذا المرض في نخاع العظام وينتشر إلى الأجزاء الأخرى من الجسم.[12]
التصنيف
التصنيف العام
أنواع سرطان الدم \ تصنيفاتهم:
| نوع الخلية | حاد | مزمن |
|---|---|---|
| ابيضاض دم لمفاوي
(أو "ابيضاض الأرومات اللمفاوية") |
ابيضاض الدم الليمفاوي الحاد
(ALL) |
ابيضاض الدم الليمفاوي المزمن
(CLL) |
| ابيضاض الدم النقوي الحاد
(AML أو الأرومات النقوية) |
ابيضاض الدم النقوي المزمن
(CML) |
ابيضاض دم نقوي
("نخاعي" أو "غير لمفاوي") |

سرطان الدم يُصنَّفُ سريريَّاً ومرضيَّاً إلى عدة أنواع وأوًل نوع يتضمَّن حدة المرض (حاد، مزمن):
- السرطان الحاد يتصف بزيادة في عدد خلايا الدم غير الناضجة ممَّا يجعل نخاع العظم مزدحم بهذه الخلايا فتقل قدرته على إنتاج خلايا طبيعية. سرطان الدم الحاد يتطلب علاج فوري بسبب التطور السريع وتجمع الخلايا السرطانية التي تخرج من الدم وتنتشر إلى أعضاء أخرى. إنَّ سرطان الدم الحاد هو الأكثر شيوعا بين الأطفال.
- السرطان المزمن يتصف بوجود عدد كبير من الخلايا البيضاء الناضجة نسبياً ولكنها تمتلك شكلا غير طبيعي. خلايا الدم البيضاء في العادة تحتاج إلى شهور أو سنوات لتنضج ولكن في هذه الحالة خلايا الدم البيضاء تنتج بسرعة عالية مما يؤدي إلى وجود عدد كبير من خلايا البيضاء غير الطبيعية. يستلزم سرطان الدم الحاد معالجة فورية، بينما سرطان الدم المزمن يستلزم مراقبة لفترة معينة قبل تطبيق العلاج وذلك لضمان التأثير الأكبر الممكن للمعالجة. سرطان الدم المزمن عادةً يصيب كبار السن ومن الممكن أنْ يحصل أيضاً ضمن أيِّ فئة عمرية.
بالإضافة إلى أنَّه يمكن تقسيم سرطان الدم حسب نوع خلية الدم المتأثرة، فيتم تقسيم سرطان الدم إلى سرطان الأنسجة الليمفاوية وسرطان نخاع العظم.
- في سرطان الأنسجة الليمفاوية، التغيُّر السرطاني يحدث في نوع من خلايا النخاع العظمي والتي عادةً ما تتحول أو تُكوِّن خلايا الليمف والتي تُعد خلايا مناعية تهاجم المرض؛ أغلب سرطانات الأنسجة الليمفاوية تحتوي على نوع بيتا من خلايا الليمف.
- في سرطان نخاع الدم، يحدث التغير السرطاني في خلايا نخاع العظم التي تُكوِّن عادة خلايا الدم الحمراء، وبعض أنواع خلايا الدم البيضاء والصفائح الدموية.
الجمع بين هذين التصنيفين يوفِّر أربع فئات رئيسية. داخل كل فئة من هذه الفئات الرئيسية هناك عادةً عدَّة فئات فرعية. وأخيراً، تُعتبر بعض الأنواع نادرةً وعادةً ما تكون خارج نظام هذا التصنيف.
أنواع خاصة
- ابيضاض الدم الليمفاوي الحاد (ALL) هي أكثر الأنواع شيوعاً في الأطفال، كما أنَّه يصيب البالغين خصوصاً الذين تزيد أعمارهم عن 65 سنة. العلاج يتضمَّن علاج كيميائي وإشعاعي. معدل النَّجاة يختلف حسب عمر المريض 85% عند الأطفال و50% عند البالغين.[13] فروع هذا النوع هي سرطان النسيج اللمفاوي الحاد لخلايا B ، سرطان النسيج اللمفاوي الحاد لخلاياT، سرطان البيركت، سرطان الدم الحاد الذي له تمثيلان شكليان.
- ابيضاض الدم الليمفاوي المزمن (CLL) والذي غالباً ما يصيب البالغين فوق جيل 55. وغالباً ما يصيب البالغين ولا يصيب الأطفال، وثلثي الأشخاص المصابين هم من الذكور. معدل النجاة لمدة 5 سنوات هو 75%.[14] السرطان المزمن غير قابل للشفاء، ولكنْ هنالكَ العديد من العلاجات الفعَّآلة. ولسرطان الدم المزمن يوجد تصنيف فرعي واحد وهو ابيضاض خلايا السليفة الليمفاوية ب والذي يعتبر مرض أكثر عدوانية.
- ابيضاض الدم النقوي الحاد (AML) عادةً يصيب البالغين أكثر من الأطفال كما أنَّه يصيب الذكور أكثر من الإناث. يمكن علاجه بالعلاج الكيميائي. معدل النجاة لمدة 5 سنوات هي 40% ما عدا سرطان الدم الحاد البرولمفوسين الذي يمثل نسبة 90%.[15] فروع ابيضاض الدم النقويّ الحاد هي سرطان الدم البرولمفوسايت الحاد، سرطان الدم الميوبلاستي الحاد الذي يؤثر على الخلايا العضلية الجذعية وmegakaryoblastic leukemia.
- ابيضاض الدم النقوي المزمن (CML) يحدث غالباً في البالغين ويصيب عدد قليل جدا من الأطفال. يتم علاجه بدواء Lmatnib أو أدوية أخرى.[16] معدل النجاة لخمس سنوات 90%.[17][18] وله فرع واحد هو Chomic myelommocytic leukemia.
- سرطان الدم الزغبي (سرطان الدم بالخلايا المشعرة)Hairy cell leukemia)HCL) هو نوع من أنواع سرطان الخلايا الليمفية المزمن، ولكنَّه لا يتناسب تماماً مع هذه الفئة. 80% من المصابين هم ذكور بالغين.لم يُذكر أنَّه تمَّ تسجيل أيِّ حالة في الأطفال.يوجد علاجات له لكن لا يمكن الشفاء منه. معدل النجاة من 96 إلى 100% خلالَ عشر سنوات.[19]
- (T-PLL) (Tcell prolymphocytic leukemia) هو مرضٌ نادرٌ جدَّاً وخطير ويؤثر على البالغين وغالباً تأثيره على الذكور أكثر من الإناث.[20] بالرغم من نُدرته، إلّا أنَّه الأكثر شيوعا من سرطانات الدم التي تُصيب خلايا ال Tcell,[21] أغلب أنواع سرطانات الدم تؤثر على ال Bcel. يصعب علاجه ومعدل النجاة يقاس بالأشهر فقط.
- سرطان الدم الليمفي الذي يصيب الحبيبات الكبيرة وهي إمَّا تحوي Tcell أو NKcells، هو مرض نادر مثل سرطان الدم الزغبي، والذي يحدث فقط في الخلايا B وهو غير عدواني.[22]
- سرطان الدم الي يصيب خلايا T البالغة. هو ناتج عن فيروس يسمى بالفيروس البشري الذي يصيب Tcell (HTLV) وهو فيروس شبيه بل HIV؛ حيثُ كلاهما يصيب خلايا CD4+ Tcell ويتضاعف فيها. على أيَّة حالٍ، هو يختلف عن فيروس HIV في كونه لا يدمِّر هذه الخلايا. بدلاً من ذلك، HTLV «يُخلِّد» خلايا T المصابة، مما يتيح لهم القدرة على التكاثر بشكل غير طبيعي. فيروس خلية T البشرية النوعين الأول والثاني منه (HTLV-I / II) مُستوطنة في مناطق مُحددة في العالم.
الأعراض والعلامات

في سرطان الدم يتم استبدال خلايا نخاع العظم الطبيعية بأعدادٍ كبيرة من خلايا الدم البيضاء غير النَّاضجة ممَّا يُؤدِّي إلى تحطيم نخاع العظم ونتيجة لذلك يقل عدد الصفائح الدموية التي تساعد في الوضع الطبيعي في عملية تجلُّط الدم. مما يعني أنَّ الأشخاص المصابين يصابون بكدمات بسهولة ويعانون من النزيف الزائد ويتكون لديهم نزيف على سطح الجلد أو ما يُسمَّى بالنمشات. خلايا الدم البيضاء (المسؤولة عن محاربة الكائنات الممرضة). سيقل عددها أو ستخسر وظيفتها الطبيعية. مما يؤدي إلى ضعفٍ بالجهاز المناعي فيصبح غير قادر على مواجهة الالتهابات البسيطة أو يبدأ بمحاربة خلايا الجسم الأخرى. يعاني مصاب سرطان الدم من الاتهابات المتكررة بسبب ضعف جهاز المناعة وهذه الالتهابات تتراوح بين التهاب اللوزين أو قرحة بالفم أو الإسهال إلى الالتهاب الرئوي أو الالتهابات بالكائنات الانتهازية. كما أنَّ عدد خلايا الدم الحمراء يقل مما يؤدي إلى فقر الدم والتي بدورها تسبب الشحوب وقصر النفس. بعض المصابين يعانون من أعراض أخرى مثل الشعور بالمرض، ارتفاع درجة الحرارة، التعرُّق خلال الليل، الشعور بالإرهاق وأعراض أُخرى تُشابه الأعراض المُصاحبة للإنفونزا. كما من الممكن أن يشعر الشخص بالغثيان والامتلاء بسبب تضخم الكبد والطحال مما يؤدي إلى نقص الوزن غير المقصود. الخلايا غير النَّاضجة قد تتجمع وتشكل انتفاخ بالكبد أو العقد الليمفية ممَّا يؤدِّي إلى الشعور بالألم وتؤدي إلى الشعور بالغثيان.[23]
إذا اجتاحت الخلايا السرطانية الجهاز العصبي المركزي ستظهر أعراض وعلامات عصبية أهمّها الصداع. ومن الأعراض الأخرى: الصداع النصفي والتشنجات العصبية كما أنَّ ارتفاع الضغط على جذع الدماغ يؤدي إلى حدوث حالات الإغماء. يُذكر أنَّ جميع هذه الأعراض قد ترتبط بأمراض أخرى ولهذا سرطان الدم يتم تشخيصه عن طريق فحوص طبية. كلمة سرطان الدم (تعني ابيضاض الدم) مشتقة من وجود أعداد كبيرة من خلايا الدم البيضاء. تظهر هذه الأعداد عند فحص عينة من الدم باستخدام المجهر. وتكون هذه الخلايا الزائدة ذات أشكال غير طبيعية أو وظيفة غير طبيعية. كما أنَّ وجود عدد كبير من خلايا الدم البيضاء يؤثِّر على أعداد خلايا الدم الأُخرى مما يؤدي إلى اختلال في توازن كمية الدم.
بعض المصابين بسرطان الدم لا يكون عندهم ارتفاع في خلايا الدم البيضاء عند إجراء فحص تعداد الدم وهذه الحالة تسمى ندرة الكريات البيض (aleukemia) وفي هذه الحالة يحتوي نخاع العظم على خلايا دم بيضاء سرطانية تعمل على تدمير الخلايا الطبيعية المسؤولة عن إنتاج خلايا الدم ، أما الخلايا السرطانية نفسها تبقى في نخاع العظم بدلاً من الخروج إلى الدم. من الممكن أن يحدث ندرة الكريات البيض في الأربع أنواع السابقة من سرطان الدم ولكن الأكثر شيوعاً هو مُصاحباً لسرطان الدمي الزغبي.[24] إن امتلاء نخاع العظم بالخلايا السرطانية يثبط عملية بناء خلايا دم طبيعية مما يؤدي إلى نقص في كريات الدم الحمراء (أنيميا) وقصٍ في الصفائح الدموية، والتي تلعب دوراً أساسيَّاً في عملية تخثر الدم. من هنا، قد يعاني مرضى ابيضاض الدم من النزيف الذي غالبًا ما يحدث في اللثة، أو سطح الجلد ويظهر كبقع نزف صغيرة تحت الجلد بحجم رأس الإبرة تُعرف باسم الحبرات.
الأسباب
لا يوجد سبب محدد لهذا السرطان، يوجد بضعة أسباب تسبب بضعة أنواع منه.[25] السبب وراء أغلب أنواعه غير معروف، قد تكون الاسباب بسبب التاريخ العائلي للمرض والإشعاع المؤين والعلاج الكيميائي، ويختلف السبب باختلاف نوع السرطان. سرطان الدم ينتج عن طفرة بالمادة الوراثية من خلال تفعيل الجينات المسرطنة أو تعطيل الجينات الكابتة للورم وبالتالي تعطيل تنظيم موت الخلايا، والتمايز أو التقسيم هذه الخطوات من الممكن أن تحدث تلقائيَّاً (أي بدون أي مؤثر خارجي) أو من الممكن أنْ تحدث بسبب التعرُّض لإشعاع أيوني أو مواد مسرطنة . تعد الإشعاعات الأيونية الطبيعية والصناعية هي السبب الأكثر شيوعاً في البالغين كما أنَّ بعض الفيروسات كالفيروس البشري للنسيج اللمفاوي وبعض الكيماويات خصوصاً البنزين والمعالجة القاعدية الكيميائية قد تؤدي إلى هذا السرطان.[26][27][28][29] إنَّ التدخين يزيد خطورة الإصابة بسرطان الدم النخاعي الحاد عند البالغين بنسبة بسيطة.[27] من خلال بعض الدراسات مثل دراستي كوهورت و(حالة-تحكم) تم ربط التعرض لبعض الكيماويات البترولية وصبغات الشعر بالإصابة بسرطان الدم. إنَّ النِّظام الغذائي ليس له دور في الإصابة لكن تناول الخضروات قد يحمي.[25] الفيروسات التي تمَّ إعازتها لهذا السرطان ومنها الفيروس البشري للنسيج Tاللمفاوي الذي يسبب سرطان الدم لخلايا T الليمفاوية البالغة.[30] بعض الأفراد لديهم عامل وراثي لتطوُّر سرطان الدم والذي يُحدَّد عن طريق تاريخ العائلة ودراسات توين Twin study.[27] إنَّ الناس المصابين لديهم جين واحد أو عدة جينات مشتركة. في بعض العائلات، الأفراد يصابون بنفس النوع من سرطان الدم وفي البعض الآخر يصابون بأنواع مختلفة أو أنواع مختلفة من السرطانات المرتبطة بالدم.[27] الأفراد الذين يعانون من شذوذات كروموسوميه لديهم نسبة أكبر بالإصابة بهذا السرطان.[28] فعلى سبيل المثال، المُصابين بمتلازمة داون لديهم نسبة خطر أكبر للإصابة بسرطان الدم (خصوصاً سرطان الدم الحاد).[27] كذلك وجود طفرة في جينspred1 له دور بالإصابة بسرطان الدم خلال الطفولة.[31] يتمُّ دراسة قدرة الإشعاعات غير المؤيَّنة على التسبب في مرض ابيضاض الدم منذ عقود عديدة. أخذت مجموعة عمل أخصائيّي المنظمة العالمية لأبحاث السرطان على عاتقها البحث المُفصل في جميع البيانات حول حقول الطاقة الكهرومغناطيسية الساكنة وذات التردد المنخفض التي تظهر طبيعيا عند توليد ونقل واستخدام الطاقة الكهربائية، توصَّلوا إلى أنَّ هناك أدلَّة محدودة على أنَّ التعرض لكميات كبيرة من الموجات المغناطيسية منخفضة التردد قد تسبب بعض أنواع ابيضاض الدم لدى الأطفال ولم يتم إثبات أي علاقة مع سرطانات الدم الأخرى والأورام لدى الكبار . حيث أنَّ التعرض لمثل تلك الكميات (إذا تم إثباته كعامل مسبب) أمر غير شائع . توصلت منظمة الصحة العالمية أنَّ مثل تلك الإشعاعات تسبب 100-2400 حالة من ابيضاض الدم لدى الأطفال سنويَّاً ما نسبته 0.2 إلى 4.9% من حالات ابيضاض دم الأطفال في تلك السنة وما نسبته 0.03-0.9% من جميع حالات ابيضاض الدم [32] تم تسجيل بعض حالات ابيضاض الدم لدى الأطفال نتيجة انتقاله من الأم إلى الجنين في حالة إصابة الأم بابيضاض الدم أثناء الحمل [27] وفقاً للدراسة التي أجراها مركز البحث في الأوبئة والصحة السكانية في فرنسا، فإنَّ الأطفال الذين يُولدون للأمَّهات اللاتي يستخدمن أدوية الخصوبة لتحفيز الإباضة تكون فرصتهم في الإصابة بابيضاض الدم في فترة الطفولة مرتين أكثر من الأطفال الآخرين [33] هناك عدة عوامل يمكنها أنْ تجعل الشخص عرضةً للإصابة بابيضاض الدم أكثر من غيره وهي:
- التعرض للإشعاعات. حيث تم ملاحظة أنَّ العاملين في الأشعة من أطباء وفنيين والمرضى الذين تم علاجهم من مرض التهاب الفقار المُقَسِط (Ankylosing Spondylitis) باستخدام الأشعة مقارنة بالمرضى الذين استُخدمَت معهم علاجات غير العلاج بالأشعة والناجين من القنبلة الذرية في هيروشيما وناكازاكي في اليابان جميعهم أظهروا نسبةً أعلى للإصابة بابيضاض الدم.
- التعرض لبعض المركبات الكيميائية مثل الكلورمفينيكول (Chloramphenicol) والبنزين وبعض المضادات الحشرية. وهناك بعض الأدوية التي تستخدم في علاج السرطانات مثل فينيل ألانين الخل الذي يستخدم في علاج الورم النِقَوي المتعدد وبعض المواد القاعدية التي تستخدم في علاج مرض هودجكين وبعض الأدوية المثبطة مناعيّاً.
- بعض الأمراض الوراثية مثل متلازمة داون ومتلازمة بلووم.
- بعض الفيروسات مثل Human T-Lymphocyte بنوعيه الأول HTLV-1 والثاني HTLV-2 وذلك عن طريق إدخال جين ورمي (Oncogene) لخلايا الإنسان مما يجعلها سرطانية.
التشخيص

يتم تشخيص المرض مخبرياً وذلك بإجراء عدة فحوصات ومن أهمها
- العد الكامل لمكونات الدم (Complete Blood Count CBC) ومن خلال هذا الفحص يمكن إعطاء إشارات أولية باحتمال الإصابة بأبيضاض الدم.
- الفحص السريري للكشف عن وجود تضخم في الكبد أو الطحال أوالعقد اللمفاوية
- خزعة من نخاع العظم وذلك بفحص تلك الخزعة تحت المجهر بعد صبغها ببعض الصبغات الخاصة التي تشير إلى وجود أبيضاض في الدم.
في بعض الأحيان فحوص الدم لا تظهر إصابه المريض بسرطان الدم خصوصاً خلال بداية المرض أو خلال كُمون المرض أي بدون أعراض. في بعض أنواع السرطان يمكن استخدام خزعة من العقد اللمفاوية. بعد التشخيص يمكن إجراء فحوص الدم الكيميائية لتحديد الضرر المُصيب للكلية والكبد وتأثير العلاج الكيميائي على المريض. ومن الممكن استخدام x-ray وهي صوره الأشعة السينيه أو ultrasound الأشعة فوق الصوتية أو التصوير بالأشعة المغناطيسية MRI. وهذه الفحوصات تستخدم لكشف ضرر بالعظام (السينيه) أو الدماغ (ام ار أي) أو الكلية أو الطحال أو الكبد (فوق الصوتية). يمكن استخدام التصوير المقطعي المحوسب (ال سي تي) لفحص العقد اللمفاوية بالصدر ولكن هذه الطريقة نادره الاستخدام. بالرغم من استخدام هذه الطرق لتشخيص المريض إذا كان مصاب أم معافى، إلَّا أنَّ من الناس لم يتم تشخيصهم وسبب ذلك هو التشخيص الخاطئ لتشابه الأعراض مع أمراض أخرى. ولهذه السبب تقدر جمعية السرطان الأمريكية أنَّه على الأقل خُمسةٌ من الأشخاص الذين يعانون من سرطان الدم لم يتم تشخيصهم بالمرض.[24]
المعالجة
هناك عدة طرق مستخدمة لعلاج ابيضاض الدم. بناء على حالة المريض وحدَّة المرض ونوع المرض يتم اتخاذ العلاج المناسب. ومن أكثر العلاجات استخداما:
- العلاج الكيميائي (Chemotherapy): ويتم فيه إعطاء المريض أدوية مثل (hydroxyurea, busulfan, etoposide, glivec ,tasigna ,daunorubicin) وغيرها للقضاء على الخلايا السرطانية.
- العلاج بالأشعة (Radiotherapy): تعريض المريض للأشعة للقضاء على الخلايا السرطانية.
- زراعة نخاع العظم (Bone Marrow Transplantation)
العلاجات المساعدة
- نقل دم: وذلك لمعالجه فقر الدم وعلاج النزيف.
- مضادَّات حيويه (Antibiotics) وإنترفيرون (Interferon): ليتم دعم الجسم مناعياً ويجعله مُقاوِماً للأمراض.
سرطان الدم الحاد الليمفاوي
البؤرة التدبيريَّة العلاجية هي السيطرة على نخاع العظم وعلى المرض في جميع أجهزة الجسم (لكلِّ الجسم). بالإضافة إلى أنَّ العلاج يمنع الخلايا السرطانية من الانتشار إلى مناطق أخرى بالجسم وتحديدا الجهاز العصبي المركزي، فعلى سبيل المثال إجراء خزعةٍ من النخاع الشوكي شهرياً. بشكل عام الخطة العلاجية لهذا المرض تقسم إلى عدَّة مراحل:
- المرحلة الاستهلاكية أو الحثية: وتهدف للوصول إلى حالة استقرار نخاع العظم والخطة عند البالغين أو الخطة الاستهلاكيَّة تتكون من الأدوية برويليزون. فبكريسين وانثراسيكلين، والطرق العلاجية الأخرى تتكون من سيكلوفوسفيد ول-سباراجينياس. أَمَّا في الأطفال ذوي الخطورة العالية نستخدم برينليزون ول-اسباراجينياس وفينكيسترين.
- الخطة العلاجية المركزة المكثفة تهدف إلى حصر عدد الخلايا السرطانية المتبقية. ولها عدّة طرق وبشكل تقليدي هي جرعه عالية من عدة علاجات وتتم خلال عدَّة أشهر، أمَّا ذوي الخطورة المتوسطة والمنخفضة يُعطى مضاد الأيض مثل الميثوكريكسيات و6-مركابتوبورون، وفي الخطورة العالية يعطون جرعات عالية من نفس الأدوية السابقة بالإضافة لأدوية أُخرى.
- حماية الجهاز العصبي المركزي وهي حماية وقائية تتمثل بالعلاج الإشعاعي وقد تعطى بعض العلاجات مباشره داخل النُّخاع الشوكي.
- العلاج الكيمائي وذلك للوقاية من عدم رجوع المرض وعادة تتكون من جرعه منخفضة من عدَّة علاجات وتستمر لثلاث سنوات.
- كبديل في حالة المرض ذي الخطورة العالية يمكن عمل زرع نخاع العظم.[34]
السرطان اللمفاوي المزمن
قرار المعالجة
وتعتمد على مرحلة المرض والأعراض . أغلبيَّة مرضى سرطان الدم اللمفاوي المزمن والذين لديهم درجه منخفضة من المرض لا يستفيدون من العلاج، والذين لديهم مضاعفات čيستفيدون من العلاج . بشكل عام المؤشرات للعلاج هي:
- هبوط مستوى خضاب الدم أو الصفائح الدموية.
- تطور مرحلة المرض لمرحلة أخرى
- تضخم مؤلم بالغدد اللمفاوية أو الطحال
- زيادة في إنتاج عدد كريات الدم اللمفاوية [35]
النهج العلاجي
سرطان كريات الدم المزمن غير قابل للشفاء بالعلاجات الحالية. خطه العلاج الكيماوي هي تشكيلة من كلورامبوسيل أو سيكلوفوفسفايد بالإضافة إلى الكلوجوستيدويدات مثل بريدنيولون أو بريدنون . إنَّ استخدام الستيرويد له إضافة علاجيَّة بإحباط بعض الأمراض المناعية مثل فقر الدم أو نقص الصفائح المناعية، في بعض الحالات المستعصية يعطى العلاج المركب مع أدوية النيكليوسيد كالفلودرابين[36] والبينتوستاتين أو كلادربين وقد يكون ناجحاً في الحالات الأصغر سنَّاً يمكن زرع نخاع العظم وزرع النسيج الذاتي أو غير الذاتي.
سرطان الدم النقوي الحاد
عدد مختلف من العلاجات المضادة للسرطان فعّآلة في علاجه، المعالجة تختلف حسب العمر وحسب النوع الفرعي للسرطان. بشكل عام استراتيجية السيطرة على المريض تتمثل بالسيطرة على نخاع العظم وأجهزة الجسم كلِّها وتوفير علاج خاص للجهاز العصبي عند إصابته. وبشكل عام أغلبية أخصَّائي الأورام يعتمدون على تركيبة العلاجات المتعددة للمعالجة الحثية الاستهلاكية مثل هذا النهج المتعدد الدوائي عادةً ما يوفر السكون المرضي وانخفاض في خطورة مقاومة المرض للعلاج، العلاج المكشف والصياني تُعطى للوقاية من رجوع المرض وتُعطَى بهذه المرحلة نفس الأدوية في مرحله الحث وأدوية أخرى . كما أَنَّ العلاج الصياني يُعطى بجرعات أقل من الحثي. أما في حاله السكون المرضي فإنَّ العلاج الصياني يكون بجرعات أقل من جرعات العلاج الحثي.[37]
سرطان الدم النقوي المزمن
هناك عدة احتمالات والشكل الرئيسي للعلاج عند المرض الحاد ويشمل بإعطائهم ايماتينيب[38] هذا العلاج بالمقارنة مع العلاجات الأخرى له مميزات منها قلَّة الآثار الجانبية ويُعطى عن طريق الفم. وبهذا العلاج يكون أكثر من 90 بالمائة تحت السيطرة لمده خمس سنوات[38] ولهذا يصبح مزمن يمكن علاجه. أمَّا في الحالات المتقدمة عند فقدان السيطرة أو عدم المريض للعلاج أو عند رغبة المريض بالشفاء كليَّاً من المرض يمكن استخدام عمليه زرع نخاع العظم من مصدر غير ذاتي. وهذه الزراعة قد يدخل ضمنها العلاج الشعاعي والكيمائي و30 بالمائة من المصابين يموتون بعد القيام بهذه العملية.[38]
الخلايا الشعورية
عندما لا يوجد أعراض عند المريض فإنَّه لا يُعطى أيُّ علاج . بشكل عام يعطى علاج يعتبر ضروري عندما تظهر على المصاب علامات وأعراض كعدد خلايا الدم المنخفض (على سبيل المثال، معدل خلايا مكافحة العدوى أقل من 1.0 K / ميكرولتر) والالتهابات المتكررة والكدمات غير المبررة وفقر الدم أو التعب والتي هي كبيرة بما يكفي لتعطيل حياة المريض اليومية.
النهج العلاجي التقليدي إنَّ المريض الذي قد يحتاج معالجة سوف يتناول كلاديبن لأسبوع ويُعطى عن طريق الوريد أو جرعه تحت الجلد أو يمكن أن يتناول بيتوستاتين لمدة أربعه أسابيع . وفي كثير من الحالات دورة واحدة من العلاج ينتج عنها توقُّف للمرض لفترة طويلة.[39]
هناك علاجات أخرى تُعطى مثل ريتوكسياب من خلال الوريد مع انترفيرون ألفا، أو في حالات محدودة يمكن للمريض الاستفادة من إزالة الطحال، مثل هذه العلاجات لا تُعطى منذ البداية لأنَّ احتمال نجاحها أقل من الكلدريبين أو البينتوستاتين.[40]
ابيضاض الدم T-prolymphocytic
معظم المرضى المصابين ب ابيضاض الدم t-cell prolymphcytic (وهو نوع نادر جداً وعنيف، متوسط الحياة يقل عن السنة الواحدة) يتطلبون علاجاً فورياً .[41]
هذا النوع من ابيضاض الدم صعب العلاج ولا يستجيب لمعظم العلاجات الكيماوية المتوافرة.[41] تم تجربة علاجات مختلفة ولاقت نتائج محدودة في مرضى معينين مثل: أشباه البيورين (pentostatin, fludarabine, cladribine)، chlorambucil، وتوليفات متنوِّعة من العلاجات الكيماوية (cyclophosphamide, doxorubicin, vincristine, prednisone CHOP, cyclophosphamide, vincristine, prednisone [COP], vincristine, doxorubicin, prednisone, etoposide, cyclophosphamide, bleomycin VAPEC-B). Alemtuzumab مضاد أحادي النسيلة يهاجم خلايا الدم البيضاء تم استخدامه كنوع من العلاج ولاقى نجاح أكبر من الخيارات السابقة.[41] بعض المرضى الذين يستجيبون للعلاج يخضعون أيضاً لزراعة الخلايا الجذعية لتدعيم استجابتهم للعلاج.[41]
سرطان ابْيِضاضٌ وَحيدِيٌّ نِقَوِيّ اليَفَعِيّ (Juvenile myelomonocytic)
علاج هذا النوع من السرطان يمكن أن يكون باستئصال الطحال والعلاج الكيميائي، وزراعة نخاع العظم.[42]
علم الأوبئة

في عام 2010 تُوفِّي حوالي 281,500 شخص بابيضاض الدم حول العالم.[44] وفي عام 2000 طوَّر حوالي 256,000 طفل وبالغ شكلاً من أشكال اللوكيميا حول العالم، وتوفي منهم 209,000 .[45] يمثل هذا حوالي 3% من سبعة ملايين حالة وفاة بسبب السرطان في ذلك العام وحوالي 0.35% من إجمالي الوفيات لأسباب مختلفة.[45] من المواقع الـستّة عشرة المنفصلة التي تم مقارنتها كان مرض ابيضاض الدم في المرتبة الثانية عشرة في تصنيف الأمراض الأكثر شيوعاً والحادي عشر من حيث الوفيات لأسباب تتعلق بالسرطان.[45]
الولايات المتحدة
تتأثر حوالي 245,000 شخص في الولايات المتحدة ببعضٍ من أشكال سرطان الدم بما في ذلك تلك التي حققت علاج. وزادت المعدلات 1975-2011 بنسبة 0.7٪ سنويَّاً بين الأطفال.[46] تم تشخيص ما يقرب من 44270 حالة جديدة من سرطان الدم في عام 2008 في الولايات المتحدة.[47] وهذا يُمثِّل 2.9٪ من جميع حالات السرطان (باستثناء الخلايا القاعدية بسيطة والجلد الحرشفية الخلايا السرطان) في الولايات المتحدة، و30.4٪ من جميع سرطانات الدم.[48]
من بين مجموع الأطفال الذين يعانون من أي شكل من أشكال السرطان، حوالي الثلث يعانون من سرطان الدم، الأكثر شيوعاً من هذه الأنواع سرطان الدم الليمفاوي الحاد.[47] وهناك نوع من سرطان الدم هو الشكل الثاني الأكثر شيوعا من بين أنواع السرطان في الأطفال (دون سن 12 شهرا) والشكل الأكثر شيوعا من بين أنواع السرطان في الأطفال الأكبر سنا.[49] البنين إلى حدٍّ ما أكثر عرضة للإصابة بسرطان الدم من الفتيات، والأطفال الأميركيين البيض لديهم ضعف احتماليَّة الإصابة بسرطان الدم للأطفال الأمريكيين السود.[49] فقط حوالي ٪3 من حالات السرطان المُشخَّصة عند البالغين تكون للوكيميا، ولكن لأنَّ السرطان أكثر شيوعا بين البالغين يتم تشخيص أكثر من 90% من سرطانات الدم عند البالغين.[47]
أصول الأفراد هو أحد عوامل الخطر في الولايات المتحدة؛ اللاتينيين وخاصة من هم دون سن ال 20 هم الأكثر عرضة لسرطان الدم. في حين البيض الأميركيين الأصليين والأميركيين الآسيويين وسكان ألاسكا الأصليين هم أكثر عرضة من الأميركيين الأفارقة.[50]
الجنس هو أيضاً أحد عوامل الخطر؛ الرجال هم الأكثر إصابة بالمرض ويموتون بسببه بنسبة أكبر من النساء. حوالي 30 في المائة الرجال أكثر من النساء بنسبة الإصابة بسرطان الدم.[51] سرطان الدم أكثر شيوعا في الدول المتقدمة.[7]
المملكة المتحدة
عموماً سرطان الدم هو الحادي عشر من أكثر أنواع السرطان شيوعا في المملكة المتحدة (تم تشخيص حوالي 8600 شخص يعانون من هذا المرض في عام 2011) وهو السبب التاسع من الأسباب الأكثر شيوعا لوفيات السرطان (توفي حوالي 4800 شخص في عام 2012).[52]
التاريخ
رودولف فيرشو وُصف ابيضاض الدم للمرة الأولى على يد المُشرّح والجرّاح الفرنسي ألفرد-أرمند-لويس-ماري-فيلبو عام 1827. أعطى اختصاصي الباثولوجيا رودولف فيرشو وصفًا أكثر شمولية عام 1845. بعد أن رأى فيرشو عدد كبير بشكل غير طبيعي لخلايا الدم البيضاء في عينة من دم المريض . أطلق فيرشو على الحالة اسم لوكيميا (Leukämie) باللغة الألمانية، والتي تتشكل من الكلمتين اليونانيتين لويكوس (leukos; λευκός)، والتي تعني «أبيض»، وهيما (haima; αἷμα)، والتي تعني «دم». بعد نحو عشر سنوات من نتائج فيرشو، وجد اختصاصي الباثولوجيا الألماني فرانتس إرنست كريستيان نومان أنَّ نخاع العظم في متوفي مريض ابيضاض الدم كان ذو لون «أخضر-أصفر قذر» بدلاً من اللون الأحمر العادي. استنتج نومان من هنا أنَّ مشكلة في نخاع العظم هي المسؤولة عن الدم غير الطبيعي في مرضى ابيضاض الدم. بحلول القرن العشرين اعتُبر ابيضاض الدم كمجموعة من الأمراض بدلًا من مرض واحد. وبحلول عام 1947 اعتقد اختصاصي الباثولوجيا من بوستون «سيدني فاربر» من تجارب سابقة أنَّ الأمينوبتيرين، وهو تقليد لحمض الفوليك، قد يشفي ابيضاض الدم في الأطفال. وقد أظهر معظم الأطفال مُصابي ابيضاض الدم اللمفاوي الحاد الذين فُحصوا علامات تحسُّن في نخاع العظم، ولكن لم يُشفى أيًا منهم في الواقع. ومع ذلك أدَّى ذلك إلى مزيد من التجارب. في عام 1962، استخدم الباحثَين إميل ج. فريريخ جونيور وإميل فري الثالث العلاج الكيميائي في محاولة لعلاج ابيضاض الدم. نجحت التجارب مع بعض المرضى الذين بقُوا على قيد الحياة فترة طويلة بعد التجربة.[53]
المجتمع والثقافة
وفقا لسوزان سونتاغ: إنَّ لسرطان الدم طابعاً رومانسياً في القرن العشرين، صُّور على أنه ينهي الفرح، المصابين هم ضحايا أبرياء ماتوا صغاراً أو في الوقت غير المناسب. على هذا النحو وكانت الخليفة الثقافية له هو مرض السل، الذي حمل هذا اللقب الثقافي حتى اكتشف أنه أحد الأمراض المعدية.[54] الرواية الرومانسية (قصة حب) هي مثال على تفسير الرومانسية في سرطان الدم.
في الولايات المتحدة أُنفق حوالي 54 بليون دولار على العلاج في السنة.[6]
اتجاهات البحوث
يتم تنفيذ بحوث مهمة في الأسباب والانتشار والتشخيص والعلاج والتشخيص لسرطان الدم. ويجري التخطيط لمئات من التجارب السّريرية له [55] وتركز الدراسات على وسيلة فعّآلة للعلاج وأفضل الطرق لعلاج هذا المرض وتحسين نوعية الحياة للمرضى أو الرعاية المناسبة خلال أو بعد العلاج.
بشكل عام هناك نوعان من بحوث سرطان الدم: البحوث السريرية أو التفسيرية والبحوث الأساسية. وتركز البحوث السريرية / البحوث التفسيرية على دراسة هذا المرض بطريقة محددة وغير محدده بطرق تناسب المريض؛ مثل اختبار دواء جديد في المرضى. على النقيض من ذلك تدرس البحوث العلمية الأساسية المرض بأبعاد أخرى؛ مثل رؤية ما إذا كانت مادة مُسرطنة يمكن أن تسبِّب تغيرات اللوكيميا في الخلايا المعزولة في المختبر أو كيف يتغير DNA داخل خلايا سرطان الدم. النتائج من الدراسات البحثية الأساسية عادة ما تكون أقل إفاده للمرضى الذين يعانون من هذا المرض.[56]
ويجري حالياً متابعة العلاج عن طريق العلاج الجيني. وإحدى هذه الطرق تستعمل خلية تائية (T cell) لمهاجمة الخلية السرطانية. في عام 2011 بعد عام من إجراء العلاج اثنين من ثلاثة مرضى شفوا من سرطان الدم الليمفاوي المزمن[57] وفي عام 2013 ثلاثة من خمسة اشخاص الذين عانوا من سرطان الدم الليمفاوي الحاد أصبح لديهم حالة من الخمود لمدة خمسة أشهر أو عامين[58] يجري حالياً تحديد الخلايا الجذعية التي تسبب أنواع مختلفة من سرطان الدم.[59]
الحمل
نادراً ما يرتبط سرطان الدم مع الحمل. يؤثر فقط في حوالي 1 من 10.000من النساء الحوامل.[60] طريقة التعامل مع المرض تعتمد بالدرجة الأولى على نوع سرطان الدم. تقريباً جميع سرطانات الدم التي تظهر عند النساء الحوامل هي سرطانات الدم الحادة.[61] اللوكيميا الحادة تتطلب عادة علاج عدواني سريع. على الرغم من المخاطر الكبيرة لفقدان الحمل والتشوهات الخلقية وخاصة إذا تم إعطاء العلاج الكيميائي أثناء الأشهر الثلاثة الأولى والتي هي حساسة لحالة الطفل التنموية.[60]
ويمكن علاج سرطان ابيضاض الدم النقوي المزمن في أي وقت خلال فترة الحمل باستخدام الهرمونات إنترفيرون ألفا.[60] علاج اللوكيميا اللمفاوية المزمنة والذي هو نادر عند النساء الحوامل يمكن تأجيله إلى ما بعد نهاية الحمل.[60][61]
الأبحاث
وجدت مجموعة بحث أن لمركب سكلاريول القدرة على إحداث أثر الاستماتة على بعض أنواع خلايا مرض ابيضاض الدم.[62]
انظر أيضاً
- سرطان الدم الليمفاوي الحاد
- سرطان الدم النقوي الحاد
- سرطان الدم الليمفاوي المزمن
- سرطانة خلايا الدم
- أمراض الدم
- سرطان الغدد الليمفاوية
- ألفرد فرانسوا دونيه
- جون هيوز بينيت
المراجع
- ^ Q98547939، ص. 4، QID:Q98547939
- ^ "ابيضاض الدم - الأعراض والأسباب - Mayo Clinic (مايو كلينك)". www.mayoclinic.org. مؤرشف من الأصل في 2023-06-12. اطلع عليه بتاريخ 2023-06-15.
- ^ "Leukemia". NCI. 1 يناير 1980. مؤرشف من الأصل في 2014-05-27. اطلع عليه بتاريخ 2014-06-13.
Cancer that starts in blood-forming tissue, such as the bone marrow, and causes large numbers of abnormal blood cells
- ^ أ ب "What You lNeed To Know About™ Leukemia". National Cancer Institute. 23 ديسمبر 2013. مؤرشف من الأصل في 2014-07-06. اطلع عليه بتاريخ 2014-06-18.
- ^ أ ب Hutter JJ (يونيو 2010). "Childhood leukemia". Pediatrics in Review. ج. 31 ع. 6: 234–241. DOI:10.1542/pir.31-6-234. PMID:20516235.
- ^ أ ب ت ث ج ح خ "A Snapshot of Leukemia". NCI. مؤرشف من الأصل في 2015-04-04. اطلع عليه بتاريخ 2014-06-18.
- ^ أ ب ت ث ج ح World Cancer Report 2014. World Health Organization. 2014. ص. Chapter 5.13. ISBN:9283204298. مؤرشف من الأصل في 2022-12-05.
- ^ Vardiman، JW؛ Thiele، J؛ Arber، DA؛ Brunning، RD؛ Borowitz، MJ؛ Porwit، A؛ Harris، NL؛ Le Beau، MM؛ Hellström-Lindberg، E؛ Tefferi، A؛ Bloomfield، CD (30 يوليو 2009). "The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes". Blood. ج. 114 ع. 5: 937–51. DOI:10.1182/blood-2009-03-209262. PMID:19357394.
- ^ Cătoi، Alecsandru Ioan Baba, Cornel (2007). Comparative oncology. Bucharest: The Publishing House of the Romanian Academy. ص. Chapter 17. ISBN:973-27-1457-3. مؤرشف من الأصل في 2017-09-10.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "SEER Stat Fact Sheets: Leukemia". National Cancer Institute. 2011. مؤرشف من الأصل في 2019-03-26.
- ^ American Cancer Society (2 مارس 2014). "Survival rates for childhood leukemia". مؤرشف من الأصل في 2015-08-21.
- ^ Merriam-Webster Dictionary: Leukemia
- ^ Jameson, J. N. St C.; Dennis L. Kasper; Harrison, Tinsley Randolph; Braunwald, Eugene; Fauci, Anthony S.; Hauser, Stephen L; Longo, Dan L. (2005). Harrison's principles of internal medicine. New York: McGraw-Hill Medical Publishing Division. ISBN:0-07-140235-7.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Finding Cancer Statistics » Cancer Stat Fact Sheets »Chronic Lymphocytic Leukemia National Cancer Institute. نسخة محفوظة 09 أبريل 2018 على موقع واي باك مشين.
- ^ Colvin G. A., Elfenbein G. J. (2003). "The latest treatment advances for acute myelogenous leukemia". Medicine and Health, Rhode Island. ج. 86 ع. 8: 243–6. PMID:14582219.
- ^ Novartis نسخة محفوظة 08 ديسمبر 2017 على موقع واي باك مشين.
- ^ Patients with Chronic Myelogenous Leukemia Continue to Do Well on Imatinib at 5-Year Follow-Up Medscape Medical News 2006. نسخة محفوظة 30 نوفمبر 2016 على موقع واي باك مشين.
- ^ Updated Results of Tyrosine Kinase Inhibitors in CML ASCO 2006 Conference Summaries. نسخة محفوظة 08 يوليو 2011 على موقع واي باك مشين. [وصلة مكسورة]
- ^ Else, M., Ruchlemer, R., Osuji, N. (2005). "Long remissions in hairy cell leukemia with purine analogs: a report of 219 patients with a median follow-up of 12.5 years". Cancer. ج. 104 ع. 11: 2442–8. DOI:10.1002/cncr.21447. PMID:16245328.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Matutes Estella (1998). "T-cell prolymphocytic leukemia, a rare variant of mature post-thymic T-cell leukemias, has distinct clinical and laboratory characteristics and a poor prognosis". Cancer Control Journal. ج. 5 ع. 1. مؤرشف من الأصل (PDF) في 2012-06-26.
- ^ Valbuena JR, Herling M, Admirand JH, Padula A, Jones D, Medeiros LJ (مارس 2005). "T-cell prolymphocytic leukemia involving extramedullary sites". American Journal of Clinical Pathology. ج. 123 ع. 3: 456–64. DOI:10.1309/93P4-2RNG-5XBG-3KBE. PMID:15716243. مؤرشف من الأصل في 2013-05-15.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Elaine Sarkin Jaffe, Nancy Lee Harris, World Health Organization, International Agency for Research on Cancer, Harald Stein, J. W. Vardiman (2001). Pathology and genetics of tumours of haematopoietic and lymphoid tissues. World Health Organization Classification of Tumors. Lyon: IARC Press. ج. 3. ISBN:92-832-2411-6. مؤرشف من الأصل في 2020-03-13.
{{استشهاد بكتاب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Leukemia". Columbia Electronic Encyclopedia, 6th Edition. مؤرشف من الأصل في 2017-03-23. اطلع عليه بتاريخ 2011-11-04.
- ^ أ ب American Cancer Society (2010). "How is Leukemia Diagnosed?". Detailed Guide: Leukemia – Adult Chronic. American Cancer Society. مؤرشف من الأصل في 2010-04-05. اطلع عليه بتاريخ 2010-05-04.
- ^ أ ب Ross JA, Kasum CM, Davies SM, Jacobs DR, Folsom AR, Potter JD (أغسطس 2002). "Diet and risk of leukemia in the Iowa Women's Health Study". Cancer Epidemiol. Biomarkers Prev. ج. 11 ع. 8: 777–81. PMID:12163333. مؤرشف من الأصل في 2019-05-14.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Radivoyevitch، T؛ Sachs، R K؛ Gale، R P؛ Molenaar، R J؛ Brenner، D J؛ Hill، B T؛ Kalaycio، M E؛ Carraway، H E؛ Mukherjee، S. "Defining AML and MDS second cancer risk dynamics after diagnoses of first cancers treated or not with radiation". Leukemia. DOI:10.1038/leu.2015.258. مؤرشف من الأصل في 2020-03-15.
- ^ أ ب ت ث ج ح Wiernik, Peter H. (2001). Adult leukemias. New York: B. C. Decker. ص. 3–15. ISBN:1-55009-111-5. مؤرشف من الأصل في 2022-05-16.
- ^ أ ب Robinette, Martin S.; Cotter, Susan; Van de Water (2001). Quick Look Series in Veterinary Medicine: Hematology. Teton NewMedia. ص. 105. ISBN:1-893441-36-9.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Stass, Sanford A.; Schumacher, Harold R.; Rock, William R. (2000). Handbook of hematologic pathology. New York, N.Y: Marcel Dekker. ص. 193–194. ISBN:0-8247-0170-4. مؤرشف من الأصل في 2022-05-16.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Leonard، Barry (1998). Leukemia: A Research Report. DIANE Publishing. ص. 7. ISBN:0-7881-7189-5. مؤرشف من الأصل في 2016-08-05. "نسخة مؤرشفة". مؤرشف من الأصل في 2014-02-04. اطلع عليه بتاريخ 2016-01-27.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Pasmant E, Ballerini P, Lapillonne H et al. SPRED1 disorder and predisposition to leukemia in children. Blood 2009; 114:1131. نسخة محفوظة 28 مارس 2020 على موقع واي باك مشين.
- ^ "WHO | Electromagnetic fields and public health". مؤرشف من الأصل في 2013-12-06. اطلع عليه بتاريخ 2009-02-18.
- ^ Rudant J، Amigou A، Orsi L، Althaus T، Leverger G، Baruchel A، Bertrand Y، Nelken B، Plat G، Michel G، Sirvent N، Chastagner P، Ducassou S، Rialland X، Hémon D، Clavel J (2013). "Fertility treatments, congenital malformations, fetal loss, and childhood acute leukemia: the ESCALE study (SFCE)". Pediatr Blood Cancer. ج. 60 ع. 2: 301–8. DOI:10.1002/pbc.24192. PMID:22610722.
- ^ Hoffbrand AV, Moss PAH, and Pettit JE, "Essential Haematology", Blackwell, 5th ed., 2006.
- ^ National Cancer Institute. "Chronic Lymphocytic Leukemia (PDQ) Treatment: Stage Information". مؤرشف من الأصل في 2015-04-24. اطلع عليه بتاريخ 2007-09-04.
- ^ Eichhorst BF, Busch R, Hopfinger G, Pasold R, Hensel M, Steinbrecher C, Siehl S, Jäger U, Bergmann M, Stilgenbauer S, Schweighofer C, Wendtner CM, Döhner H, Brittinger G, Emmerich B, Hallek M, German CLL Study Group. (2006). "Fludarabine plus cyclophosphamide versus fludarabine alone in first-line therapy of younger patients with chronic lymphocytic leukemia". Blood. ج. 107 ع. 3: 885–91. DOI:10.1182/blood-2005-06-2395. PMID:16219797.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ American Cancer Society (22 مارس 2012). "Typical treatment of acute myeloid leukemia (except promyelocytic M3)". Detailed Guide: Leukemia – Acute Myeloid (AML). American Cancer Society. مؤرشف من الأصل في 2016-12-10. اطلع عليه بتاريخ 2012-10-31.
- ^ أ ب ت Fausel C (October 2007). "Targeted chronic myeloid leukemia therapy: seeking a cure" (PDF). J Manag Care Pharm. ج. 13 ع. 8 Suppl A: 8–12. PMID:17970609. مؤرشف من الأصل (PDF) في 11 أغسطس 2017. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ "Cladribine in a weekly versus daily schedule for untreated active hairy cell leukemia: final report from the Polish Adult Leukemia Group (PALG) of a prospective, randomized, multicenter trial – Robak et al. 109 (9): 3672 – Blood". مؤرشف من الأصل في 2007-09-29. اطلع عليه بتاريخ 2007-09-10.
- ^ "Filgrastim for Cladribine-Induced Neutropenic Fever in Patients With Hairy Cell Leukemia – Saven et al. 93 (8): 2471 – Blood". مؤرشف من الأصل في 2008-02-22. اطلع عليه بتاريخ 2007-09-10.
- ^ أ ب ت ث Dearden CE, Matutes E, Cazin B (September 2001). "High remission rate in T-cell prolymphocytic leukemia with CAMPATH-1H". Blood. ج. 98 ع. 6: 1721–6. DOI:10.1182/blood.V98.6.1721. PMID:11535503. مؤرشف من الأصل في 28 مارس 2020. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "JMMLfoundation.org". JMMLfoundation.org. مؤرشف من الأصل في 2009-01-25. اطلع عليه بتاريخ 2010-08-29.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. مؤرشف من الأصل في 2014-02-11. اطلع عليه بتاريخ 2009-11-11.
- ^ Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, Ahn SY, Alvarado M, Anderson HR, Anderson LM, Andrews KG, Atkinson C, Baddour LM, Barker-Collo S, Bartels DH, Bell ML, Benjamin EJ, Bennett D, Bhalla K, Bikbov B, Bin Abdulhak A, Birbeck G, Blyth F, Bolliger I, Boufous S, Bucello C, Burch M, Burney P, Carapetis J, Chen H, Chou D, Chugh SS, Coffeng LE, Colan SD, Colquhoun S, Colson KE, Condon J, Connor MD, Cooper LT, Corriere M, Cortinovis M, de Vaccaro KC, Couser W, Cowie BC, Criqui MH, Cross M, Dabhadkar KC, Dahodwala N, De Leo D, Degenhardt L, Delossantos A, Denenberg J, Des Jarlais DC, Dharmaratne SD, Dorsey ER, Driscoll T, Duber H, Ebel B, Erwin PJ, Espindola P, Ezzati M, Feigin V, Flaxman AD, Forouzanfar MH, Fowkes FG, Franklin R, Fransen M, Freeman MK, Gabriel SE, Gakidou E, Gaspari F, Gillum RF, Gonzalez-Medina D, Halasa YA, Haring D, Harrison JE, Havmoeller R, Hay RJ, Hoen B, Hotez PJ, Hoy D, Jacobsen KH, James SL, Jasrasaria R, Jayaraman S, Johns N, Karthikeyan G, Kassebaum N, Keren A, Khoo JP, Knowlton LM, Kobusingye O, Koranteng A, Krishnamurthi R, Lipnick M, Lipshultz SE, Ohno SL, Mabweijano J, MacIntyre MF, Mallinger L, March L, Marks GB, Marks R, Matsumori A, Matzopoulos R, Mayosi BM, McAnulty JH, McDermott MM, McGrath J, Mensah GA, Merriman TR, Michaud C, Miller M, Miller TR, Mock C, Mocumbi AO, Mokdad AA, Moran A, Mulholland K, Nair MN, Naldi L, Narayan KM, Nasseri K, Norman P, O'Donnell M, Omer SB, Ortblad K, Osborne R, Ozgediz D, Pahari B, Pandian JD, Rivero AP, Padilla RP, Perez-Ruiz F, Perico N, Phillips D, Pierce K, Pope CA, Porrini E, Pourmalek F, Raju M, Ranganathan D, Rehm JT, Rein DB, Remuzzi G, Rivara FP, Roberts T, De León FR, Rosenfeld LC, Rushton L, Sacco RL, Salomon JA, Sampson U, Sanman E, Schwebel DC, Segui-Gomez M, Shepard DS, Singh D, Singleton J, Sliwa K, Smith E, Steer A, Taylor JA, Thomas B, Tleyjeh IM, Towbin JA, Truelsen T, Undurraga EA, Venketasubramanian N, Vijayakumar L, Vos T, Wagner GR, Wang M, Wang W, Watt K, Weinstock MA, Weintraub R, Wilkinson JD, Woolf AD, Wulf S, Yeh PH, Yip P, Zabetian A, Zheng ZJ, Lopez AD, Murray CJ, AlMazroa MA, Memish ZA (ديسمبر 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. ج. 380 ع. 9859: 2095–128. DOI:10.1016/S0140-6736(12)61728-0. PMID:23245604.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت Mathers, Colin D, Cynthia Boschi-Pinto, Alan D Lopez and Christopher JL Murray (2001). "Cancer incidence, mortality and survival by site for 14 regions of the world" (PDF). Global Programme on Evidence for Health Policy Discussion Paper No. 13. World Health Organization. مؤرشف من الأصل (PDF) في 2020-03-16.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Amitay، EL؛ Keinan-Boker، L (1 يونيو 2015). "Breastfeeding and Childhood Leukemia Incidence: A Meta-analysis and Systematic Review". JAMA pediatrics. ج. 169 ع. 6: e151025. DOI:10.1001/jamapediatrics.2015.1025. PMID:26030516.
- ^ أ ب ت "Leukemia Facts & Statistics." The Leukemia & Lymphoma Society. Retrieved 2009-07-02. نسخة محفوظة 24 مارس 2010 على موقع واي باك مشين.
- ^ Horner MJ, Ries LAG, Krapcho M, Neyman N, et al. (eds). "SEER Cancer Statistics Review, 1975–2006". Surveillance Epidemiology and End Results (SEER). Bethesda, MD: المعهد الوطني للسرطان. مؤرشف من الأصل في 2013-10-04. اطلع عليه بتاريخ 2009-11-03.
Table 1.4: Age-Adjusted SEER Incidence and U.S. Death Rates and 5-Year Relative Survival Rates By Primary Cancer Site, Sex and Time Period
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب James G. Gurney, Malcolm A. Smith, Julie A. Ross (1999) Cancer Incidence and Survival among Children and Adolescents, United States SEER program 1975–1995, chapter on Leukemia Cancer Statistics Branch, National Cancer Institute, available online from the SEER web site نسخة محفوظة 10 أغسطس 2013 على موقع واي باك مشين.
- ^ Childhood Blood Cancers | The Leukemia & Lymphoma Society نسخة محفوظة 25 أبريل 2015 على موقع واي باك مشين.
- ^ Facts 2012 from The Leukemia & Lymphoma Society نسخة محفوظة 09 فبراير 2015 على موقع واي باك مشين.
- ^ "Leukaemia (all subtypes combined) statistics". Cancer Research UK. مؤرشف من الأصل في 2015-05-19. اطلع عليه بتاريخ 2014-10-27.
- ^ Patlak، Margie. "Targeting Leukemia: From Bench to Bedside" (PDF). Breakthroughs in Bioscience. The Federation of American Societies for Experimental Biology. مؤرشف من الأصل (PDF) في 2013-05-14. اطلع عليه بتاريخ 2010-05-20.
- ^ Sontag, Susan (1978). المرض كإستعارة. New York: Farrar, Straus and Giroux. ص. 18. ISBN:0-374-17443-1.
- ^ Search of: leukemia – List Results – ClinicalTrials.gov نسخة محفوظة 11 سبتمبر 2017 على موقع واي باك مشين.
- ^ "Understanding Clinical Trials for Blood Cancers" (PDF). Leukemia and Lymphoma Society. مؤرشف من الأصل (PDF) في 2011-01-05. اطلع عليه بتاريخ 2010-05-19.
- ^ Jaslow، Ryan. "New Leukemia Therapy Destroys Cancer by Turning Blood Cells into "Assassins"". CBSnews.com HealthPop section. مؤرشف من الأصل في 2019-05-11. اطلع عليه بتاريخ 2011-08-11.
- ^ Coghlan, Andy (26 March 2013) Gene therapy cures leukaemia in eight days The New Scientist, Retrieved 15 April 2013 نسخة محفوظة 15 مايو 2015 على موقع واي باك مشين.
- ^ "How we're beating leukaemia". Leukaemia & Lymphoma Research. مؤرشف من الأصل في 2015-03-23. اطلع عليه بتاريخ 2013-09-24.
- ^ أ ب ت ث Shapira T, Pereg D, Lishner M (سبتمبر 2008). "How I treat acute and chronic leukemia in pregnancy". Blood Rev. ج. 22 ع. 5: 247–59. DOI:10.1016/j.blre.2008.03.006. PMID:18472198.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Koren G, Lishner M (2010). "Pregnancy and commonly used drugs in hematology practice". Hematology Am Soc Hematol Educ Program. ج. 2010: 160–5. DOI:10.1182/asheducation-2010.1.160. PMID:21239787.
- ^ Dimas, Kostas؛ Kokkinopoulos, Dimitrios؛ Demetzos, Costas؛ Vaos, Basilios؛ Marselos, Marios؛ Malamas, Mixalis؛ Tzavaras, Theodoros (1999). "The effect of sclareol on growth and cell cycle progression of human leukemic cell lines". Leukemia Research. ج. 23 ع. 3: 217–234. DOI:10.1016/S0145-2126(98)00134-9. PMID:10071073.
وصلات خارجية
| ابيضاض الدم في المشاريع الشقيقة: | |