|
تضامنًا مع حق الشعب الفلسطيني |
بيئة مكروية للورم
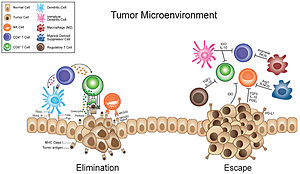
البيئة المكروية للورم أو بيئة الورم المكروية (بالإنجليزية: Tumor microenvironment) هي البيئة المحيطة بورم، وتشمل: الأوعية الدموية، الخلايا المناعية، الجزيئات المؤشرة والمطرس خارج الخلوي المحيطين بالورم.[1][2][3][4] الورم والبيئة الميكروية المحيطة به متصلان اتصالا وثيقا ويتآثران باستمرار. تؤثر الأورام على البيئة المحيطية بإفراز إشارات خارج خلوية تعزز توليد الأعية للورم وتُحدث التحمل المناعي المحيطي، بينما بمقدور الخلايا المناعية في البيئة المكروية التأثير على نمو وتطور الخلايا السرطانية.[1][5][6]
الجهاز الوعائي
حوالي 80–90% من السرطان هي كرسينومات أو سرطانات تشكلت من نسيج ظهاري.[7] وهذا النسيج غير مزود بالأوعية الدموية وهو ما يمنع الأورام من النمو أكثر من 2 ملم في القطر من دون استحداث أوعية دموية جديدة.[8] ينظم تولد الأوعية بالزيادة لتغذية الخلايا السرطانية، ونتيجة لذلك تختلف الجملة الوعائية المتشكلة عن نظيرتها في النسيج الطبيعي.
تأثير النفاذية والاحتفاظ المحسَّنين
تأثير النفاذية والاحتفاظ المحسنين [English] هو ملاحظة أن الجملة الوعائية الخاصة بالورم غالبا ما تكون مسرِّبة وتُراكم الجزيئات في تيار الدم بدرجة أكبر من النسيج الطبيعي. لا يُلاحظ هذا التأثير الالتهابي في الأورام وحسب، بل في المناطق ناقصة التأكسج من عضلة القلب بعد حدوث نوبة قلبية كذلك.[9][10] يُعتقد أن سبب نفاذية هذه الجملة الوعائية يرجع لعدة عوامل منها: خلايا حولية غير كافية والتكون الخاطئ للغشاء القاعدي.[10]
نقص التأكسج

غالبا ما تكون بيئة الورم المكروية ناقصة التأكسج، ومع زيادة كتلة الورم، يزيد بعد الجزء الداخلي للورم عن المصدر المزود بالدم. رغم أن تولد الأوعية يخفض من تأثير نقص التأكسج، إلا أن الضغط الجزئي للأكسجين يكون أقل من 5 ملم زئبقي (الضغط الجزئي للأكسجين الخاص بالأوردة الدموية هو 40 ملم زئبقي) لدى أزيد من 50% من الأورام الصلبة المتقدمة موضعيا.[11][12] تؤدي البيئة ناقصة التأكسج إلى عدم استقرار جيني عبر تنظيم بالإنقاص لآليات ترميم الدنا مثل: مساري ترميم استئصال النوكليوتيد وترميم الدنا غير المتطابق.[13] يسبب نقص التأكسج كذلك زيادة التعبير عن العامل المحدث بنقص التأكسج 1α [English] (HIF1-α) الذي يُحدث تولد الأوعية وهو مرتبط بمآل أسوء، كما ينشط الجينات المرتبطة بالانبثاث، ما يؤدي -على سبيل المثال- إلى زيادة هجرة الخلايا السرطانية وإعادة ترتيب المطرس خارج الخلوي.[4]
في حين أن عوز الأكسجين يمكن أن يسبب تحلل الجلوكوز في الخلايا، بعض الخلايا اللورمية تقوم بتحلل السكر الهوائي [English] وفيه يتم إنتاج حمض اللبنيك من الغلوكوز بشكل تفضيلي حتى مع توفر الأكسجينن ويسمى ذلك تأثير واربورغ.[14] ومهما كان السبب، يجعل ذلك البيئة المكروية خارج الخلوية حمضية (الأس الهيدروجيني 6.5–6.9) بينما تبقى الخلايا السرطانية محايدة (الأس الهيدروجيني 7.2–7.4).[15] تم إثبات أن هذه البيئة الحمضية للمطرس خارج الخلوي تحث على هجرة الخلايا سواء حيويا أو مخبريا، وربما تعزز تفكيك وهدم المطرس خارج الخلوي.[16][17]
مراجع
- ^ أ ب Alfarouk KO، Muddathir AK، Shayoub ME (يناير 2011). "Tumor acidity as evolutionary spite". Cancers. ج. 3 ع. 1: 408–14. DOI:10.3390/cancers3010408. PMC:3756368. PMID:24310355.
- ^ "NCI Dictionary of Cancer Terms". National Cancer Institute. 2 فبراير 2011. مؤرشف من الأصل في 2015-05-09.
- ^ Joyce JA، Fearon DT (أبريل 2015). "T cell exclusion, immune privilege, and the tumor microenvironment". Science. ج. 348 ع. 6230: 74–80. Bibcode:2015Sci...348...74J. DOI:10.1126/science.aaa6204. PMID:25838376.
- ^ أ ب Spill F، Reynolds DS، Kamm RD، Zaman MH (أغسطس 2016). "Impact of the physical microenvironment on tumor progression and metastasis". Current Opinion in Biotechnology. ج. 40: 41–48. DOI:10.1016/j.copbio.2016.02.007. PMC:4975620. PMID:26938687.
- ^ Korneev KV، Atretkhany KN، Drutskaya MS، Grivennikov SI، Kuprash DV، Nedospasov SA (يناير 2017). "TLR-signaling and proinflammatory cytokines as drivers of tumorigenesis". Cytokine. ج. 89: 127–135. DOI:10.1016/j.cyto.2016.01.021. PMID:26854213.
- ^ Ghoshdastider U، Rohatgi N، Mojtabavi Naeini M، Baruah P، Revkov E، Guo YA، Rizzetto S، Wong AM، Solai S، Nguyen TT، Yeong JP، Iqbal J، Tan PH، Chowbay B، Dasgupta R، Skanderup AJ (أبريل 2021). "Pan-Cancer Analysis of Ligand-Receptor Cross-talk in the Tumor Microenvironment". Cancer Research. ج. 81 ع. 7: 1802–1812. DOI:10.1158/0008-5472.CAN-20-2352. PMID:33547160. S2CID:232432582.
- ^ Standford Medicine Cancer Institute, Cancer Overview نسخة محفوظة 2013-09-21 على موقع واي باك مشين.
- ^ Duffy، Michael J. (1996). "The biochemistry of metastasis". Advances in Clinical Chemistry Volume 32. ص. 135–66. DOI:10.1016/S0065-2423(08)60427-8. ISBN:9780120103324. PMID:8899072.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ Palmer TN، Caride VJ، Caldecourt MA، Twickler J، Abdullah V (مارس 1984). "The mechanism of liposome accumulation in infarction". Biochimica et Biophysica Acta (BBA) - General Subjects. ج. 797 ع. 3: 363–8. DOI:10.1016/0304-4165(84)90258-7. PMID:6365177.
- ^ أ ب Danhier F، Feron O، Préat V (ديسمبر 2010). "To exploit the tumor microenvironment: Passive and active tumor targeting of nanocarriers for anti-cancer drug delivery". Journal of Controlled Release. ج. 148 ع. 2: 135–46. DOI:10.1016/j.jconrel.2010.08.027. PMID:20797419.
- ^ Weber CE، Kuo PC (سبتمبر 2012). "The tumor microenvironment". Surgical Oncology. ج. 21 ع. 3: 172–7. DOI:10.1016/j.suronc.2011.09.001. PMID:21963199.
- ^ Blagosklonny MV (يناير 2004). "Antiangiogenic therapy and tumor progression". Cancer Cell. ج. 5 ع. 1: 13–7. DOI:10.1016/S1535-6108(03)00336-2. PMID:14749122.
- ^ Bindra RS، Glazer PM (يناير 2005). "Genetic instability and the tumor microenvironment: towards the concept of microenvironment-induced mutagenesis". Mutation Research. ج. 569 ع. 1–2: 75–85. DOI:10.1016/j.mrfmmm.2004.03.013. PMID:15603753.
- ^ Gatenby RA، Gillies RJ (نوفمبر 2004). "Why do cancers have high aerobic glycolysis?". Nature Reviews. Cancer. ج. 4 ع. 11: 891–9. DOI:10.1038/nrc1478. PMID:15516961. S2CID:10866959.
- ^ Lee SH، Griffiths JR (يونيو 2020). "How and Why Are Cancers Acidic? Carbonic Anhydrase IX and the Homeostatic Control of Tumour Extracellular pH". Cancers. ج. 12 ع. 6: 1616. DOI:10.3390/cancers12061616. PMC:7352839. PMID:32570870.
- ^ van Sluis R، Bhujwalla ZM، Raghunand N، Ballesteros P، Alvarez J، Cerdán S، وآخرون (أبريل 1999). "In vivo imaging of extracellular pH using 1H MRSI". Magnetic Resonance in Medicine. ج. 41 ع. 4: 743–50. DOI:10.1002/(SICI)1522-2594(199904)41:4<743::AID-MRM13>3.0.CO;2-Z. PMID:10332850.
- ^ Estrella V، Chen T، Lloyd M، Wojtkowiak J، Cornnell HH، Ibrahim-Hashim A، وآخرون (مارس 2013). "Acidity generated by the tumor microenvironment drives local invasion". Cancer Research. ج. 73 ع. 5: 1524–35. DOI:10.1158/0008-5472.CAN-12-2796. PMC:3594450. PMID:23288510.