|
تضامنًا مع حق الشعب الفلسطيني |
إنزيم
إنزيم |

| جزء من سلسلة حول |
| كيمياء حيوية |
|---|
 |
| المكونات الرئيسية |
| التاريخ والموضوعات |
| بوابات: كيمياء حيوية |
الإنزيمات[1] هي محفِّزاتٌ بيولوجية جزيئة بروتينة. تسرِّعُ التفاعلات الكيميائية. تُسمى الجزيئات التي تمارس الأنزيمات تأثيرها عليها بالركائز، حيث يحوّل الإنزيم الركيزة إلى جزيئات تُعرف باسم النواتج. تحتاج معظم عمليات الاستقلاب (الأيض) إلى إنزيمات من أجل أن تحدث بسرعة كافية للحفاظ على الحياة.[2]:8.1 تحدد الإنزيمات في الخلية أي مسار استقلابي سيحدث في تلك الخلية. تُعرف دراسة الإنزيمات بالإنزيمولوجي وهناك حقل جديد فيه لتحليل «الإنزيمات الكاذبة» ينمو باستمرار، حيث يدرس هذا الحقل الإنزيمات التي فقدت قدرتها التحفيزية البيولوجية خلال التطور وهذا غالباً يؤثر على تسلسلات الأحماض الأمينية ويعطيها خصائص تحفيزية كاذبة غير عادية.[3][4]
تُعرف الإنزيمات بقدرتها على تحفيز أكثر من 5000 نوع من التفاعلات الكيميائية الحيوية.[5] معظم الإنزيمات بروتينات، ولكن بعضها جزيئات محفزة للرنا (RNA) تدعى ريبوزومات. تأتي نوعية الإنزيمات من بينتها ثلاثية الأبعاد المميزة.
تزيد الإنزيمات كما كل المحفّزات سرعة التفاعل من خلال تخفيض طاقة التنشيط. تصل قدرة بعض الإنزيمات حتى جعل تحوّل الركيزة إلى المنتج أسرع بملايين المرات من التحول دون وجود الإنزيم. أحد الأمثلة هو إنزيم أورتيدين 5'-فوسفات ديكربوكسيلاز الذي يسمح بتفاعل من الممكن خلال ثوانٍ، بينما سيتطلب هذا التفاعل دون الإنزيم ملايين السنين.[6][7] كيميائياً، لا تُستهلك الإنزيمات في التفاعلات الكيميائية ولا تقوم بتغيير التوازن في التفاعلات الكيميائية، كما كل الحفّازات الكيميائية. تتميز الإنزيمات عن بقية الحفّازات الكيميائية بنوعيتها الشديدة. يمكن أن يتأثر النشاط الإنزيمي بجزيئات معينة كالمثبطات التي تقلل من النشاط الإنزيمي، أو المنشطات التي تنشط عمل الإنزيم. الكثير من الأدوية العلاجية والسموم هي مثبطات إنزيمية. ينخفض النشاط الإنزيمي بشكل ملحوظ كذلك خارج درجة الحرارة والحموضة المثاليتين.
تُستخدم بعض الإنزيمات تجارياً، لتصنيع المضادات الحيوية مثلاً، حتى أن بعض المنتجات المنزلية تستخدم الإنزيمات لتسريع تفاعلات كيميائية معينة كبعض الإنزيمات الموجودة في مساحيق الغسيل الحيوية التي تحطم البروتينات أو النشا أو الدهون الموجودة الي تسبب بقع الملابس.
أصل الكلمة والتاريخ

بحلول أواخر القرن السابع عشر وبدايات القرن الثامن عشر، كان قد تم التعرّف على هضم المعدة للَّحم بواسطة مفرزاتها، [8] وتحويل النشا إلى سكاكر عبر المستخلصات النباتية واللعاب، إلا أن الآليات التي يتم من خلالها هذا كانت مجهولة.[9]
كان الكيميائي الفرنسي أنسيلم باين أول من اكتشف إنزيماً وهو إنزيم دي أسيتاز عام 1833.[10] بعد عدّة عقود وأثناء دراسة تخمّر السكر وتحوله إلى كحول بواسطة الخميرة، خلص لويس باستور أن قوةً حيوية هي من تسبب هذا التخمّر وهي موجودة في خلايا الخميرة، أطلق على هذه القوة اسم "Ferments" «التخمّر»، واِعْتُقِدَ أن التخمّر وظيفة موجودة فقط في الكائنات الحيّة. كتب باستر أن «التخمّر الكحولي فعل مرتبط بحياة وتنظيم خلايا الخميرة، وليس مرتبطاً بموت أو تعفّن هذه الخلايا».[11]
عام 1877، استخدم الفيزيولوجي الألماني فيلهام كون (1837-1900) المصطلح «إنزيم» للمرة الأولى، مشتَقَّةً من الكلمة اليونانية ἔνζυμον والتي تعني «مُخمَّر» أو «في الخميرة»، وقد استخدم هذا المصطلح النشاط كيميائي تقوم به الكائنات الحية.[12]
قدّم إدوارد بوخنر أول ورقة له عن دراسة مستخلصات الخمائر عام 1897. وجد بوخنر في سلسلة من التجارب التي أُجريت في جامعة برلين أن السكر تخمّر بواسطة مستخلصات الخمائر حتى عندما لم يحتوِ المزيج على خلايا خمائر حيّة [13] وأطلق اسم «زيماز» على الإنزيم الذي خمّر السكروز.[14] تلقى بوخنر جائزة نوبل في الكيمياء عام 1907 عن «اكتشافه التخمّر دون الخلايا». سُمِّيت الإنزيمات بعد بوخنر تبعاً للتفاعل الذي تقوم بإجراءه، حيث اِصطُلح على إدماج اللاحقة "ase" «از» مع اسم الركيزة (مثلاً اللاكتاز هو الإنزيم الذي يقسم اللاكتوز) أو مع اسم التفاعل (مثلاً دنا بوليميراز يقوم بتشكيل بوليميرات الحمض النووي الريبي منقوص الأوكسجين).[15]
لم يتم التعّرف على الهوية الكيمائية الحيوية للإنزيمات في بدايات القرن العشرين، على الرغم من أن الكثير من العلماء لاحظوا النشاط الإنزيمي الذي كان مترافقاً مع البروتينات، ولكن بعض العلماء الآخرين (منهم الحائز على جائزة نوبل ريتشارد فيلستاتر) جادلوا في أن البروتينات عبارة عن ناقلة للإنزيمات الحقيقية وأن البروتينات غير قادرة على التحفيز.[16] أظهر جيمس بي. سيمنر عام 1926 أن إنزيم اليوراز بروتينٌ نقيّ وقام ببلورته، قام بالمثل أيضاً عام 1937 مع إنزيم الكاتالاز. أثبت جون هوارد نورثروب وفيندل ميردريث ستانلي اللذان عملا على إنزيم الببسين الهاضم عام 1930 وإنزيم الكيموتربسين والتريبسين، أثبتا أن البروتينات النقية يمكن أن تكون إنزيمات. حصل هؤلاء العلماء الثلاثة على جائزة نوبل في الكيمياء عام 1946.[17]
مكّن اكتشاف إمكانية بلورة الإنزيمات من تحليل بنى الإنزيمات بدراسة البلورات بواسطة الأشعة السينية، وتم القيام بهذا الأمر للمرة الأولى من أجل دراسة إنزيم الليزوزوم، وهو إنزيم موجود في اللعاب والدموع وبياض البيض ويقوم هذا الإنزيم بهضم معطف بعض أنواع البكتيريا، حيث فُهِّم هيكل هذا الإنزيم من قبل مجموعة من العلماء يقودهم دافيد تشيلتون فيليبس، ونُشر الأمر 1965.[18] شكّل هيكل الليزوزوم عالي الدقة بدايةً لحقل البيولوجيا الهيكلية وبدايةً لجهود فهم كيف تعمل الإنزيمات على المستوى الذري.[19]
اصطلاحات التسمية
يُشتق اسم الإنزيم غالباً من ركيزته أو التفاعل الكيميائي الذي يحفّزه، مع اللاحقة «از» "ase" في النهاية.[2] ومن الأمثلة على ذلك اللاكتاز ونازعة هيدروجين الكحول ودنا بوليميراز. تُسمَّى الإنزيمات المختلفة التي تحفّز التفاعل الكيميائي نفسه بالإيزوزيمات أو النظائر الإنزيمية.[2]
طوّر الاتحاد الدولي للكيمياء الحيوية والبيولوجية الجزيئية نظام تسمية الإنزيمات، وهو رقم التصنيف الإنزيمي، حيث يُوصف كل إنزيم بواسطة تسلسل من أربعة أرقام مسبوقة بالسابقة "EC". يصنِّف الرقم الأول الإنزيمات على أساس آلية عملها.[20]
أعلى مستوى للتصنيف هو:
- EC1 إنزيمات أكسدة-إرجاع: تحفّز تفاعلات الأكسدة-إرجاع
- EC2 إنزيمات الترانسفيراز: ينقل زمرة وظيفية (كزمرة الميثيل أو الفوسفات)
- EC3 إنزيمات هيدرولاز: تحفّز تفاعلات التحلل المائي للعديد من الروابط
- EC4 إنزيمات اللياز: تقوم بإنشاء العديد من الروابط بوسائل غير التحلل المائي أو الأكسدة
- EC5 إنزيمات الإيزوميراز: تحفّز التغيرات التصاوغية في جزيئة واحدة
- EC6 إنزيمات الليغاز: تربط جزيئتين بواسطة رابطة تساهمية
هناك تقسيم فرعي لهذه الأقسام بحسب خصائص أخرى كالركيزة والنواتج والآلية الكيميائية. فالإنزيم نوعي لأربعة خصائص تصفها الخانات الأربعة في رقم التصنيف الإنزيمي. على سبيل المثال، الهكسوكيناز (EC 2.7.1.1) إنزيم ترانسفيراز أي إنزيم ناقل، يضيف مجموعة الفوسفات (EC 2.7) إلى جزيء الهكسوز، والهكسوز هو جزيء يحتوي على مجموعة كحولية (EC 2.7.1).[21]
البنية

عموماً تكون الإنزيمات بروتينات كروية، تمارس تأثيرها بمفردها أو في معقّدات أكبر. يحدد تسلسل الحموض الأمينية هيكل الإنزيم، والذي بدوره يحدد نشاطه التحفيزي.[22] على الرغم من أن البنية تحدد الوظيفة الإنزيمية، إلا أنه لا يُمكن التنبؤ بكامل النشاط الإنزيمي بواسطة البنية فقط.[23] يتمسخ الإنزيم عند التسخين أو عند التعرّض لممسخات كيميائية، ما يؤدي لحدوث خلخلة في بنية الإنزيم، يفقد الإنزيم بسببها نشاطه.[24] يرتبط تمسّخ الإنزيمات بدرجات الحرارة الأعلى من الأنواع الشائعة، لذلك فإن الإنزيمات التي تُستحصل من بكتيريا البيئات البركانية كالينابيع الساخنة تُعتبر ثمينة للغاية لقدرتها على القيام بوظائفها في ظل درجات حرارة عالية، مما يسمح للتفاعلات التي يشرف عليها الإنزيم بالحدوث بمعدّلات عالية جداً.
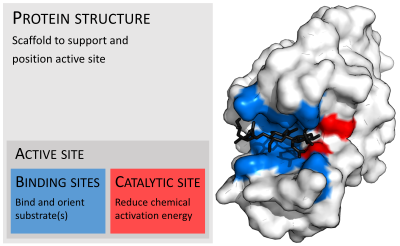
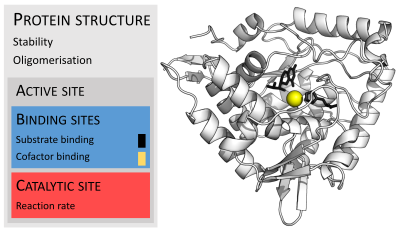
عادةً تكون الإنزيمات أكبر بكثير من ركائزها. تتفاوت أحجام الإنزيمات بين ثمالة من الأحماض الأمينية في موحود -أوكسالوكروتونات توتوميراز، [25] حتى أكثر من 2500 ثمالة في تصنيع الأحماض الدهنية الحيوانية.[26] يشترك في عملية التحفيز جزء صغير فقط من بنيتها (حوالي 2 إلى 4 حموض أمينية) وهو يسمى الموقع الحفّاز.[27] يقع الموقع الحفّاز قريباً من موقع رابط أو أكثر حيث توجّه الثمالات الركائز. يشكل الموقع الحفّاز والموقع الرابط سويةً موقع النشط في الإنزيم. معظم ما تبقى من بنية الإنزيم تخدم في الحفاظ على التوجيه الدقيق وديناميكية موقع النشط.[28]
في بعض الإنزيمات لا تشارك الأحماض الأمينية في التحفيز بشكل مباشر، بل يحتوي الإنزيم على مواقع تربط وتوجه العوامل المحفّزة المرافقة، أي أنه ينشط التفاعل بشكل غير مباشر.[28] يمكن أن تحتوي بنى الإنزيمات أيضاً على مواقع تفارغية حيث يؤدي ربط جزيء صغير إلى إحداث تغيير في التركيب يزيد أو يُنقص النشاط.[29]
الريبزيمات هي مجموعة صغيرة من المحفزات الحيوية التي تحفز تفاعلات رنا، يمكن أن يكون الإنزيم مفرداً أو ضمن معقّد. أشيع هذه الإنزيمات هو الريبوزوم وهو معقّد من البروتينات ومكّونات محفزة لرنا.[2]
الآلية
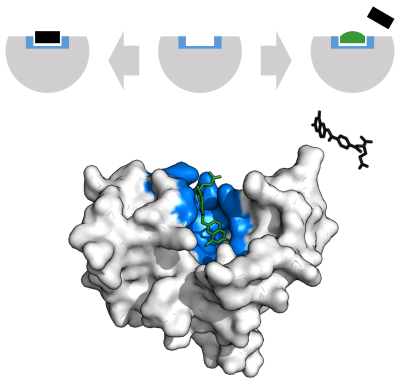
ربط الركيزة
يجب أن تربط الإنزيمات ركائزها قبل أن تحفّز تفاعلاتها.عادةً ما تكون الإنزيمات نوعية جداً بالنسبة لركائزها التي تربطها والتفاعلات التي تحفّزها. تتحدد هذه النوعية بجيوب الربط ذات الشكل والشحنة الملائمين بالإضافة إلى الصفة المحبة أو الكارهة للماء، بناء على الصفات السابقة تستطيع الإنزيمات التفريق بين الركائز المتشابهة جداً.[30]
تكون الإنزيمات المشاركة في عملية النسخ وتعبير الجينوم عالية الدقة والنوعية، حيث تمتلك بعض هذه الإنزيمات آلية «القراءة للإثبات» مثل إنزيم دنا بوليميراز الذي يحفّز تفاعلاً أولاً ومن ثم يتأكد من كون المنتج صحيحاً.[31] تؤدي هاتان الخطوتان إلى معدّل أخطاء أقل من 1 إلى 100 مليون تفاعل في بوليميراز عالية الدقة عند الثدييات.[2] هناك آليات تأكد شبيهة موجودة في رنا بوليميراز،[32] وأمينو أسيل رنا الناقل سينثيتازات،[33] والريبوزومات.[34]
و على العكس من ذلك يوجد العديد من الإنزيمات التي تظهر اختلاطاً إنزيمياً، حيث تمتلك نوعية واسعة وتمارس تأثيراً على ركائز عديدة مختلفة فيزيولوجياً. تؤدي العديد من الإنزيمات إلى حدوث نشاطات جانبية صغيرة، وقد تمثل هذه النشاطات نقطة بداية لانتقاء تطوّري لوظيفة جديدة.[35][36]
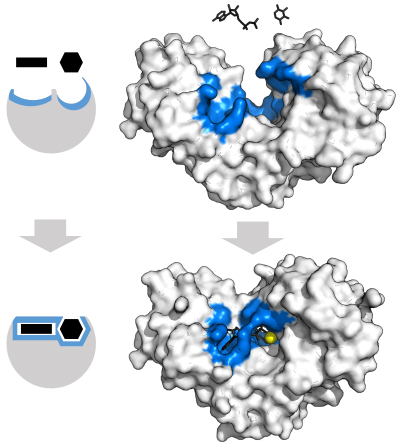
نموذج القفل والمفتاح
لشرح النوعية الملحوظة للإنزيمات اقترح إميل فيشر عام 1894 أن للإنزيم والركيزة أشكال هندسية محددة تناسب بعضها بعضاً.[37] تمت الإشارة إلى هذه الفكرة بـ«نموذج القفل والفتاح».[2] نجح هذا النموذج في تفسير نوعية الإنزيمات إلا أنه فشل في تفسير استقرار الحالة الانتقالية التي تحققها الإنزيمات.[38]
نموذج التلاؤم المُستحث
اقترح دانيال كوشلاند عام 1958 تعدلاً على نموذج القفل والمفتاح لأن هياكل الإنزيمات مرنة نوعاً ما، حيث يتغير شكل الموقع النشط باستمرار من خلال التفاعل مع الركيزة.[39] وبالنتيجة فإن الركيزة لا ترتبط ببساطة بموقع نشط جامد، أن السلاسل الجانبية للحموض الأمينية التي تكوّن الموقع النشط تتوضع في أماكن معينة بدقة بالغة حتى تمكّن الإنزيم من أداء وظيفته التحفيزية. يتغير شكل الركيزة أيضاً في بعض الحالات بمجرد دخولها للموقع النشط مثل إنزيم الغلوكوزيداز.[40] يستمر الموقع النشط بتغيير شكله حتى ترتبط الركيزة بشكل تام وتوفق هذه اللحظة تحديد الشكل النهائي وتوزع الشحنات.[41] يزيد التلاؤم المُستحث من دقة التعرّف الجزيئي في ظل وجود منافسة وضوضاء جزيئية، وهذا يكسب التفاعلات التي تتم بإشراف الإنزيم تدقيقاً للركائز.[42]
التحفيز
تحفّز الإنزيمات التفاعلات بطرائق عدة، تشترك هذه الطرق جميعها بمحلة خفض طاقة التنشيط.[43]
- عبر تثبيت الحالة الانتقالية:
- خلق بيئة مع توزع شحنات متكاملان مع الحالة الانتقالية لتخفيض طاقة التنشيط.[44]
- عبر توفير مسار تفاعلي بديل:
- يتم إحداث تفاعل مؤقت مع الركيزة، ويتشكل عبر هذا التفاعل وسيط يساهم في توفير طاقة تنشيط أقل للحالة الانتقالية.[45]
- عبر زعزعة استقرار الحالة الأرضية للركيزة:
- دفع الركيزة المرتبطة إلى الحالة الانتقالية لتقليل الطاقة المطلوبة للوصول إلى الحالة الانتقالية.[46]
- عبر توجيه الركائز إلى التفاعلات المنتجة لتقليل تغير إنتروبية التفاعل.[47] مساهمة هذه الآلية في التحفيز ضئيلة نسبياً.[48]
قد تستخدم الإنزيمات العديد من هذه الآليات في وقت واحد.
الديناميكية
الإنزيمات ليست هياكل جامدة ثابتة، بل على العكس من ذلك فإن للإنزيمات حركة ديناميكية داخلية معقدة، حيث تتحرك أجزاء من بنية الإنزيم كثمالات الأحماض الأمينية المفردة، أو الزمر لتشكل عروة بروتينية أو وحدة بنية ثانوية أو حتى نطاق بروتين كامل. تؤدي هذه الحركات إلى مجموعة متجانسة من البنى البروتينية المختلفة قليلاً التي تتداخل مع بعضها البعض عند التوازن. تؤدي هذه الحركات إلى اختلافات في وظائف الإنزيم باختلاف الحالات. على سبيل المثال إنزيم ديهيدروفولات ريدوكتاز يقوم بربط الركيزة ويحفّز ويطلق العامل المرافق ويطلق المنتج خلال دورة تحفيزه.[49]
التعديل التفارغي
تمثل المواقع التفارغية جيوب على الإنزيم، تتميز عن المواقع النشطة أنها تربط الجزيئات في البيئة الخلوية، حيث تسبب هذه الجزيئات فيما بعد تغييراً في شكل أو ديناميكية الإنزيم، وينتقل هذا التأثير إلى الموقع النشط، مما يؤدي إلى تغير معدل تفاعل الإنزيم.[50] بهذه الطريقة تنشط التعديلات التفارغية أو تثبط الإنزيم. ترفع التعديلات التفارغية مع المستقبلات أو تخفض من استخدام مسار الإنزيم الاستقلابي، وهي آلية تلقيم راجع تنظم التفاعل وتبدّل نشاط الإنزيم تبعاً للتدفق الأيضي عبر هذا المسار الأيضي.[51]
العوامل المرافقة

لا تحتاج بعض الإنزيمات إلى مكونات إضافية لإظهار نشاطها الكامل، بينما تتطلب بعض الإنزيمات وجود جزيئات غير بروتينية تدعى العوامل المرافقة.[52] يمكن أن تكون العوامل المرافقة مركبات عضوية (مثل الفلافين أو الهيم) أو غير عضوية (مثل أيونات المعادن). تقوم هذه العوامل المرافقة بالعديد من المهام للمساعدة في إنجاز مهمة الإنزيم. يمكن للعوامل المرافقة أن تكون مرافقات إنزيم تُطْلَق من موقع الإنزيم النشط أثناء التفاعل أو أن تكون مجموعات اصطناعية ترتبط بشدة بالإنزيم (كالبيوتين في إنزيمات كالبيروفات كاربوكسيلاز).[53]
مثال على إنزيم يحتوي على عامل مرافق هو الكاربونيك أنهيدراز وعامله المرافق الزنك المرتبط كجزء من موقعه النشط في الشكل أعلاه.[54] توجد عادةً الجزيئات أو الأيونات مرتبطة بشدةً بالموقع النشط للإنزيم لتشترك في التحفيز.[2]
تُدعى الإنزيمات التي يتطلب نشاطها وجود عوامل مرافقة إلا أنه لا تمتلك عاملاً مرافقاً بأبوإنزيم أو أبوبروتينات. بينما يُدعى الإنزيم مع عامله المرافق معاً بالهولوإنزيم (أو هالوإنزيم)، كما يطلق مصطلح هولوإنزيم على الإنزيمات التي تشتمل على وحدات فرعية عديدة للبروتين مثلاً إنزيمات دنا بوليميراز، حيث أن الهولوإنزيم هو المعقد الكامل الذي يحتوي على كل الوحدات الفرعية المطلوبة في هذا النشاط.[2]
العوامل المرافقة للإنزيمات
العوامل المرافقة للإنزيمات جزيئات عضوية صغيرة ترتبط ارتباطاً شديداً أو ضعيفاً بالإنزيم. تنقل العوامل المرافقة للإنزيم زمراً كيميائية من إنزيم إلى آخر.[55] مثلاً ثنائي نوكليوتيد الأدنين وأميد النيكوتين NADH وفوسفات ثنائي نيوكليوتيد الأدينين وأميد النيكوتين NADPH والأدينوزين ثلاثي الفوسفات ATP. تُشتق بعض العوامل المرافقة للإنزيمات من الفيتامينات مثلاً الفلافين أحادي النيكليوتيد FMN وثنائي نيوكليوتيد الفلافين والأدينين FAD والثيامين بيروفوسفات TPP وتيتراهيدروفولات THF، لا يمكن اصطناع هذه الإنزيمات المشتقة من الفيتامينات بشكل جديد de novo في الجسم، لذلك يجب الحصول على المكبات المرتبطة بها (الفيتامينات المشتقة منها) في حالات الحميات الغذائية. تشمل الزمر الكيميائية المحمولة أيون الهيدريد (H?) الذي تحمله مركبات NAD و NADP+، كذلك زمرة الفوسفات التي يحملها مركب الأدينوزين ثلاثي الفوسفات، زمرة الأستيل التي يحملها مرافق الإنزيم A ، زمر الفورميل أو الميثينيل أو الميثيل يحملها حمض الفوليك، وكذلك يحمل أدينوزيل ميثيونين S زمرة الميثيل.[55] يمكن اعتبار العوامل المرافقة للإنزيمات نوعاً خاصاً من الركائز نظراً لتغيرها الكيميائي نتيجة التفاعل الإنزيمي، أو يمكن اعتبارها ركائز ثانوية شائعة للعديد من الإنزيمات، مثلاً NADH يستخدمها أ: ثر من 1000 إنزيم معروف حتى الآن.[56] يتم تجديد العوامل المرافقة للإنزيمات بشكل مستمر وتبقى تراكيزها في مستوى ثابت تقريباُ داخل الخلية. مثلاً يتجدد NADH عبر سبيل البنتوز فوسفات، كذلك أدينوزيل ميثيونين S يتجدد بواسطة الميثيونين أدينوزيلترانسفيراز.
الديناميكا الحرارية
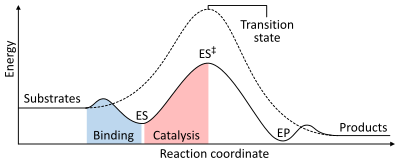
لا تغير الإنزيمات -كما كل الحفّازات- من اتجاه التفاعل الكيميائي، حيث يجري التفاعل في حالة وجود إنزيم في الاتجاه ذاته الذي كان سيسر فيه في حالة عدم وجود هذا الإنزيم، ولكن الفارق هو السرعة، حيث يزيد الإنزيم من سرعة التفاعل.[2] مثلاً الكاربونيك أنهيدراز يحفّز تفاعله في أحد الاتجاهين اعتماداً على تراكيز المواد المتفاعلة:[57]
-
(CO2 في الأنسجة يكون تركيز )
(1)
-
(في الرئتين يكون تركيز CO2 منخفض)
(2)
تعتمد سرعة التفاعل على طاقة التنشيط المطلوبة للوصول إلى الحالة الانتقالية، التي تنتهي بإطلاق النواتج. تزيد الإنزيمات من سرعة التفاعلات عبر خفض طاقة الحالة الانتقالية. أولاً يقوم الإنزيم بعملية ربط الركيزة ليتشكل معقد إنزيم-تحت ركيزة منخفض الطاقة (ES).ثانياً يؤسس الإنزيم للحالة الانتقالية التي تتطلب طاقةً أقل لتنجز التفاعل من تلك الطاقة المطلوبة في حالة التفاعل غير المُحفّز (ES‡). أخيراً يتحلل المعقّد إنزيم-نواتج (EP) ليطلق النواتج.[2] يمكن أن تنجز الإنزيمات تفاعلين أو أكثر، حيث تقوم تحفّز تفاعلاً مناسباً من ناحية الديناميكا الحرارية، يمكن أن يُستخدم هذا التفاعل ليؤدي لحدوث تفاعل ثاني غير مناسب من ناحية الديناميكا الحرارية بحيث يكون إجمالي طاقة المنتجات أقل من طاقة الركائز. مثلاً التحلل المائي للأزينزوين ثلاثي الفوسفات ATP يؤدي لحدوث تفاعلات كيميائية أخرى.[58]
حركية الإنزيمات
حركية الإنزيم هي التحقيق في كيفية ربط الإنزيم للركائز وتحويله إياهم إلى نواتج التفاعل. تستخدم بيانات سرعة التفاعل في تحليل حركية الإنزيم من خلال الحصول عليها عبر المقايسة الإنزيمية. اقترح ليونور ميكايليس وماود مينتين نظرية كميّة للحركية الإنزيمية، يُشار إلى تلك النظرية بـ«حركية ميكايليس و مينتين».[59] كانت مساهمة ميكايليس ومينتين الأعظم هي تفكيرهما في أن تفاعل الإنزيم يجري على خطوتين. بدايةً ترتبط الركيزة بشكل عكوس بالإنزيم ويتشكّل معقد إنزيم-ركيزة، يُدعى أحياناً بمعقد ميكايليس-مينتين تكريماً لهما. يحفّز الإنزيم الخطوة الكيميائية في التفاعل ويطلق النواتج. طُوِّر هذا العمل بواسطة جورج إدوارد بريغز وجون هولدين، الذان اشتقا المعادلات الحركية التي ما تزال مُستخدمة حتى يومنا هذا.[60]
تعتمد سرعة الإنزيم على ظروف الذوبانية وتركيز الركيزة. لاكتشاف أعلى سرعة لتفاعلٍ إنزيميّ ما يتم زيادة تركيز الركيزة حتى تصبح سرعة تشكيل النواتج ثابتة. يظهر هذا في منحنى الإشباع إلى اليمين. يحدث الإشباع بسبب ازدياد تركيز الركيزة، ومع ازدياد تركيز الركيزة يزداد تحول الإنزم الحر إلى معقّد نزيم-ركيزة، عند الوصول إلى أعلى سرعة للإنزيم (Vmax) تكون جميع المواقع النشطة في الإنزيم مرتبطة بالركيزة، وكمية المعقّد هي كل كمية الإنزيم.[2]
تعتبر أعظم سرعة للإنزيم Vmax أحد مقاييس الحركية الإنزيمية المهمة. كذلك فإن تركيز الركيزة اللازم لتحقيق سرعة إنزيم معينة هي قيمة مهمة أيضاً، وهي تُعطى من ثابت ميكايليس-مينتين (Km)، وهو تركيز الركيزة المطلوب ليصل الإنزيم إلى نصف سرعة تفاعله العظمى، ويمتلك كل إنزيم قيمة Km مميزة لركيزة معينة. هناك ثابت آخر مهم هو kcat وهو عدد جزيئات الركيزة التي يعالجها موقع نشط واحد في ثانية واحدة.[2]
يمكن التعبير عن فعالية إنزيم باستخدام المصطلحات kcat/Km. يدعى أيضاً يثابت النوعية وهو يدمج بين ثوابت سرعة كل خطوات التفاعل بما في ذلك أول خطوة غير عكوسة. يُستخدم ثابت النوعية للمقارنة بين الإنزيمات أو نفس الإنزيم بالنسبة لمختلف الركائز، وذلك لأن ثابت النوعية يعكس القدرة على الجذب والتحفيز. يُدعى الحد الأقصى نظرياً لثابت النوعية بحد الانتشار وهو حوالي 108 إلى 109 (M?1 s?1). عند هذا الحد يؤدي كل تصادم بين الركيزة والإنزيم إلى تحفيز تفاعل، ويكون معدل تكوين النواتج غير محصور بمعدل التفاعل بل بحد الانتشار. تدعى الإنزيمات التي تتحلى بهذه الخاصية بالإنزيمات المثالية حركياً أو تحفيزياً. على سبيل المثال التريوز-فوسفات إيزوميراز، والكاربونيك أنهيدراز، والأستيل كولين إستيراز، والكاتالاز، والفوماراز، وبيتا لاكتاماز، وسوبر أكسيد ديسميوتاز.[2] يمكن أن تصل قيمة kcat لهذه الإنزيمات حتى ملايين التفاعلات خلال ثانية.[2]
تعتمد حركية ميكايليس-مينتين على قانون فاعلية الكتلة، المستمد من فرضيات الانتشار الحر ومن ناحية الديناميكا الحرارية فهو مشتق من الاصطدام العشوائي. لكن العديد من العمليات الخلوية والكيميائية الحيوية تنحرف بشكل كبير عن هذه الظروف، وذلك بسبب الحشد الجزيئي الهائل وتقييد الحركة الجزيئية.[61] أُضيف إلى النموذج إضافات معقّدة في محاولة لتصحيح هذه التأثيرات.[62]
التثبيط
يمكن أن تنفض سرعات تفاعل إنزيمي بمثبطات الإنزيم المتنوعة.[63]
أنماط المثبطات
المثبط التنافسي
لا يمكن أن يرتبط المثبط التنافسي والركيزة مع الإنزيم في الوقت ذاته.[64] معظم المثبطات التنافسية تشبه بشكل كبير ركائز الإنزيمات التي تثبطها. على سبيل المثال، عقار الميثوتركسات مثبط تنافسي لإنزيم ديهيدروفولات ريدوكتاز الذي يحفّز إرجاع ديهيدروفولات إلى تيتراهيدروفولات. في الشكل المجاور يظهر التشابه بين بنية الميثوتركسات والديهيدروفولات. يمكن التغلب على التثبيط في هذه الحالة بزيادة تركيز الركيزة. في بعض الحالات يرتيط المثبط بموقع غير الموقع الرابط للركيزة المعتادة ويمارس تأثيراً تفارغياً يغير بموجبه الشكل المعتاد للموقع الرابط.
المثبط غير التنافسي
يرتبط المثبط غير التنافسي بموقع غير موقع ربط الركيزة. ترتبط الركيزة وتتمتع بألفتها المعتادة وتبقى قيمة Km ذاتها. يقوم المثبط بخفض الفعالية التحفيزية للإنزيم فتنخفض بذلك قيمة السرعة العظمى Vmax. على النقيض من المثبط التنافسي، فإن المثبط غير التنافسي لا يمكن التغلب عليه عبر زيادة تركيز الركيزة.[63]
مثبط ضد التنافسي
لا يستطيع المثبط ضد التنافسي أن يرتبط بالإنزيم الحر، بل يرتبط فقط بالمعقد إنزيم-ركيزة، وبالتالي فإن هذا النوع من المثبطات هو الأكثر فعالية في التراكيز المرتفعة من الركيزة. في وجود المثبط يصبح المعقد إنزيم-ركيزة غير فعّال.[63] إلا أن هذا النوع من المثبطات نادر.[65]
مختلط
يرتبط المثبط المختلط بموقع تفارغي ويتآثر ارتباط الركيزة وارتباط المثبط. تقلّ وظيفة الإنزيم ولكن لا تختفي عند ارتباط المثبط به. هذا النوع من الثبطات لا يتبع لمعادلة ميكايليس-مينتين.[63]
المثبط غير العكوس
اليعطل المثبط غير العكوس الإنزيم بشكل دائم، وذلك عادةً عبر تشكيل رابطة تساهمية للبروتين. من الأمثلة الشائعة عن هذه الطريقة أدوية البنسلين،[66] والأسبرين.[67]
وظائف المثبطات
تعتبر المثبطات جزءاً من آليات التلقيم الراجع في العديد من الأحياء. فإذاا أنتج إنزيم ما كمية أكبر من اللازم لركيزة ما في الكائن الحي، يمكن لهذه المادة المنتجة أن تمارس دوراً مثبطاً لهذا الإنزيم في المراحل الأولى من المسار الإنتاجي، مما يؤدي لإبطاء إنتاج هذه المادة أو إيقافه عند وجود كمية كافية منها. يعتبر هذا شكلاً من أشكال التقليم الراجع السلبي. تستخدم مسارات الاستقلاب الرئيسية هذه الآلية.[2]
بما أن مثبطات الإنزيم تعدل الوظيفة الإنزيمية فقد اِستُخدمت كأدوية. العديد من الأدوية هي مثبطات تنافسية عكوسة تشبه ركيزة الإنزيم الأصلية، كما هو الحال في مثال الميثوتركسات أعلاه، من الأمثلة المعروفة الأخرى الستاتينات التي تستخدم لمعالجة الكوليسترول المرتفع،[68] ومثبطات إنزيم البروتياز التي تستخدم لعلاج عدوى الفيروس العكسي كفيروس HIV.[69] أما الأسبرين فيعتبر مثالاً شائعاً للمثبطات الإنزيمية غير العكوسة التي تستعمل دوائياً، وهو يثبط إنزيمات COX-1 و COX-2 التي تنتج البروستاجلاندين رسول الالتهاب.[67] المثبطات الإنزيمية الأخرى سموم، مثلاً سم السيانيد هو مثبط إنزيمي غير عكوس يجتمع مع النحاس والحديد في الموقع النشط للإنزيم السيتوكروم سي أوكسيداز ويقوم بإحصار التنفس الخلوي.[70]
الوظيفة البيولوجية
يقوم الإنزيم بوظائف عديدة داخل الكائن الحي. فلا غنى عن الإنزيمات من أجل التنبيه الإشاري في التنظيم الخلوي وغالباً عبر إنزيمات الكيناز والفوسفاتاز.[71] كما أنها تقوم بتوليد الحركة عبر توليد التقلص العضلي ونقل المواد عبر الخلية كجزء من الهيكل الخلوي.[72] إنزيمات أخرى مرتبطة بـ ATP موجودة في غشاء الخلية وهي مضخات أيونية تقوم بالنقل الفاعل لهذه الأيونات عبر الغشاء. تشترك الإنزيمات كذلك في وظائف أكثر غرابةً كتوليد الضوء في اليراعات.[73] يمكن أن تحتوي الفيروسات أيضاً على إنزيمات تقوم بوظائف دخل الخلية المصابة مثل إنزيم HIV إنترغاز، وترانسكريبتاز العكسي، أو لإطلاق الفيروس من الخلية مثل إنزيمات نيورامينيداز الخاص بفيروس الإنفلونزا.[74] في الحيوانات تظهر وظيفة هامة للإنزيمات في الجهاز الهضمي كإنزيمات الأميلاز والبروتياز التي تقوم بتحطيم الجزيئات الكبيرة (النشا والبروتينات على التوالي) إلى جزيئات صغيرة، لتتمكّن الأمعاء من امتصاصها. مثلاً جزيئات النشا كبيرة جداً لتستطيع الأمعاء امتصاصها، تقوم الإنزيمات بحلمهة هذه سلاسل النشا الطويلة إلى جزيئات صغيرة كالمالتوز ومن ثم تنتهي إلى جزيئات غلوكوز هي قابلة للامتصاصا في الأمعاء. تختلف الإنزيمات الهاضمة باختلاف ركائزها. في المجترات ذات النظام الغذائي العاشب، تنتج الأحياءالدقيقة داخل أمعائها إنزيم السيللوز الذي يكسر جدران الخلايا النباتية في الألياف النباتية.[75]
الاستقلاب

العديد من الإنزيمات يمكن أن تعمل معاً في تكامل من أجل صنع مسار استقلابي.[2] في المسار الاستقلابي، يأخذ الإنزيم نواتج الإنزيم السابق كركيزة له، ومن ثم تمرر نواتج التفاعل إلى الإنزيم الذي يليه ليستخدمه كركيزة. في بعض الأحيان قد يُحفّز التفاعل بأكثر من إنزيم بشكل متوازي، يسمح هذا التحفيز بتنظيم أكثر تعقيداً، على سبيل المثال انخفاض النشاط التفاعلي لأحد الإنزيمات بينما يستمر النشاط في إنزيم ثاني.[76] تحدد الإنزيمات الخطوات التي تحدث في هذه المسارات الاستقلابية. وبدون الإنزيمات لن تستمر العلميات الاستقلابية في الخطوات نفسها، ولا يمكن حتى تنظيم الاستقلاب لتلبية احتياجات الخلية. معظم المسارات الاستقلابية المركزية تُنظَّم عبر خطوات مفتاحية، عبر الإنزيمات من خلال الإنزيمات ذات النشاط المرتبط بحلمهة ATP، لأن هذه التفاعلات تطلق كمية كبيرة من الطاقة، بينما يوجد تفاعلات أخرى غير مناسبة من ناحية الديناميكا الحرارية يمكن أن تقترن بحلمهة ATP، حيث تمثل حلمهة ATP شرارة كل أنماط التفاعلات الاستقلابية التي تليها.[2]
التحكم في النشاط
هناك خمسة طرق رئيسية للتحكم بنشاط الإنزيم في الخلية.[2]
التنظيم
يمكن للإنزيمات أن تكون منشطة أو مثبطة بواسطة جزيئات عديدة. على سبيل المثال المنتج (أو المنتجات) النهائي لأحد المسارات الاستقلابية غالباً هي مثبطات لواحد من الإنزيمات الأولى في هذا المسار، هذه الآلية من التنظيم تُدعى بالتلقيم الراجع السلبي، لأن كمية المنتج النهائي التي يتم إنتاجها يتم ضبطها عبر تركيز هذا المنتج.[77] يمكن لآلية التلقيم الراجع السلبي أن تضبط بشكل فعّال معدل تخليق المستقلبات المتوسطة تبعاً لطلب الخلايا. تساعد هذه الآلية في تخصيص فعّال للمواد واقتصاد في الطاقة وتمنع تصنيع فائض من المنتجات النهائية. التحكم في الفعل الإنزيمي يساعد عفي الحفاظ على بيئة داخلية متوازنة في المتعضيات الحية كما كل أجهزة ضبط الاستتباب الداخلي.[77]
تعديل بعد الترجمة
تتضمن الأمثلة على آلية التعديل بعد الترجمة الفسفرة والغلكزة.[77] مثلاً في الاستجابة للإنسولين، تتم فسفرة إنزيمات متعددة بما في ذلك الغليكوجين سينثاز ، تساعد هذه الفسفرة في التحكم في تصنيع أو تقويض الغليكوجين وتسمح للخلايا بالاستجابة للتغيرات في السكر الدم.[78] مثالٌ آخر على التعديل بعد الترجمة هو تقسيم سلسلة عديد الببتيد، مثلاً إنزيم الكيموتربسين وهو من نوع إنزيمات البروتياز، يتم إنتاجه في البنكرياس ويكون اسمه الكيموتربسينوجين أو مولد الكيموتربسين وهو الشكل غير الفعّال، ومن ثم يُنقل وهو في الشكل غير الفعّال إلى المعدة حيث يتم تفعيله. هذا السلوك يمنع الإنزيم من هضم البنكرياس أو الأنسجة الأُخرى قبل أن يدخل لمعة المعي. هذا النمط من طليعة الإنزيم غير الفعّالة تُعرف باسم طليعة الإنزيم.
الكمية
يمكن أن ينخفض أو يزداد إنتاج الإنزيم (نسخ وترجمة جينات الإنزيم) في الخلية كاستجابة للتغيرات في بيئة الخلية. هذا النموذج من التنظيم الجيني يدعى بتحريض الإنزيم. مثلاً إنزيم السيتوكروم بي450 أوكسيداز في الكبد وهو مهم جداً في استقلاب الأدوية. يمكن أن يؤدي تحريض أو تثبيط هذه الإنزيمات إلى تداخلات دوائية.[79] مستويات الإنزيم يمكن أن تُنظم أيضاً عبر تغيير معدل تقويض الإنزيم.[2]
التوزيع داخل الخلوي
يمكن أن تُجزأ الإنزيمات عبر مسارات استقلابية تحدث في الحجرات الخلوية المختلفة. مثلاً تُصنّع الحموض الدسمة بواسطة مجموعة واحدة من الإنزيمات في العصارة الخلوية والشبكة الإندوبلازمية وجهاز غولجي، بينم تستخدم من قبل مجموعة مختلفة من الإنزيمات كمصدر للطاقة في الميتاكوندريا عبر أكسدة بيتا.[80] بالإضافة إلى ذلك فإن نقل الإنزيم إلى حجرات مختلفة يمكن أن يغير في درجة البروتونات (حيث السيتوبلاسم محايد بينما الليزوزوم حامضي) أو في الحالة التأكسدية، وهذا يؤثر على نشاط الإنزيم.[81]
اختصاص الأعضاء
في عديدات الخلايا حقيقيات النوى، تمتلك الخلايا في النسج المختلفة أنماطاً مختلفة في التعبير الجيني، لذا فإنها تمتلك مجموعات مختلفة من الإنزيمات (تُعرف باسم الإيزوزيمات) متاحة للتفاعلات الاستقلابية. هذا يوفر آلية للتنظيم لكل استقلاب العضوية. مثلاً الهيكسوكيناز أول إنزيم في سبيل تحلل الغلوكوز له شكل خاص يدعى الغلوكوكيناز يتم التعبير عنه في الكبد والبنكرياس، لهذا الشكل من الإنزيم ألفة منخفضة للغلوكوز ولكنه أكثر حساسية لتركيز الغلوكوز.[82] يشترك هذا الإنزيم في التحسس لسكر الدم وتنظيم إنتاج الأنسولين.[83]
المشاركة في الأمراض
يعتبر التحكم الصارم في نشاط الإنزيم أمراً ضرورياً للاستتباب، حيث أن أي خلل (طفرة، أو إنتاج مفرط، أو إنتاج أقل، أو حذف) في إنزيم حرج واحد يقود إلى مرض وراثي. الخلل في نوع واحد من الإنزيمات من بين آلاف الأنواع الموجودة في جسم الإنسان يمكن أن يكون قاتلاً. من الأمثلة على الأمراض الوراثية القاتلة بسبب قصور إنزيم مرض تاي-ساكس حيث يكون لدى المريض عوز في إنزيم الهيسكوسامينيداز.[84][85]
أحد أمثلة عوز الإنزيم هو النمط الأكثر شيوعاً من بيلة الفينيل كيتون. العديد من الطفرات في أحماض أمينية مفردة في إنزيم الفينيل ألانين هيدروكسيلاز، وهو الإنزيم الذي يحفز الخطوة الأولى في تقويض الفينيل ألانين، وهذا ما يؤدي إلى تراكم الفينيل ألانين والمنتجات ذات الصلة. توجد بعض الطفرات في الموقع النشط، تعطِّل بشكل مباشر الارتباط والتحفيز، ولكن العديد من الطفرات تكون بعيدة عن الموقع النشط وهي تقلل النشاط عبر زعزعة استقرار بنية البروتين، أو عبر آليات أخرى.[86][87] يمكن أن يؤدي هذا إلى إعاقة ذهنية إذا لم يُعَالَج المرض.[88] مثالٌ آخر هو عوز كولين إستيراز الكاذب، في هذه الحالة تضعف قدرة الجسم على تحطيم أدوية كولين إستير.[89] حالات قصور الإنزيمات الوظيفية يمكن علاجها عبر الإعطاء الفموي للإنزيمات مثل قصور البنكرياس[90] وعدم تحمل اللاكتوز.[91]
كما أن هناك طرقاً أخرى تحدث أمراض فيها بسبب خلل إنزيمي يأتي من طفرات جرثومية في الجينات المرمّزة لإنزيمات إصلاحدنا. تسبب العيوب في هذه الإنزيمات سرطاناً لأن الخلايا تصبح أقل قدرةً على إصلاح الطفرات في جينوماتها. هذا يسبب تراكم بطيء للطفرات ويؤدي إلى تطور السرطانات. مثلاً متلازمة السرطان الوراثي هي جفاف الجلد المصطبغ، وهي تسبب تطور سرطانات الجلد استجابةً للحد الأدنى من التعرض للأشعة فوق البنفسجية.[92][93]
تطبيقات صناعية
تستخدم الإنزيمات في الصناعات الكيمائية والتطبيقات الصناعية الأخرى عندما يكون هناك حاجة لمحفّزات نوعية للغاية. عموماً الإنزيمات محدودة في التفاعلات التي تحفّزها، لأنها تطورت لتحفز هذه التفاعلات بالإضافة إلى عدم استقرارها في المذيبات العضوية وفي درجات الحرارة المرتفعة. نتيجةً لذلك، فإن هندسة البروتين هي مجال بحث نشيط يحاول أن يصنع إنزيمات جديدة إما من خلال تصميم عقلاني أو من خلال التطوير في المخبر.[94][95] بدأت تلقى هذه الجهود نجاحاً، حيث قد تم بالفعل تصميم بعض الإنزيمات «من الصفر» لتحفيز تفاعلات لا تحدث في الطبيعة.[96]
| التطبيق | الإنزيمات المستخدمة | الاستخدامات |
|---|---|---|
| صناعة الوقود الحيوي | إنزيمات السليولاز | تحطيم السيللوز إلى جزيئات سكرية يمكن تخميرها للحصول على إيثانول سليولوزي.[97] |
| إنزيمات اللينغيناز | المعالجة الأولية للكتلة الحيوية من أجل إنتاج الوقود الحيوي.[97] | |
| المنظفات الحيوية | إنزيمات البروتياز، والأميلاز، والليباز | إزالة البقع البروتينية والدهنية والزيتية وبقع النشاء من الغسيل والأطباق.[98] |
| إنزيمات المانّاز | إزالة بقع الطعام من إضافات الطعام الشائعة صمغ الغوار.[98] | |
| صناعة الجعة | إنزيمات الأميلاز، والغلوكوناز، والبروتياز | تقسيم عديدات السكريات والبروتينات في الجعة.[99]:150–9 |
| إنزيمات بيتا غلوكاناز | تحسين خصائص ترشيح النبتة والبيرة.[99]:545 | |
| إنزيمات الأميلوغلوكوزيداز، والبولولوناز | صنع بيرة منخفضة السعرات الحرارية ضبط التخمير.[99]:575 | |
| إنزيمات أسيتولاكتات ثنائي كاربوكسيلاز (ALDC) | زيادة فعالية التخمير عبر إنقاص تشكيل دي أستيل.[100] | |
| استخدامات في الطبخ | باباين | ترقيق اللحوم من أجل الطبخ.[101] |
| إنتاج الحليب | الرينين (يسمى أيضاً الكيموسين) | تحليل البروتين في تصنيع الجبن.[102] |
| إنزيمات الليباز | إنتاج جبن كامامبير والأجبان الزرقاء كجبن روكفور.[103] | |
| معالجة الطعام | إنزيمات الأميلاز | إنتاج السكريات من النشا كما في صناعة شراب الذرة عالي الفركتوز.[104] |
| إنزيمات البروتياز | خفض مستوى البروتين في الدقيق كما هو الحال في صناعة البسكويت.[105] | |
| التربسين | صناعة أطعمة الأطفال من أجل حالات الحساسية.[105] | |
| إنزيمات السليولاز، والبيكتيناز | تنقية عصائر الفواكه.[106] | |
| البيولوجيا الجزيئية | إنزيمات النوكلياز، ودنا ليغاز، والبوليميراز | استخدام الهضم المُقيَّد، وتفاعل بلمرة السلاسل لصناعة الحمض النووي.[2]:6.2 |
| صناعة الورق | إنزيمات الزيلاناز، والهيميسليولاز، واللينغين بيروكسيداز | إزالة الليجنين من عجينة ورق كرافت.[107] |
| العناية الشخصية | إنزيمات البروتياز | إزالة البروتينات من العدسات اللاصقة لمنع العدوى.[108] |
| صناعة النشا | إنزيمات الأميلاز | تحويل النشا إلى غلوكوز وشرابات مختلفة.[109] |
اقرأ أيضا
مراجع
- ^ Q114972534، ص. 22، QID:Q114972534
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف Stryer L، Berg JM، Tymoczko JL (2002). Biochemistry (ط. 5th). San Francisco: W.H. Freeman. ISBN:0-7167-4955-6. مؤرشف من الأصل في 2020-12-25.

- ^ Murphy JM, Farhan H and Eyers PA (2017) Bio-Zombie: the rise of pseudoenzymes in biology.Biochem Soc Trans. 45:537-544
- ^ Murphy JM، وآخرون (2014). "A robust methodology to subclassify pseudokinases based on their nucleotide-binding properties". Biochemical Journal. ج. 457 ع. 2: 323–334. DOI:10.1042/BJ20131174. PMID:24107129.
- ^ Schomburg I، Chang A، Placzek S، Söhngen C، Rother M، Lang M، Munaretto C، Ulas S، Stelzer M، Grote A، Scheer M، Schomburg D (يناير 2013). "BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA". Nucleic Acids Research. ج. 41 ع. Database issue: D764–72. DOI:10.1093/nar/gks1049. PMC:3531171. PMID:23203881.
- ^ Radzicka A، Wolfenden R (يناير 1995). "A proficient enzyme". Science. ج. 267 ع. 5194: 90–931. Bibcode:1995Sci...267...90R. DOI:10.1126/science.7809611. PMID:7809611.
- ^ Callahan BP، Miller BG (ديسمبر 2007). "OMP decarboxylase—An enigma persists". Bioorganic Chemistry. ج. 35 ع. 6: 465–9. DOI:10.1016/j.bioorg.2007.07.004. PMID:17889251.
- ^ de Réaumur RA (1752). "Observations sur la digestion des oiseaux". Histoire de l'academie royale des sciences. ج. 1752: 266, 461.
- ^ Williams، Henry Smith (1904). A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences. Harper and Brothers. مؤرشف من الأصل في 2012-05-09.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Payen A, Persoz JF (1833). "Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels" [Memoir on diastase, the principal products of its reactions, and their applications to the industrial arts]. Annales de chimie et de physique. 2nd (بالفرنسية). 53: 73–92. Archived from the original on 2020-04-11.
- ^ Manchester KL (ديسمبر 1995). "Louis Pasteur (1822–1895)–chance and the prepared mind". Trends in Biotechnology. ج. 13 ع. 12: 511–5. DOI:10.1016/S0167-7799(00)89014-9. PMID:8595136.
- ^ Holmes، Frederic Lawrence (2003). "Enzymes". في Heilbron، John L. (المحرر). The Oxford Companion to the History of Modern Science. Oxford: Oxford University Press. ص. 270.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ "Eduard Buchner". Nobel Laureate Biography. Nobelprize.org. مؤرشف من الأصل في 2018-07-24. اطلع عليه بتاريخ 2015-02-23.
- ^ "Eduard Buchner – Nobel Lecture: Cell-Free Fermentation". Nobelprize.org. 1907. مؤرشف من الأصل في 2018-08-13. اطلع عليه بتاريخ 2015-02-23.
- ^ The naming of enzymes by adding the suffix "-ase" to the substrate on which the enzyme acts, has been traced to French scientist Emile Duclaux (1840–1904), who intended to honor the discoverers of دياستيز – the first enzyme to be isolated – by introducing this practice in his book Duclaux E (1899). Traité de microbiologie: Diastases, toxines et venins [Microbiology Treatise: diastases , toxins and venoms] (بالفرنسية). Paris, France: Masson and Co. Archived from the original on 2020-10-14. See Chapter 1, especially page 9.
- ^ Willstätter R (1927). "Faraday lecture. Problems and methods in enzyme research". Journal of the Chemical Society (Resumed): 1359. DOI:10.1039/JR9270001359. quoted in Blow D (April 2000). "So do we understand how enzymes work?" (PDF). Structure (London, England : 1993). ج. 8 ع. 4: R77–R81. DOI:10.1016/S0969-2126(00)00125-8. PMID:10801479. مؤرشف من الأصل (pdf) في 9 أغسطس 2017. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ "Nobel Prizes and Laureates: The Nobel Prize in Chemistry 1946". Nobelprize.org. مؤرشف من الأصل في 2018-08-04. اطلع عليه بتاريخ 2015-02-23.
- ^ Blake CC، Koenig DF، Mair GA، North AC، Phillips DC، Sarma VR (مايو 1965). "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 ?ngstr?m resolution". Nature. ج. 206 ع. 4986: 757–61. Bibcode:1965Natur.206..757B. DOI:10.1038/206757a0. PMID:5891407.
- ^ Johnson LN، Petsko GA (1999). "David Phillips and the origin of structural enzymology". Trends Biochem. Sci. ج. 24 ع. 7: 287–9. DOI:10.1016/S0968-0004(99)01423-1. PMID:10390620.
- ^ Nomenclature Committee. "Classification and Nomenclature of Enzymes by the Reactions they Catalyse". International Union of Biochemistry and Molecular Biology (NC-IUBMB). School of Biological and Chemical Sciences, Queen Mary, University of London. مؤرشف من الأصل في 2017-09-17.
- ^ Nomenclature Committee. "EC 2.7.1.1". International Union of Biochemistry and Molecular Biology (NC-IUBMB). School of Biological and Chemical Sciences, Queen Mary, University of London. مؤرشف من الأصل في 2017-06-08.
- ^ Anfinsen CB (يوليو 1973). "Principles that govern the folding of protein chains". Science. ج. 181 ع. 4096: 223–30. Bibcode:1973Sci...181..223A. DOI:10.1126/science.181.4096.223. PMID:4124164.
- ^ Dunaway-Mariano D (نوفمبر 2008). "Enzyme function discovery". Structure (London, England : 1993). ج. 16 ع. 11: 1599–600. DOI:10.1016/j.str.2008.10.001. PMID:19000810.
- ^ Petsko، Gregory A.؛ Ringe، Dagmar (2003). "Chapter 1: From sequence to structure". Protein structure and function. London: New Science. ص. 27. ISBN:978-1405119221.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Chen LH، Kenyon GL، Curtin F، Harayama S، Bembenek ME، Hajipour G، Whitman CP (سبتمبر 1992). "4-Oxalocrotonate tautomerase, an enzyme composed of 62 amino acid residues per monomer". The Journal of Biological Chemistry. ج. 267 ع. 25: 17716–21. PMID:1339435.
- ^ Smith S (ديسمبر 1994). "The animal fatty acid synthase: one gene, one polypeptide, seven enzymes". FASEB Journal. ج. 8 ع. 15: 1248–59. PMID:8001737.
- ^ "The Catalytic Site Atlas". The European Bioinformatics Institute. مؤرشف من الأصل في 2018-09-27. اطلع عليه بتاريخ 2007-04-04.
- ^ أ ب Suzuki H (2015). "Chapter 7: Active Site Structure". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 117–140. ISBN:978-981-4463-92-8.
- ^ Krauss G (2003). "The Regulations of Enzyme Activity". Biochemistry of Signal Transduction and Regulation (ط. 3rd). Weinheim: Wiley-VCH. ص. 89–114. ISBN:9783527605767.
- ^ Jaeger KE، Eggert T (أغسطس 2004). "Enantioselective biocatalysis optimized by directed evolution". Current Opinion in Biotechnology. ج. 15 ع. 4: 305–13. DOI:10.1016/j.copbio.2004.06.007. PMID:15358000.
- ^ Shevelev IV، Hübscher U (مايو 2002). "The 3' 5' exonucleases". Nature Reviews Molecular Cell Biology. ج. 3 ع. 5: 364–76. DOI:10.1038/nrm804. PMID:11988770.
- ^ Zenkin N، Yuzenkova Y، Severinov K (يوليو 2006). "Transcript-assisted transcriptional proofreading". Science. ج. 313 ع. 5786: 518–20. Bibcode:2006Sci...313..518Z. DOI:10.1126/science.1127422. PMID:16873663.
- ^ Ibba M، Soll D (2000). "Aminoacyl-tRNA synthesis". Annual Review of Biochemistry. ج. 69: 617–50. DOI:10.1146/annurev.biochem.69.1.617. PMID:10966471.
- ^ Rodnina MV، Wintermeyer W (2001). "Fidelity of aminoacyl-tRNA selection on the ribosome: kinetic and structural mechanisms". Annual Review of Biochemistry. ج. 70: 415–35. DOI:10.1146/annurev.biochem.70.1.415. PMID:11395413.
- ^ Khersonsky O، Tawfik DS (2010). "Enzyme promiscuity: a mechanistic and evolutionary perspective". Annual Review of Biochemistry. ج. 79: 471–505. DOI:10.1146/annurev-biochem-030409-143718. PMID:20235827.
- ^ O'Brien PJ، Herschlag D (أبريل 1999). "Catalytic promiscuity and the evolution of new enzymatic activities". Chemistry & Biology. ج. 6 ع. 4: R91–R105. DOI:10.1016/S1074-5521(99)80033-7. PMID:10099128.
- ^ Fischer E (1894). "Einfluss der Configuration auf die Wirkung der Enzyme" [Influence of configuration on the action of enzymes]. Berichte der Deutschen chemischen Gesellschaft zu Berlin (بالألمانية). 27 (3): 2985–93. DOI:10.1002/cber.18940270364. Archived from the original on 2020-11-27. From page 2992: "Um ein Bild zu gebrauchen, will ich sagen, dass Enzym und Glucosid wie Schloss und Schlüssel zu einander passen müssen, um eine chemische Wirkung auf einander ausüben zu k?nnen." (To use an image, I will say that an enzyme and a glucoside [i.e., glucose derivative] must fit like a lock and key, in order to be able to exert a chemical effect on each other.)
- ^ Cooper GM (2000). "Chapter 2.2: The Central Role of Enzymes as Biological Catalysts". The Cell: a Molecular Approach (ط. 2nd). Washington (DC ): ASM Press. ISBN:0-87893-106-6. مؤرشف من الأصل في 2019-12-16.
- ^ Koshland DE (فبراير 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proceedings of the National Academy of Sciences of the United States of America. ج. 44 ع. 2: 98–104. Bibcode:1958PNAS...44...98K. DOI:10.1073/pnas.44.2.98. PMC:335371. PMID:16590179.
- ^ Vasella A، Davies GJ، Böhm M (أكتوبر 2002). "Glycosidase mechanisms". Current Opinion in Chemical Biology. ج. 6 ع. 5: 619–29. DOI:10.1016/S1367-5931(02)00380-0. PMID:12413546.
- ^ Boyer، Rodney (2002). "Chapter 6: Enzymes I, Reactions, Kinetics, and Inhibition". Concepts in Biochemistry (ط. 2nd). New York, Chichester, Weinheim, Brisbane, Singapore, Toronto.: John Wiley & Sons, Inc. ص. 137–8. ISBN:0-470-00379-0. OCLC:51720783. مؤرشف من الأصل في 2022-03-31.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Savir Y، Tlusty T (2007). Scalas E (المحرر). "Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition" (PDF). PLoS ONE. ج. 2 ع. 5: e468. Bibcode:2007PLoSO...2..468S. DOI:10.1371/journal.pone.0000468. PMC:1868595. PMID:17520027. مؤرشف من الأصل (PDF) في 19 مارس 2012. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) والوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Fersht A (1985). Enzyme Structure and Mechanism. San Francisco: W.H. Freeman. ص. 50–2. ISBN:0-7167-1615-1.
- ^ Warshel A، Sharma PK، Kato M، Xiang Y، Liu H، Olsson MH (أغسطس 2006). "Electrostatic basis for enzyme catalysis". Chemical Reviews. ج. 106 ع. 8: 3210–35. DOI:10.1021/cr0503106. PMID:16895325.
- ^ Cox، Michael M.؛ Nelson، David L. (2013). "Chapter 6.2: How enzymes work". Lehninger Principles of Biochemistry (ط. 6th). New York, N.Y.: W.H. Freeman. ص. 195. ISBN:978-1464109621.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Benkovic SJ، Hammes-Schiffer S (أغسطس 2003). "A perspective on enzyme catalysis". Science. ج. 301 ع. 5637: 1196–202. Bibcode:2003Sci...301.1196B. DOI:10.1126/science.1085515. PMID:12947189.
- ^ Jencks WP (1987). Catalysis in Chemistry and Enzymology. Mineola, N.Y: Dover. ISBN:0-486-65460-5.
- ^ Villa J، Strajbl M، Glennon TM، Sham YY، Chu ZT، Warshel A (أكتوبر 2000). "How important are entropic contributions to enzyme catalysis?". Proceedings of the National Academy of Sciences of the United States of America. ج. 97 ع. 22: 11899–904. Bibcode:2000PNAS...9711899V. DOI:10.1073/pnas.97.22.11899. PMC:17266. PMID:11050223.
- ^ Ramanathan A، Savol A، Burger V، Chennubhotla CS، Agarwal PK (2014). "Protein conformational populations and functionally relevant substates". Acc. Chem. Res. ج. 47 ع. 1: 149–56. DOI:10.1021/ar400084s. PMID:23988159.
- ^ Tsai CJ، Del Sol A، Nussinov R (2009). "Protein allostery, signal transmission and dynamics: a classification scheme of allosteric mechanisms". Mol Biosyst. ج. 5 ع. 3: 207–16. DOI:10.1039/b819720b. PMC:2898650. PMID:19225609.
- ^ Changeux JP، Edelstein SJ (يونيو 2005). "Allosteric mechanisms of signal transduction". Science. ج. 308 ع. 5727: 1424–8. Bibcode:2005Sci...308.1424C. DOI:10.1126/science.1108595. PMID:15933191.
- ^ de Bolster، M.W.G. (1997). "Glossary of Terms Used in Bioinorganic Chemistry: Cofactor". International Union of Pure and Applied Chemistry. مؤرشف من الأصل في 2017-05-05. اطلع عليه بتاريخ 2007-10-30.
{{استشهاد ويب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Chapman-Smith A، Cronan JE (1999). "The enzymatic biotinylation of proteins: a post-translational modification of exceptional specificity". Trends Biochem. Sci. ج. 24 ع. 9: 359–63. DOI:10.1016/s0968-0004(99)01438-3. PMID:10470036.
- ^ Fisher Z، Hernandez Prada JA، Tu C، Duda D، Yoshioka C، An H، Govindasamy L، Silverman DN، McKenna R (فبراير 2005). "Structural and kinetic characterization of active-site histidine as a proton shuttle in catalysis by human carbonic anhydrase II". Biochemistry. ج. 44 ع. 4: 1097–115. DOI:10.1021/bi0480279. PMID:15667203.
- ^ أ ب Wagner AL (1975). Vitamins and Coenzymes. Krieger Pub Co. ISBN:0-88275-258-8.
- ^ "BRENDA The Comprehensive Enzyme Information System". Technische Universit?t Braunschweig. مؤرشف من الأصل في 2019-04-04. اطلع عليه بتاريخ 2015-02-23.
- ^ McArdle WD، Katch F، Katch VL (2006). "Chapter 9: The Pulmonary System and Exercise". Essentials of Exercise Physiology (ط. 3rd). Baltimore, Maryland: Lippincott Williams & Wilkins. ص. 312–3. ISBN:978-0781749916.
- ^ Ferguson SJ، Nicholls D، Ferguson S (2002). Bioenergetics 3 (ط. 3rd). San Diego: Academic. ISBN:0-12-518121-3. مؤرشف من الأصل في 2021-01-27.
- ^ Michaelis L, Menten M (1913). "Die Kinetik der Invertinwirkung" [The Kinetics of Invertase Action]. Biochem. Z. (بالألمانية). 49: 333–369.; Michaelis L، Menten ML، Johnson KA، Goody RS (2011). "The original Michaelis constant: translation of the 1913 Michaelis-Menten paper". Biochemistry. ج. 50 ع. 39: 8264–9. DOI:10.1021/bi201284u. PMC:3381512. PMID:21888353.
- ^ Briggs GE، Haldane JB (1925). "A Note on the Kinetics of Enzyme Action". The Biochemical Journal. ج. 19 ع. 2: 339–339. DOI:10.1042/bj0190338. PMC:1259181. PMID:16743508.
- ^ Ellis RJ (أكتوبر 2001). "Macromolecular crowding: obvious but underappreciated". Trends in Biochemical Sciences. ج. 26 ع. 10: 597–604. DOI:10.1016/S0968-0004(01)01938-7. PMID:11590012.
- ^ Kopelman R (سبتمبر 1988). "Fractal reaction kinetics". Science. ج. 241 ع. 4873: 1620–26. Bibcode:1988Sci...241.1620K. DOI:10.1126/science.241.4873.1620. PMID:17820893.
- ^ أ ب ت ث Cornish-Bowden A (2004). Fundamentals of Enzyme Kinetics (ط. 3). London: Portland Press. ISBN:1-85578-158-1.
- ^ Price NC (1979). "What is meant by 'competitive inhibition'?". Trends in Biochemical Sciences. ج. 4 ع. 11: N272–N273. DOI:10.1016/0968-0004(79)90205-6.
- ^ Cornish-Bowden A (يوليو 1986). "Why is uncompetitive inhibition so rare? A possible explanation, with implications for the design of drugs and pesticides". FEBS Letters. ج. 203 ع. 1: 3–6. DOI:10.1016/0014-5793(86)81424-7. PMID:3720956.
- ^ Fisher JF، Meroueh SO، Mobashery S (فبراير 2005). "Bacterial resistance to beta-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. ج. 105 ع. 2: 395–424. DOI:10.1021/cr030102i. PMID:15700950.
- ^ أ ب Johnson DS، Weerapana E، Cravatt BF (يونيو 2010). "Strategies for discovering and derisking covalent, irreversible enzyme inhibitors". Future Medicinal Chemistry. ج. 2 ع. 6: 949–64. DOI:10.4155/fmc.10.21. PMC:2904065. PMID:20640225.
- ^ Endo A (1 نوفمبر 1992). "The discovery and development of HMG-CoA reductase inhibitors". J. Lipid Res. ج. 33 ع. 11: 1569–82. PMID:1464741. مؤرشف من الأصل (PDF) في 2010-02-14.
- ^ Wlodawer A، Vondrasek J (1998). "Inhibitors of فيروس العوز المناعي البشري-1 protease: a major success of structure-assisted drug design". Annual Review of Biophysics and Biomolecular Structure. ج. 27: 249–84. DOI:10.1146/annurev.biophys.27.1.249. PMID:9646869.
- ^ Yoshikawa S، Caughey WS (مايو 1990). "Infrared evidence of cyanide binding to iron and copper sites in bovine heart cytochrome c oxidase. Implications regarding oxygen reduction". The Journal of Biological Chemistry. ج. 265 ع. 14: 7945–58. PMID:2159465.
- ^ Hunter T (يناير 1995). "Protein kinases and phosphatases: the yin and yang of protein phosphorylation and signaling". Cell. ج. 80 ع. 2: 225–36. DOI:10.1016/0092-8674(95)90405-0. PMID:7834742.
- ^ Berg JS، Powell BC، Cheney RE (أبريل 2001). "A millennial myosin census". Molecular Biology of the Cell. ج. 12 ع. 4: 780–94. DOI:10.1091/mbc.12.4.780. PMC:32266. PMID:11294886.
- ^ Meighen EA (مارس 1991). "Molecular biology of bacterial bioluminescence". Microbiological Reviews. ج. 55 ع. 1: 123–42. PMC:372803. PMID:2030669.
- ^ De Clercq E (2002). "Highlights in the development of new antiviral agents". Mini Rev Med Chem. ج. 2 ع. 2: 163–75. DOI:10.2174/1389557024605474. PMID:12370077.
- ^ Mackie RI، White BA (أكتوبر 1990). "Recent advances in rumen microbial ecology and metabolism: potential impact on nutrient output". Journal of Dairy Science. ج. 73 ع. 10: 2971–95. DOI:10.3168/jds.S0022-0302(90)78986-2. PMID:2178174.
- ^ Rouzer CA، Marnett LJ (2009). "Cyclooxygenases: structural and functional insights". J. Lipid Res. 50 Suppl: S29–34. DOI:10.1194/jlr.R800042-JLR200. PMC:2674713. PMID:18952571.
- ^ أ ب ت Suzuki H (2015). "Chapter 8: Control of Enzyme Activity". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 141–69. ISBN:978-981-4463-92-8.
- ^ Doble BW، Woodgett JR (أبريل 2003). "GSK-3: tricks of the trade for a multi-tasking kinase". Journal of Cell Science. ج. 116 ع. Pt 7: 1175–86. DOI:10.1242/jcs.00384. PMC:3006448. PMID:12615961.
- ^ Skett P، Gibson GG (2001). "Chapter 3: Induction and Inhibition of Drug Metabolism". Introduction to Drug Metabolism (ط. 3). Cheltenham, UK: Nelson Thornes Publishers. ص. 87–118. ISBN:978-0748760114. مؤرشف من الأصل في 2022-03-30.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ Faergeman NJ، Knudsen J (أبريل 1997). "Role of long-chain fatty acyl-CoA esters in the regulation of metabolism and in cell signalling". The Biochemical Journal. ج. 323 ع. Pt 1: 1–12. PMC:1218279. PMID:9173866.
- ^ Suzuki H (2015). "Chapter 4: Effect of pH, Temperature, and High Pressure on Enzymatic Activity". How Enzymes Work: From Structure to Function. Boca Raton, FL: CRC Press. ص. 53–74. ISBN:978-981-4463-92-8.
- ^ Kamata K، Mitsuya M، Nishimura T، Eiki J، Nagata Y (مارس 2004). "Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase". Structure. ج. 12 ع. 3: 429–38. DOI:10.1016/j.str.2004.02.005. PMID:15016359.
- ^ Froguel P، Zouali H، Vionnet N، Velho G، Vaxillaire M، Sun F، Lesage S، Stoffel M، Takeda J، Passa P (مارس 1993). "Familial hyperglycemia due to mutations in glucokinase. Definition of a subtype of diabetes mellitus". The New England Journal of Medicine. ج. 328 ع. 10: 697–702. DOI:10.1056/NEJM199303113281005. PMID:8433729.
- ^ Okada S، O'Brien JS (أغسطس 1969). "Tay-Sachs disease: generalized absence of a beta-D-N-acetylhexosaminidase component". Science. ج. 165 ع. 3894: 698–700. Bibcode:1969Sci...165..698O. DOI:10.1126/science.165.3894.698. PMID:5793973.
- ^ "Learning About Tay-Sachs Disease". U.S. National Human Genome Research Institute. مؤرشف من الأصل في 2018-11-06. اطلع عليه بتاريخ 2015-03-01.
- ^ Erlandsen H، Stevens RC (أكتوبر 1999). "The structural basis of phenylketonuria". Molecular Genetics and Metabolism. ج. 68 ع. 2: 103–25. DOI:10.1006/mgme.1999.2922. PMID:10527663.
- ^ Flatmark T، Stevens RC (أغسطس 1999). "Structural Insight into the Aromatic Amino Acid Hydroxylases and Their Disease-Related Mutant Forms". Chemical Reviews. ج. 99 ع. 8: 2137–2160. DOI:10.1021/cr980450y. PMID:11849022.
- ^ "Phenylketonuria". Genes and Disease [Internet]. Bethesda (MD): National Center for Biotechnology Information (US). 1998–2015.
- ^ "Pseudocholinesterase deficiency". U.S. National Library of Medicine. مؤرشف من الأصل في 2018-07-28. اطلع عليه بتاريخ 2013-09-05.
- ^ Fieker A، Philpott J، Armand M (2011). "Enzyme replacement therapy for pancreatic insufficiency: present and future". Clinical and Experimental Gastroenterology. ج. 4: 55–73. DOI:10.2147/CEG.S17634. PMC:3132852. PMID:21753892.
- ^ Misselwitz B، Pohl D، Frühauf H، Fried M، Vavricka SR، Fox M (يونيو 2013). "Lactose malabsorption and intolerance: pathogenesis, diagnosis and treatment". United European Gastroenterology Journal. ج. 1 ع. 3: 151–9. DOI:10.1177/2050640613484463. PMC:4040760. PMID:24917953.
- ^ Cleaver JE (مايو 1968). "Defective repair replication of DNA in xeroderma pigmentosum". Nature. ج. 218 ع. 5142: 652–6. Bibcode:1968Natur.218..652C. DOI:10.1038/218652a0. PMID:5655953.
- ^ James، William D؛ Elston، Dirk؛ Berger، Timothy G (2011). Andrews' Diseases of the Skin: Clinical Dermatology (ط. 11th). London: Saunders/ Elsevier. ص. 567. ISBN:978-1437703146. مؤرشف من الأصل في 2020-07-24.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)صيانة الاستشهاد: التاريخ والسنة (link) - ^ Renugopalakrishnan V، Garduño-Juárez R، Narasimhan G، Verma CS، Wei X، Li P (نوفمبر 2005). "Rational design of thermally stable proteins: relevance to bionanotechnology". Journal of Nanoscience and Nanotechnology. ج. 5 ع. 11: 1759–1767. DOI:10.1166/jnn.2005.441. PMID:16433409.
- ^ Hult K، Berglund P (أغسطس 2003). "Engineered enzymes for improved organic synthesis". Current Opinion in Biotechnology. ج. 14 ع. 4: 395–400. DOI:10.1016/S0958-1669(03)00095-8. PMID:12943848.
- ^ Jiang L، Althoff EA، Clemente FR، Doyle L، Röthlisberger D، Zanghellini A، Gallaher JL، Betker JL، Tanaka F، Barbas CF، Hilvert D، Houk KN، Stoddard BL، Baker D (مارس 2008). "De novo computational design of retro-aldol enzymes". Science. ج. 319 ع. 5868: 1387–91. Bibcode:2008Sci...319.1387J. DOI:10.1126/science.1152692. PMC:3431203. PMID:18323453.
- ^ أ ب Sun Y، Cheng J (مايو 2002). "Hydrolysis of lignocellulosic materials for ethanol production: a review". Bioresource Technology. ج. 83 ع. 1: 1–11. DOI:10.1016/S0960-8524(01)00212-7. PMID:12058826.
- ^ أ ب Kirk O، Borchert TV، Fuglsang CC (أغسطس 2002). "Industrial enzyme applications". Current Opinion in Biotechnology. ج. 13 ع. 4: 345–351. DOI:10.1016/S0958-1669(02)00328-2. PMID:12323357.
- ^ أ ب ت Briggs، Dennis E. (1998). Malts and Malting (ط. 1st). London: Blackie Academic. ISBN:978-0412298004. مؤرشف من الأصل في 2022-03-31.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ Dulieu C، Moll M، Boudrant J، Poncelet D (2000). "Improved performances and control of beer fermentation using encapsulated alpha-acetolactate decarboxylase and modeling". Biotechnology Progress. ج. 16 ع. 6: 958–65. DOI:10.1021/bp000128k. PMID:11101321.
- ^ Tarté، Rodrigo (2008). Ingredients in Meat Products Properties, Functionality and Applications. New York: Springer. ص. 177. ISBN:978-0-387-71327-4. مؤرشف من الأصل في 30 مارس 2022.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=لا يطابق|تاريخ=(مساعدة) والوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة) - ^ "Eduard Buchner – Nobel Lecture: Cell-Free Fermentation". Nobelprize.org. 1907. مؤرشف من الأصل في 2017-07-08. اطلع عليه بتاريخ 2015-02-23.
- ^ Molimard P، Spinnler HE (فبراير 1996). "Review: Compounds Involved in the Flavor of Surface Mold-Ripened Cheeses: Origins and Properties". Journal of Dairy Science. ج. 79 ع. 2: 169–184. DOI:10.3168/jds.S0022-0302(96)76348-8. مؤرشف من الأصل في 2022-03-31.
- ^ Guzmán-Maldonado H، Paredes-López O (سبتمبر 1995). "Amylolytic enzymes and products derived from starch: a review". Critical Reviews in Food Science and Nutrition. ج. 35 ع. 5: 373–403. DOI:10.1080/10408399509527706. PMID:8573280.
- ^ أ ب "Protease – GMO Database". GMO Compass. European Union. 10 يوليو 2010. مؤرشف من الأصل في 2017-01-23. اطلع عليه بتاريخ 2015-02-28.
- ^ Alkorta I، Garbisu C، Llama MJ، Serra JL (يناير 1998). "Industrial applications of pectic enzymes: a review". Process Biochemistry. ج. 33 ع. 1: 21–28. DOI:10.1016/S0032-9592(97)00046-0. مؤرشف من الأصل في 2022-03-31.
- ^ Bajpai P (مارس 1999). "Application of enzymes in the pulp and paper industry". Biotechnology Progress. ج. 15 ع. 2: 147–157. DOI:10.1021/bp990013k. PMID:10194388.
- ^ Begley CG، Paragina S، Sporn A (مارس 1990). "An analysis of contact lens enzyme cleaners". Journal of the American Optometric Association. ج. 61 ع. 3: 190–4. PMID:2186082.
- ^ Farris، Paul L. (2009). "Economic Growth and Organization of the U.S. Starch Industry". في BeMiller، James N.؛ Whistler، Roy L. (المحررون). Starch Chemistry and Technology (ط. 3rd). London: Academic. ISBN:9780080926551.
{{استشهاد بكتاب}}: الوسيط غير المعروف|name-list-format=تم تجاهله يقترح استخدام|name-list-style=(مساعدة)
قراءة إضافيةتاريخ وتسمية الإنزيمات
بنية وآلية عمل الإنزيمات
الترموديناميك
|
الحركيات والتثبيط الإنزيمي
وظيفة وتحكم الإنزيمات في الخلية
اصطلاحات تسمية الإنزيمات
تطبيقات صناعية
|
وصلات خارجية
- بنية/وظيفة الإنزيمات، دليل تعليمي حول بنية الإنزيمات ووظيفتها. (بالإنجليزية)
- * Enzyme spotlight Monthly feature at the European Bioinformatics Institute on a selected enzyme.
- UK biotech and pharmaceutical industry The Biosystems Informatics Institute (Bii) is a new UK government initiative funded by the Department of Trade and Industry and the Regional Development Agency, One NorthEast. From its outset the Institute will undertake industry-facing research and development in collaboration with the UK biotech and pharmaceutical industry.
- AMFEP, Association of Manufacturers and Formulators of Enzyme Products
- BRENDA database, a comprehensive compilation of information and literature references about all known enzymes; requires payment by commercial users.
- Enzyme Structures Database links to the known 3-D structure data of enzymes in the بنك بيانات البروتين.
- ExPASy enzyme database, links to يونيبروت sequence data, entries in other databases and to related literature searches.
- KEGG: Kyoto Encyclopedia of Genes and Genomes Graphical and hypertext-based information on biochemical pathways and enzymes.
- MACiE قاعدة بيانات آليات تفاعل الإنزيمات.
- ميتاسيك قاعدة بيانات الإنزيمات والمسالك الاستقلابية
- 'Face-to-Face Interview with Sir John Cornforth who was awarded a Nobel Prize for work on stereochemistry of enzyme-catalyzed reactions Freeview video by the Vega Science Trust
| في كومنز صور وملفات عن: إنزيم |
![{\displaystyle {\ce {CO2{}+H2O->[{\text{Carbonic anhydrase}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b)
![{\displaystyle {\ce {CO2{}+H2O<-[{\text{Carbonic anhydrase}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/618e95485aa1c3c44a29c557ac448ae5b544ff07)