|
تضامنًا مع حق الشعب الفلسطيني |
حركية ميكايليس ومينتين
اذهب إلى التنقل
اذهب إلى البحث
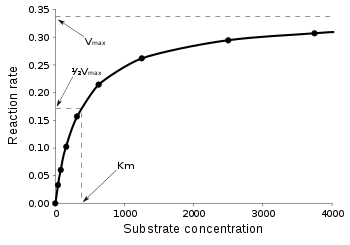
حركية ميكايليس ومينتين (بالإنجليزية: Michaelis–Menten kinetics) عندما تكون التراكيز صغيرة، فأن سرعة رد الفعل تكبر بشكل مئوي (تدريجي).[1][2][3] أما عندما تكون التراكيز كبيرة، فأن سرعة رد الفعل لن تزيد مئويا، وأنما تصل إلى أعلى سرعة (سرعة القمة).
مراجع
- ^ Leskovac، V. (2003). Comprehensive enzyme kinetics. New York: Kluwer Academic/Plenum Pub. ISBN:978-0-306-46712-7.
- ^ Chakraborty، S. (23 ديسمبر 2009). Microfluidics and Microfabrication (ط. 1). Springer. ISBN:978-1-4419-1542-9.
- ^ Michaelis، L.؛ Menten، M.L. (1913). "Die Kinetik der Invertinwirkung". Biochem Z. ج. 49: 333–369
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: postscript (link)
| في كومنز صور وملفات عن: حركية ميكايليس ومينتين |