|
تضامنًا مع حق الشعب الفلسطيني |
ألكين

| |
| الخواص | |
|---|---|
| الصيغة العامة | CnH2n |
الألكين في الكيمياء العضوية هو هيدروكربون غير متشبع يحتوى على الأقل رابطة واحدة ثنائية بين ذرتي كربون.[1][2][3] تكون الألكينات البسيطة التي تحتوى على رابطة واحدة مزدوجة سلسلة متجانسة، والألكينات لها الصيغة العامة CnH2n.
أبسط الألكينات هو الذي يعرف باسم «إثيلين» بينما الاسم الرسمية له طبقا للإتحاد الدولي للكيمياء والكيمياء التطبيقية (IUPAC) يسمي إثين. تسمى الألكينات أيضًا بالأوليفينات.
الاثيلين هو جزيء مستو بطول الكربون الكربون الرابطة المزدوجة (1.34 انغستروم) الذي هو أقصر بكثير من طول الرابطة واحدة المقابلة (1.53 انغستروم) في الإيثان.
تركيب الألكينات
كما هو متوقع طبقا لهندسة الجزيء فإنه يحدث تنافر بين زوج الإلكترونات (شاهد «الرابطة التساهمية»)، وبالتالى فإن الزاوية بين ذرتي الكربون في الرابطة المزدوجة ستكون 120°, وقد تصبح الزاوية أكبر طبقا للإجهاد الواقع من التفاعلات غير الارتباطية التي تحدث من المجموعات المرتبطة بذرة الكربون. فمثلا الزاوية بين C-C-C في البروبين (البروبيلين) تبلغ 123.9123.9°. (شاهد أيضا: هندسة جزيئية)
الهندسة الجزيئية للرابطة المزدوجة بين ذرتي كربون
مثل الرابطة التساهمية الأحادية، فإنه يمكن وصف الرابطة المزدوجة بكيفية التداخل الحادث بين المدارات الذرية، فيما عدا أنه بعكس الرابطة الأحادية (والتي تتكون من رابطة سيجما واحدة)، فإن الرابطة المزدوجة بين الكربون تتكون من رابطة سيجما ورابطة باي.
تستعمل كل ذرة كربون في الرابطة المزدوجة مداراتها sp2 المهجنة لتكون رابطة سيجما لثلاث ذرات أخرى. بينما المدارات الذرية 2p غير المهجنة، والتي تقع عموديا على مستوى المتكون من محاور مدارات sp2 المهجنة، لتكوين رابطة باي.
ونظرا لأنه يتطلب كمية كبيرة من الطاقة لكسر الرابطة باي (264 كيلو جول لكل مول في الإثيلين)، فإن الدوران حول الرابطة كربون-كربون المزدوجة صعب للغاية ومقيد بشدة.
شاهد أيضا: هندسة جزيئية
الخواص الفيزيائية والكيميائية
الألكينات بصفة عامة مركبات ثابتة ولكنها أنشط من الألكانات.
أولاً.. الخواص الفيزيائية:
أ- الذوبان: ذائبيتها في الماء مثل ذائبية الألكانات ولكنها تظهر تفوقاً بسيطاً جداً في الذائبية عن الألكانات ويعود السبب في ذلك إلى الرابطة باي التي تضفي قليلاً من القطبية على الجزيء، ولا تذوب الالكينات في الماء، ولكنها تذوب في المذيبات الغير قطبية، مثل: البنزين.
حاله المركبات: - المركبات التي تحتوى على 2 إلى 4 ذرات كربون فهى غازات
- المركبات التي تحتوى على 5 إلى 15 ذرة كربون فهى سوائل
- المركبات التي تحتوى على أكثر من 15 ذرة كربون فهى مركبات صلبه.
ب- الكثافة: الالكينات عموما كثافتها منخفضة، ولها كثافة اقل من كثافة الماء.
ج- درجة الغليان: تمتاز الألكينات بأنها ذات درجات انصهار وغليان منخفضة، وتزداد درجة غليان الالكينات مع زيادة عدد ذرات الكربون (الكتلة الجزيئية) والتشعب يقلل درجة الغليان.
ثانياً.. الخواص الكيميائية:
أ- تفاعل الاحتراق «وهو من أهم تفاعلات الهيدروكربونات.. وينتج عنها طاقة تستخدم في تشغيل الآلات».
ب- تفاعل الهدرجة.
ج- الهلجنة.
د- التفاعل مع هاليد الهيدروجين.
هـ-الهيدرة.
و-الأكسدة.
ز-البلمرة.
التفاعلات
تصنيع الألكينات
- أكثر الطرق الصناعية شيوعا لتصنيع الألكينات هي تكسير البترول.
- يمكن تصنيع الألكينات من الكحولات خلاف تفاعلات النزع والتي يتم فيها نزع جزيء ماء من الجزيء:
H3C-CH2-OH + H2SO4 → H3C-CH2-O-SO3H + H2O → H2C=CH2 + H2SO4. - التصنيع الحفزي للألكينات الكبيرة من النوع α-ألكين والتي يمكن الحصول عليها من تفاعل الإثيلين مع ثلاثي إثيل الألومنيوم، مركب عضوي فلزي في تواجد النيكل، أو الكوبالت، أو البلاتين.
تفاعلات الإضافة
إضافة حفزية للهيدروجين
الهدرجة الحفزية للألكينات تنتج الألكان المقابل. يتم التفاعل تحت الضغط في وجود عامل حفز فلزي. ومن الحفازات الصناعية الشائعة الاستخدام البلاتين، النيكل، البلاديوم، وذلك للاستخدام في المعامل. وغالبا ما يستخدم نيكل راني، وهو سبيكة من النيكل والألومنيوم.
المعادلة القادمة توضح هدرجة الإثيلين للحصول على الإيثان:
CH2=CH2 + H2 → CH3-CH3.
إضافة شغوفة بالإلكترونات
معظم تفاعلات الإضافة للألكينات تتبع آلية تشابه الإضافة الشغوفة بالإلكترونات.
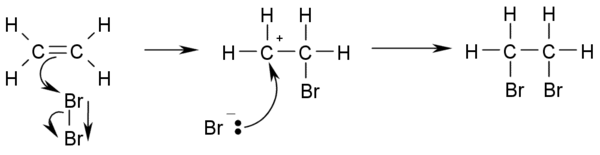
- الهلجنة: إضافة البروم، أو الكلور في حالتهم العنصرية إلى الألكينات وينتج ثنائي برومو فيسينال، وثنائي كلورو ألكين، بالترتيب. وعملية نزع الكلور من محلول البروم في الماء هي طريقة تحليلية لاختيار وجود الألكين:
CH2=CH2 + Br2 → BrCH2-CH2Br
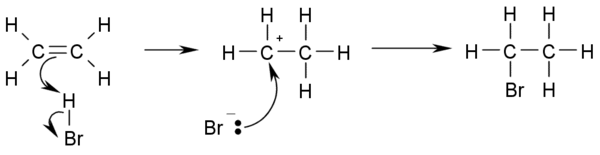
- ويسير التفاعل بسبب الكثافة الإلكترونية العالية الموجودة على الرابطة الثنائية والتي تسبب إرزاحة مؤقتة للإلكترونات في الرابطة B-B مما يسبب حث مؤقت ثنائى القطب. وهذا يجعل Br يقترب من الرابطة الثنائية الموجبة وعند ذلك يحدث هيدروهلجنة محبة للإلكترونات: إضافة حمض هيدروهاليد مثل HCl أو HBr للألكين وينتج الهالو ألكان المقابل..
CH3-CH=CH2 + HBr → CH3-CHBr- ولو أن ذرتي الكربون عند الرابطة الثنائية مرتبطتان لعدد مختلف من ذرات الهيدروجين، فإن الهالوجين يتجه لذرة الكربون التي بها عدد ذرات هيدروجين أقل (قاعدة ماركونيكوف).
- وألية التفاعل:
- إضافة الكربين أو الكاربينويد ينتج البروبان الحلقي المقابل.
الأكسدة
- في وجود الأكسجين، تحترق الألكينات بلهب لامع لتنتج ثنائي أكسيد الكربون هذا التفاعل يمكن استخدامه لتحديد مكان الرابطة المزدوجة في الألكين.
البلمرة
بلمرة الألكينات تفاعل له أهمية اقتصادية، ونتيجة التفاعل هي البوليمرات ذات القيمة الصناعية الكبيرة، ومن نواتج عملية البلمرة اللدائن مثل البولي إثيلين، البولي بروبيلين. ويمكن أن تتم عمليات البلمرة بعدة طرق منها طريقة الجذر الحر، أو الطريقة الأيونية. (لمزيد من التفاصيل شاهد البلمرة).
تفاعل أوكسو
تتفاعل الألكينات مع مزيج من أحادي أكسيد الكربون والهيدروجين بوجود حفّاز للحصول على الألدهيدات.
تسمية الألكينات
تسمى بنفس قواعد الألكانات وذلك بتحوير اسم الكان وبإبدال الألف الثانية بحرف (ي) لتصبح ألكين للدلالة على الألكينات. وبإضافة (ي) قبل للنون الأخيرة لتصبح ألكاين للدلالة على الألكاينات.
هناك ثلاث خطوات مهمة في التسمية.
1- سم أطول مجموعة متسلسلة كربونية تحتوي على رابطة ثنائية ثم استخدم النهاية. (ين).
2- رقم ذرات الكربون في السلسلة من النهاية الأقرب للرابطة الثنائية وإذا كانت النهايتان بنفس المسافة من الرابطة الثنائية ابدأ بالترقيم من النهاية التي يكون بقربها أول تفرع.
3- اكتب الاسم كاملا ً ورقم البدائل حسب موقعها ثم رتبها بحسب التهجئة الإنجليزية، وعين موقع الرابطة الثنائية بإعطائها رقمًا يمثل أول ذرة كربون من الألكين. وإذا كان هناك أكثر من رابطة ثنائية رقم موقعها واستخدم الدلالات التالية الدالة على عددها [ دايين، ترايين.تيتراين ] رابطتين، ثلاث روابط.
4- نستخدم القواعد السابقة نفسها في حالة الألكاينات ولكن باستخدام النهاية (آين).
تسمية IUPAC
لمعرفة الاسم الأصلي للألكينات، يتم تغير المقطع «ان» في الألكانات إلى المقطع «ين». فمثلا CH3-CH3 هو الإيثان، وعلى هذا فإن اسم CH2=CH2 سيكون إثين.
وبالنسبة للألكينات الأعلى حيث يوجد عديد من المتزامرات (isomers) وتتواجد في أماكن مختلفة من الرابطة المزدوجة فيتم إتباع النظام الآتي:
- ترقيم أطول سلسلة كربونية بالطريقة التي تجعل الرابطة المزدوجة تأخذ أقل الأرقام.
- تحديد موضع الرابطة المزدوجة بموضع ذرة الكربون الأولة فيها.
- يتم تسمية التفرعات أو المستبدلات بطريقة مماثلة للألكانات.
- يتم كتابة أرقام التفرعات، وتسمية المجوعات المستبدلة«مع مراعاة الترتيب الأبجدي للمستبدلات», تحديد رقم الرابطة المزدوجة، ثم تسمية السلسلة الرئيسية.
|
CH3CH2CH2CH2CH==CH2 1-هيكسين
|
CH3 |
CH3 |
أسماء شائعة
بالرغم من أن تسمية IUPAC هي الأكثر دقة في تسمية الألكينات، إلا أنه توجد بعض الأسماء الشائعة الاستخدام مثل:
| CH2="CH2" | CH3CH="CH2" | CH3C(CH3)="CH2" | |
| اسم IUPAC: | إثين | بروبين | 2-ميثل بروبين |
| الاسم الشائع: | إثيلين | بروبيلين | أيزو بيوتيلين |
مراجع
- ^ Cram, D.J.؛ Greene، Frederick D.؛ Depuy، C. H. (1956). "Studies in Stereochemistry. XXV. Eclipsing Effects in the E2 Reaction1". Journal of the American Chemical Society. ج. 78 ع. 4: 790–796. DOI:10.1021/ja01585a024.
- ^ Bach, R.D.؛ Andrzejewski، Denis؛ Dusold، Laurence R. (1973). "Mechanism of the Cope elimination". J. Org. Chem. ج. 38 ع. 9: 1742–3. DOI:10.1021/jo00949a029.
- ^ Grutters, M. M. P.؛ Muller, C.؛ Vogt, D. (2006). "Highly Selective Cobalt-Catalyzed Hydrovinylation of Styrene". J. Am. Chem. Soc. ج. 128 ع. 23: 7414–5. DOI:10.1021/ja058095y. PMID:16756275.
انظر أيضًا
| في كومنز صور وملفات عن: ألكين |