|
تضامنًا مع حق الشعب الفلسطيني |
كهرل
كهرل |

الكَهْرَل[1] أو الإلكتروليت (بالإنجليزية: Electrolyte) هو أي مادة تحتوي على أيونات حرة تشكل وسطا ناقلا للكهرباء.[2][3] مثال للكهرل محلول مائي من حامض الكبريتيك. يتألف من أيونات الهيدروجين الموجبة +H وأيونات الكبريتات 2-SO4 ذات الشحنة السالبة في المحلول. والكهرل هو عضو من ثلاثة أعضاء لازمة للتوصيل الكهربائي في دائرة وهي في حالة الخلية الجلفانية مثلا : لوح نحاس + لوح زنك + كهرل. تُعرف الكهارل بالمحاليل الأيونية. ويوجد منها الكهارل المنصهرة والكهارل الصلبة كما في البطارية الجافة.
يستعمل الكهرل في البطاريات، كما يستعمل في الطلاء الجلفاني بالمعادن مثل الطلاء بالذهب والطلاء بالزنك وغيرها.
مقدمة
توجد المواد الكهرلية عادة في محاليل حمضية أو قلوية أو ملحية. كما تتصرف بعض الغازات كمواد كهرلية تحت درجات الحرارة العالية أو الضغوط المنخفضة. يمكن أيضا أن تنتج المحاليل الكهرلية من انحلال بعض المبلمرات العضوية، مثل DNA والهضميد (عديد الببتيد)) والمبلمرات التركيبية (مثل سولفات عديد الستيرين)، وتسمى عندئذ عديدة الكهرل، والتي تحتوي على شحنات كهربائية متعددة.
تتشكل المحاليل الكهرلية عادة عند وضع ملح في مذيب مثل الماء. حيث تذوب المكونات بسبب التفاعل الدينامي الحراري بين المذيب والجزيئات المذابة بعملية تسمى الذوبان. عندما يوضع ملح الطعام NaCl في الماء تتفكك الروابط بين أيونات الصوديوم والكلور كالآتي:
- -NaCl(s) → Na+ + Cl
الكهرل هو ببساطة مادة تذوب في الماء لتعطي محلولا ناقل للتيار الكهربائي.
يمكن أن يوصف الكهرل في المحلول بأنه مركز إذا كان ذو تركيز عالي للأيونات، ويكون مخففا ًً إذا كان ذو تركيز منخفض للأيونات. إذا انحلت نسبة كبيرة من المادة الذائبة في الماء نحصل على تركيز عالي، وإذا لم تنحل بالكامل نحصل على تركيز ضعيف. وهذه خاصية من خواص المركبات الكيميائية تعتمد على خواص المذيب وخواص المادة المذابة. يمكن استغلال ظاهرة وخواص الكهارل في استخراج العناصر، مثل استخراج الألمونيوم واستخراج المركبات المنحلة في المحلول.
الأهمية في علم الوظائف (الفيزيولوجيا)
إن الأيونات الأساسية في علم وظائف الأعضاء (الفيزيولوجيا) هي الصوديوم +Na، والبوتاسيوم +K، والكالسيوم 2+Ca، والمغنيزيوم 2+Mg، والكلور -Cl، والفوسفات 3-PO4، والبيكربونات -HCO3.
إن رمز الشحنة الكهربائية (-) أو (+) يشير إلى أن المادة تحتوي على أيونات. والأيونات عبارة عن ذرات ذات توزيع إلكتروني غير متوازن، ناتج إما عن أكتساب الذرة لإلكترون زائد فتصبح سالبة الشحنة، أو تفقد الذرة إلكترونا أو أكثر وتصبح موجبة الشحنة. ويحدث ذلك أحيانا خلال التحلل الكيميائي. ففي مثالنا أعلاه فقدت ذرة الصوديوم إلكترونا فأصبحت أيونا موجبا الشحنة، واكتسبت ذرة الكلور الإلكترون المفقود من ذرة الصوديوم وأصبحت أيونا ذو شحنة سالبة.
كل الأحياء المتطورة تحتاج إلى توازن كهرليتي معقد ودقيق بين الوسطين داخل وخارج الخلية (أي توازن بين عدد الشحنات السالبة وعدد الشحنات الموجبة). ويلعب الضغط الأزموزي دورا مهما، وخصوصاً حفظ التدرج التناضحي (التنافذي) (Osmotic gradients) الدقيق للكهارل. هذا التدرج يؤثر وينظم توزيع الماء في الجسم (تميه)، ودرجة حموضة الدم، وهو أساسي لعمل الأعصاب والعضلات. ويوجد آليات مختلفة في الكائنات الحية تضبط بدقة تركيز الكهارل المختلفة.
يعتبر كلا النسيجين العضلي والعصبي نسيجا كهربائيا في الجسم. حيث تفعّل العضلات والأعصاب بالفعالية الكهرلية بين السائل خارج الخلية أو الخِلالي كما يسمى، وبين السائل داخل الخلية. يمكن للكهارل أن تدخل وتخرج من غشاء الخلية عن طريق بناءات بروتينية موجودة في الغشاء الخلوي المسمى بالقنوات الأيونية. فتقلص العضلات مثلاً، يعتمد على وجود الكالسيوم والصوديوم والبوتاسيوم. فإذا لم تتوفر هذه الكهارل بمستوى كاف، تعاني العضلات من الضعف أو من تقلصات عضلية أليمة.
يحفظ التوازن الكهرليتي بتناول مواد حاوية على الكهارل إما عن طريق الفم أو عن طريق حقنة وريدية. وتضبط عن طريق هرمونات الجسم، وتصرّف الكلية الكهارل الزائدة. يُنظم استقرار الكهارل في الجسم البشري بفضل الهرمونات، مثل هرمون إدرار البول المنتج في الغدة الكظرية، وهرمون الغدة الدرقية. إن الاضطراب في الكهارل (كالتجفاف أو فرط السوائل في البدن) قد يؤدي إلى مضاعفات قلبية وعصبية، وقد يؤدي إلى الذهاب بشكل إسعافي إلى المشفى.
الكيمياء الكهربائية
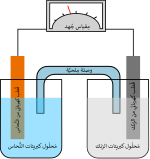
تحليل الماء عند وجود كهرل ما ونطبق عليه جهدا كهربائيا تنتقل الكهرباء في الكهرل. يحدث تفاعل كيميائي عند المهبط مستهلكاً بعض الإلكترونات من المصعد. ويحدث تفاعل آخر عند المصعد منتجا إلكترونات يكتسبها المهبط. وتكون النتيجة أن تتجمع شحنة كهربائية سالبة في الكهرل حول المهبط، وشحنة كهربائية موجبة حول المصعد. وتتحرك الأيونات في الكهرل لتعدل الشحنات الكهربائية السابقة بحيث يستمر التفاعل ويمر تيار من الإلكترونات.
مثال: في محلول من الملح العادي (كلوريد الصوديوم NaCl) في الماء، سيكون تفاعل المهبط كالآتي:
- 2H2O + 2e− → 2OH− + H2
وستتشكل فقاعات غاز الهيدروجين التي تتصاعد وتغادر المحلول، كما يجري التفاعل الآتي عند المصعد :
- -2H2O → O2 + 4H+ + 4e
ويتشكل غاز الأوكسجين ويتصاعد في هيئة فقاعات.
تُعادل شحنات الصوديوم (+Na) تلك الشحنة السالبة (-OH) عند المهبط، كما تتعادل شحنة الكلور السالبة (-Cl) تتعادل مع الشحنة الموجبة (+H) عند المصعد. وبدون الأيونات الموجودة في الكهرل، فإن الشحنات المحيطة بالمساري سوف تبطئ الجريان المستمر للشحنات الأخرى، ذلك لأن سريان أيونات الماء : (+H) و(-OH) خلال الماء من مسرى لآخر يأخذ وقتا أطولا بالمقارنة بسرعة حركة أيونات الملح (+Na) و(-Cl) الغالبة عددياً.
انظر أيضا
مراجع
- ^ Q112315598، ص. 388، QID:Q112315598
- ^ "Oral Rehydration Salt Suppliers". Rehydrate.org. 7 أكتوبر 2014. مؤرشف من الأصل في 2017-12-27. اطلع عليه بتاريخ 2014-12-04.
- ^ Cillispie، Charles، المحرر (1970). Dictionary of Scientific Biography (ط. 1). New York City: Charles Scribner's Sons. ص. 296–302. ISBN:0-684101-122.
| في كومنز صور وملفات عن: كهرل |