|
تضامنًا مع حق الشعب الفلسطيني |
عنقود تمايز
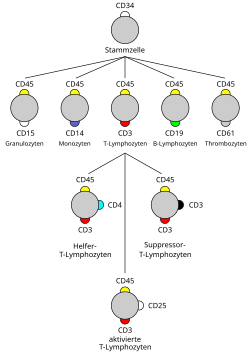
عنقود تمايز أو كتلة تمايز (بالإنجليزية: cluster of differentiation) هي طريقة اختبارية تجرى على خطوات بغرض التفرقة بين جزيئات كثيرة تظهر على أسطح الخلايا في الجسم؛ وتستهدف تلك الاختبارات معرفة ودراسة خلايا الجهاز المناعي.[1] تختصر تلك الكتلة في الإنجليزية بـ CD. يمكن أن تعمل جزيئات التمايز CD molecules بطرق عديدة، وغالبا تقوم بوظيفة مستقبل في خلايا جهاز المناعة أو تكون في شكل ربيطة (وهو جزيء ينشط مستقبل خلية مناعية) ولها أهميتها بالنسبة للخلية.
عادة تنشأ إشارات متبادلة بين الخلايا تغير من سلوكها. الكثير من عناقيد التمايز يشترك في الإشارات التي تتم بين الخلايا كما يكون لها دور كإنزيمات؛ وبعض عناقيد التمايز من البروتين وليس لها دور في تبادل الإشارات بين خلايا الجسم ولكن يكون لها تأثيرات آخرى مثل التصاق الخلايا. وقد اكتشف حتى الآن 364 من البروتينات المختلفة في الإنسان (حتى عام 2014)والتي توصف بأنها عناقيد تمايز CD ؛ وهي تكون على أسطح الخلايا. (اعتبارًا من نوفمبر 2014[تحديث]).[2][3]
وقد تعرفنا على مثالي كتلة التمايز 4 وكتلة التمايز 8 في وصفنا لـ خلية تي قاتلة، وأنهما عظيمي الشأن في التعرف على مستضد يهدد سلامة جسم الإنسان. ويقومان بتحفيز خلية تي القاتلة للقضاء على المستضد الدخيل.
تاريخها
بعد نجاح «جورج كوهلر» و «سيزار ميلشتاين» في نهاية عام 1970 في تحضير ضد وحيد النسيلة تبعتها اكتشافات كثيرة على هذا المضمار خلال سنوات قليلة لإنتاج خلايا منسخة، تختلف كثير من خصائصها عن بعضها البعض وأحيانا يتواجد تشابه في صفاتها. ولم يكن تركيبها الجزئي أو مصدرها الجيني معروفين في ذلك الوقت، وإنما كان تأثيرها فقط هو المعروف. وبغرض التوصل إلى تنظيم يفصل بين هذا العدد الهائل من الجزيئات المختلفة نجح العلماء في عام 1981 بتوليد جسيمات مضادات (أنتيبودي) لها نفس الصفات، وقاموا بتصنيف المضادات في فئات.
وطبقا لنتائج المؤتمر الطبي في عام 2004 الذي ناقش «التفرقة بين الأنتيجينات في خلايا الدم الحمراء للإنسان» HLDA فقد حُصدت نحو 300 من أنواع العناقيد (CD1 – CD339 ؛ مع بعض الفجوات), كما صنف بعضها في تصنيفات تحتية أدق (مثل CD3γ, CD3δ, CD3ε أو CD8a, CD8b). ولا يعني تقسيمهم في عناقيد بالضرورة أن الجسيمات المضادة يمكنها التعرف على نفس معين مستضد (إبيتوب) لبروتين.
توجد صفات مشتركة لمختلف الجسيمات المضادة (antibodies). ويتضح هذا مثلا في حالة تيروسين فوسفاتاز CD45. فهو يظهر على جميع خلايا نظام المناعة ماعدا خلايا الدم الحمراء. والجسيمات المضادة التي يمكنها التعرف على جميع تلك الأنواع فهي تصنف وتضم في عنقود CD45 ، بينما مضادات أخرى يكون قدرتها على التعرف محدودا، وتصنف في عناقيد تحتية مثل CD45R, أو CD45RO, أو CD45RA, أو CD45RB أو CD45RC . في الفئران يستخدم CD45R غالبا كمعلّم لخلايا الدم البيضاء ويرمز له أيضا في تلك الحالة بالرمز „B220“ (هذه التسمية تأتي من الكتلة المولية للجزيء البالغة 220 كيلو دالتون)، وهو جزيء من نوع تيروسين فوسفاتاز.
كانت التسمية CD تقتصر على بروتينات من الإنسان ولكن اتضح بعد ذلك ان كثيرا من الحيوانات، ومن ضمنها الفئران مثلا، تظهر عناقيد بروتينية مماثلة. وبغرض عدم الخلط بين عناقيد التمايز للإنسان والحيوان تضاف حروف للتعريف مثل hCD4: humanes CD4 للإنسان، أو mCD25: Maus CD25 للفأر.
أهميتها في التشخيص
الجزيئات المختلفة من عناقيد التمايز CD تكون لها خصوصية لنوع معين الخلايا أو طور معين من مراحل تطور الخلايا، ولهذا يمكن استخدامها كمعلمات تمكّن لمضادات وحدة النسيلة التعرف عليها وبالتالي تمكّننا من الكشف عنها.
ويلعب تحليل طريقة ظهور جزيء تمايز CD على «خلايا اللويكيمي» دورا هاما عند تشخيص وتصنيف مرض سرطان الدم. وتزايدت أهمية تلك الطريقة عند وضع خطة معالجة مرض ابيضاض الدم الليمفاوي الحاد.
أهميتها في العلاج
نظرا للصفات التخصصية لجزيئات عناقيد التمايز يحاول الباحثون استغلالها للتوصل إلى مركبات علاجية، يمكن استخدامها في حالات مرضية مختلفة. أحد تلك العقارات المستخدمة كضد وحيد النسيلة نجد العقار ريتوكسيماب ويستخدم كعلاج ضد مستضد أنتيجين. هذا الضد يربط نفسه بصفة خاصة بعنقود التمايز CD20 ويمكنه بذلك تنشيط استجابة مناعية ضد خلايا ذات CD20-positive cells , مثلما في حالة لمفومة لا هودجكين.
تقنية دراسة بروتينات أسطح الخلايا
يستخدم نظام عناقيد التمايز كمعلم لتعليم بروتينات تبديها الخلايا على أسطحها؛ مما يسمح بمعرفة أنواع الخلايا عن طريق ما يظهر على سطحها من جزيئات بروتينية. وتستخدم تلك المعلمات غالبا لدراسة علاقة الخلايا ببعض الوظائف في نظام المناعة. وعادة يستخدم جزيء عنقود تمايز CD في تعريف مجموعة منها (رغم أن تلك الحالة توجد في عدد قليل من الحالات)، كما سمح استخدام توليفات من المعلمات في التعرف على أنواع خلايا لها دور أساسي معين في نظام المناعة.
وتستخدم جزيئات CD في انتقاء وتصنيف الخلايا بطرق مختلفة ومن ضمنها طريقة قياس التدفق الخلوي.
القائمة التالية تبين عناقيد التمايز الموجودة على أسطح الخلايا المختلفة:
| نوع الخلية | معلم CD |
| خلية جذعية | CD34+, CD31-, كتلة التمايز 117 |
| جميع خلايا الدم الحمراء | مستضد شائع لكريات الدم البيضاء+ |
| خلية محببة | CD45+, CD11b، CD15+, CD24+, CD114+, CD182 +[4] |
| خلية وحيدة | CD45+, CD14+, CD114+, CD11a, CD11b, CD91 +,[4] كتلة التمايز 16+[5] |
| خلية تائية | + CD45+, CD3 |
| خلية تي مساعدة | + CD45+, CD3+, كتلة التمايز 4 |
| خلية تي منظمة | كتلة التمايز 4، CD25, and Foxp3 |
| خلية تي قاتلة | + CD45+, CD3+, كتلة التمايز 8 |
| خلية بائية | CD45+, CD19+ or CD45+, CD20+, CD24+, CD38، CD22 |
| الصفائح الدموية | + CD45+, كتلة التمايز 61 |
| خلية فاتكة طبيعية | كتلة التمايز 16+, جزيئات التصاق الخلايا العصبية+, CD3-, CD31، CD30, CD38 |
من جزيئات التمايز الشائعة الذكر كتلة التمايز 4 وCD8, والتي تستخدم كمعلمات لخلايا تي المساعدة والخلايا تي القاتلة على التوالي. تلك الجزيئات تعرف غالبا مع + CD3, كما تبدي بعض خلايا الدم الحمراء تلك الجزيئات (بعض الماكوفاغ تظهر معدلات قليلة من CD4 ؛ بينما تبدي الخلايا المتغصنة البروتين CD8).
ويربط فيروس العوز المناعي البشري HIV جزيء CD4 ومستقبل شيموكين على سطح خلية تي مساعدة لكي يتمكن من دخول الخلية. وتستخدم نسبة وجود خلايا تي ذات جزيء CD4 وذات جزيء CD8 في الدم غالبا لمعرفة تطور عدوى فيروس العوز المناعي البشري في المريض.
أهميتها الوظيفية
لا زلنا لا نعرف سوى القليل عن جزيئات CD وصفاتها، ولكنها لها وظائف هامة في الجسم. وقد رأينا في مثال كتلة التمايز 4 وكتلة التمايز 8 في وصفنا لـ خلية تي قاتلة أنهما عظيمي الشأن في التعرف على مستضد يهدد سلامة جسم الإنسان. وعنقود تمايز آخر وهو CD135 فقد اتضح انه يعمل كمستقبل على أسطح الخلايا أثناء النمو.
المراجع
- ^ CHAN, J. K. C., NG, C. S., HUI, P. K. (1988). "A simple guide to the terminology and application of leucocyte monoclonal antibodies". Histopathology. ج. 12 ع. 5: 461–480. DOI:10.1111/j.1365-2559.1988.tb01967.x. PMID:3294157.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "HCDM, responsible for HLDA workshop and CD molecules". Human Cell Differentiation Molecules Council (successor to the HLDA Workshops). مؤرشف من الأصل في 2016-10-27. اطلع عليه بتاريخ 2009-06-01.
- ^ Zola H, Swart B, Banham A, Barry S, Beare A, Bensussan A, Boumsell L, D Buckley C, Bühring HJ, Clark G, Engel P, Fox D, Jin BQ, Macardle PJ, Malavasi F, Mason D, Stockinger H, Yang X. (2007). "CD molecules 2006--human cell differentiation molecules". J Immunol Methods. ج. 318 ع. 1–2: 1–5. DOI:10.1016/j.jim.2006.11.001. PMID:17174972.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب "CD Antigens" (PDF). abcam. 2009. مؤرشف من الأصل (PDF) في 2018-07-12. اطلع عليه بتاريخ 2014-11-22.
- ^ Passlick B, Flieger D, Ziegler-Heitbrock HW (1989). "Identification and characterization of a novel monocyte subpopulation in human peripheral blood". Blood (journal). ج. 74 ع. 7: 2527–2534. PMID:2478233. مؤرشف من الأصل في 2013-06-19.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
اقرأ أيضا
كتب
- Mason D, ed., Leucocyte Typing VII: white cell differentiation antigens. Proceedings of the seventh international workshop and conference held in Harrogate, United Kingdom. Oxford University Press, 2002. ISBN 0-19-263252-3.
وصلات خارجية
- Molecule search maintained by the Human Cell Differentiation Molecules Council (successor to the HLDA Workshops)
- Table of CD Antigens
- CD list Protein Reviews On The Web
- Yet another list of CD molecules, at PathologyOutlines.com
- Wall charts of CD molecules and other cytokines, with colors, arrows from one cell to another, from eBioscience.
- Skin Research Center lab Hopital St Louis, Paris (France) Dir. Dr. A. Bensussan
| في كومنز صور وملفات عن: عنقود تمايز |