|
تضامنًا مع حق الشعب الفلسطيني |
نظير إنزيمي
نَظائر الإِنزيمات أو مُتشابهات الإِنزيم (بالإنجليزية: Isoenzyme)[1] أو اختصاراً (بالإنجليزية: Isozyme)[2] ويُسمى أيضًا إنْزيم إسْوِيّ[3] أو إِيزوزيم[4] أو إنزيم مِثْلِيّ[5]، وهي أَي مَجموعة مِن الإِنزيمات تتشابه في خَصائصها التَحفيزية بَحيث تُحفز نَفس التَفاعل، وَتُنتج نَفس المُنتج، وَلكنها تَتباين في خَصائصها السيرولوجية وَفي تَسلسل الأَحماض الأمينية وفي الخَواص الفيزيائية مِثل نُقْطَة تَساوِي الكَهْرَبِائيَّة، وعادة ما تَكون قَليلة الوِحدات البِنائية، وَيمكن تمييزها عن طَريق بعض التِقنيات مِثل الهجرة الكهربائية أو البَأر المُتساوي التكَهرُب.[6]
تَتواجد نظائِر الإنزيمات بأنسجة الجِسم وَأعضائه المُختلفة، ويكون تواجدها بِنسب مُميزة تَختلف من عضو لآخر ومن نسيج لآخر، كَما يختلف اتجاه التَفاعل من نسيج للآخر. وَيُعتبر نَمط تواجد نظائر الإنزيمات الموجودة في بلازما الدَم أَحد أهم الوسائل المُستخدمة في تحديد مَكان النسيج أو العُضو التالف، ومَثال ذلك بأنه يتم تَشخيص مَرض احتشاء عضلة القَلب عن طَريق تحديد مستوى كيناز الكرياتين في بلازما الدَم. تُعتبر نظائر الإنزيمات مُهمة جداً في حالة عَجز تخطيط كهربائية القلب عن تفسير بعض الأمراض والحالات.[7]
التاريخ
وُصفت نظائِر الإنزيمات لأول مرة من قِبل البريطاني أ.كنج وَالمِصري محمد أبو الفضل عام 1948[8] حيث أَجروا دِراسات مُستَفيضة على نَظائِر الإِنزيمات نُشرت فيما بَعد بِشكل مُشترك بينهما، حيث اكتَشفوا فيها عِدة طُرق للتَفرقة بَين نَظيري إِنزيم الفوسفاتاز الحِمضي، وَالذي وُجِدَ أَحَدُهما في كريات الدم الحمراء بَينما يَتركز الآخر فِي خلايا غدة البروستاتا، فَوجدا أَن مُعاملة نظير الإنزيم الأَخير بِأملاح الطَرْطَرات[9] (Tartrate salt) يُؤدي إِلى فُقدان نَشاطه بينما لا يتأثر النظير المَوجود بِالكُريات الحَمراء بِهذه المُعاملة.[10]
في عام 1957 عَرفَ ر. ل. هنتر وَكليمنت ماركيرت نظائر الإنزيمات على أنها "أَشكال مُختلفة من نَفس الإنزيم تتشابه في وظائِفها وتتواجد في بعض الأفراد"، حيث يتضمن هذا التَعريف ما يَلي:
- أن أشكال الإنزيمات التي تنتج من مواضع جينية مختلفة تُوصف بِأنها نظائر الإنزيمات (Isoenzyme).
- أن الإنزيمات الناتجة مِن الأَليلات المُختلفة لنفس الجَين تُوصف بأنها إنزيمات مُتغايرة جينياً (Alloenzyme).
المنشأ
تنشأ نظائر الإنزيمات عادةً نتيجة لِتضاعف الجَينات، كما يُمكن أن تنشأ نتيجةً لِـتعدد الصيغ الصبغية أو تهجين الحمض النووي. وعلى مرِّ الزَمن، إذا بقيت وظائف الشَكل الجَديد مطابِقة للأصل، فمن المُرجح أن يَخسر واحد أَو أَكثر على شَكل طفرة متراكمة، مما يؤدي إلى تكوين جين كاذب، وبالرَغم من ذلك فإنِ الطَفرات لا تَمنع الإنزيم عَن العَمل بشكل فَوري وَلكن تَعمل على تعديل وَظيفته أو تغيير نَمطه في التعبير الجيني، مِثل قَد يتم التَعبير عن الجَين في مَراحل مُختلفة من عَملية التَطور أو في أنسجة مُختلفة.
الشكل
تتواجد نَظائر الإنزيمات عادةً بالشكل الرُباعي[7]، حيث تَحتوي على وحدات بنائية مُتماثلة ولكنها غير مُتطابقة في ترتيب وَتسلسل الأَحماض الأمينية المُكونة لَها[11]، مما يؤدي إلى تَنوع الأشكال الرُباعية لِنظائر الإنزيمات، ومثال ذلك: كيناز الكرياتين الذي يَظهر على شَكل ثلاثة نظائر إنزيمية، كُل نظير إنزيمي مِنها عبارة عن مُركب ثنائي الوِحدات يتكون من سلسلتين من عَديد البِبتيد. يمتلك كل نظير إنزيمي لكيناز الكرياتين رحلان كهربائي مُميز عن غَيره من النَظائر.[7]
الاختلاف
تَختلف نظائر الإنزيمات عن بَعضها البَعض. حيث يَحدث هذا الاختلاف إما بسبب اختلاف الجينات المُصنِعة كَما هوَ الحال في إنزيم مالات ديهيدروجيناز، أو نتيجةً لِاختلاف كمية الكربوهيدرات المستخدمة في عملية التصنيع كما يَحصل في الفوسفاتاز القَلوي.
التوزيع
بِشكلٍ عام، توزيع نظائر الإنزيمات المُختلفة من إنزيم مُعين يعكس على الأقل أَربعة أُمور وهيَ:[11]
- الأنماط الأيضية المُختلفة في أجهزة وأعضاء الجِسم المُختلفة، مِثل: فسفوريلاز الغلايكوجين [English] (بالإنجليزية: glycogen phosphorylase)، حيث تتواجد نظائره في العَضلات الهيكلية وفي الكَبد مما يَعكس خصائصها التَنظيمية المُختلفة، حيث في الأساس يتم تخزين الغلايكوجين في الكَبد والعَضلات، ولكن النظائر الإنزيمية السابقة تعمل على تدمير وإتلاف أنسجة الكَبد والعضلات.
- المواقع والأدوار الأيضية المُختلفه في نَفس الخَلية.
- المراحل المُختلفة في من التَطور في الأنسجة الجنينة أو أنسجة الكِبار.
- ردود الفِعل المُختلفة من نظائر الإنزيمات لمُعدل التفاغر.
واسمات جزيئية
تُستخدم نظائر الإنزيمات والإنزيمات المُتغايره جينياً كَواسمات ومحددات جُزيئية [English]، حيث أَنَّ عِلم الوِراثة السُكانية في جَوهره يَعمل على دراسة أَسباب وآثار التَباين والاختِلاف الوِراثي بينَ السُكان، حيث في الماضي كانت نظائِر الإنزيمات تُستخدم كَواسمات جزيئية تُساعد في هذا العِلم، وعلى الرَغم من أنه في الوَقت الراهن تُستخدم واسمات جُزيئية أَخرى أَكثر مَنهجية وَدقة بالنِسبة للحمض النّووي (مِثل تسلسل الحمض النووي وَتعدد أشكال النوكليوتيدات المفردة) إلا أَنَّ نظائر الإنزيمات تَبقى الطَريقة الأَسرع والأقل تَكلفة بين تِلك النُظم، وفي عام 2005 اعتُبرت نظائر الإنزيمات الخَيار الأَول للاستخدام في عِلم الوراثة السُكانية.
أمثلة

الغلوكوكيناز
يُعتبر غلوكوكيناز (بالإنجليزية: Glucokinase) من الأَمثله على نظائر الإنزيمات، فهوَ بَديل الهكسوكيناز (Hexokinase) الذي لا يمكن تثبيطه عن طَريق الغلوكوز سداسي الفوسفات، وَيُستخدم الغلوكوكيناز في التَحكم في الإنسولين عن طَريق خلايا بيتا في البنكرياس، كما يلعب دوراً مُهم في بدأ تصنع الجلايكوجين في خلايا الكبد، وهذه الأمور تحدث فقط عندما يكون الجلوكوز متوافر بكثرة أو هناك مشكلة معينة.
كيناز الكرياتين
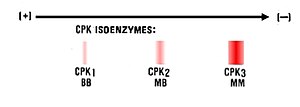
يتواجد كيناز الكرياتين (بالإنجليزية: Creatine kinase) على شكل ثَلاثة نظائر إنزيمية، تستخدم كَدليل أولي على احتشاء عضلة القلب، وَيَتكون كُل نظير من وِحدتين إحداهما M والأُخرى B كَالتالي:
| النوع | التَركيب | مَكان التَواجد | الارتفاع |
|---|---|---|---|
| CK1 | BB | في الدِماغ | يرتفع أثناء أمراض الجِهاز العَصبي المَركزي |
| CK2 | MB* | في القَلب | يَرتفع أثناء احتشاء عضلة القلب |
| CK3 | MM | في العَضلات الهيكلية وَ القَلب |
- CK2 غَير قَابل لِلكَشف (<2%) فِي مصل الدم للِأَشخاص الأَصِحاء، وَتزداد نسبته في الدَم إِلى 20% فِي الساعات 6-18 الأولى بعد احتشاء عضلة القلب، وَيتبع ازدياد نسبته ألم في الصَدر.[7]
الإنزيمات النازعة لِهيدروجين اللاكتات

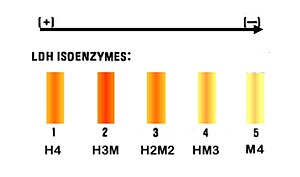
تُعتبر الإنزيمات النازعة لِهيدروجين اللاكتات (بالإنجليزية: Lactate Dehydrogenase)[12] من الأمثلة على نظائر الإنزيمات، وتُدعى اختصاراً LDH، وَهُوَ إنزيم رُباعي الوِحدات يتواجد في الأنسجة الفَقارية[11]، يَتكون مِن وحدتان من نوع H (حمضية) والآخريين من نوع M (قاعدية)، وَيكون الجُزء الرُباعي فَقط هو الفَعال في الإِنزيم[13]، وفيه تَتحد الوِحدات الأَربعة لِتُكون 5 نظائر إِنزيمية (ك.ج لِكل مِنها 33,500)[11] كَالتالي:[14][15]
| النوع | التَركيب | مَكان التَواجد | المستوى الطبيعي | الارتفاع |
|---|---|---|---|---|
| LDH1 | HHHH | في القَلب وَكريات الدَم الحَمراء | 17-27% | يَرتفع في حالات احتشاء عضلة القلب |
| LDH2 | HHHM | في القَلب وَكريات الدَم الحَمراء | 27-37% | يرتَفع في حالة الجَلطة القَلبية |
| LDH3 | HHMM | في الدِماغ والكِلية وَالعَضلات الهيكلية | 18-25% | |
| LDH4 | HMMM | في العَضلات الهيكلية والكَبِد | 8-16% | |
| LDH5 | MMMM | في العَضلات الهيكلية والكَبِد | 6-16% | يَرتفع في حالات أمرض الكبد والعضلات المخططة. |
وَتُستخدم الإنزيمات النازعة لحمض اللبن كَواسمات جزيئية في تشخيص الأَمرض، ومثال ذلك: عند تَعرض أنسجة القَلب للتَلف يتم إفراز الإنزيمات النازعة لحمض اللبن في الدَم، وبعد فترة وَجيزة مِن حُصول النوبة القَلبية يزداد مُستوى هذه الإنزيمات في الدَم بشكل غير طَبيعي، وتُصبح كَمية الإنزيم النازع لحمض اللبن الثاني أكثر من كمية الإنزيم النازع لحمض اللبن الأول، وبعد مُرور 12 ساعة تُصبح كَميتهما مُتساوية تقريباً، وبعد مُضي 24 تصبح كمية الإنزيم النازع الأول أكثر من كمية الإنزيم النازع الثاني، وبالتالي يتم اعتبار التغيير في النسبة بين النظير الأول والثاني بالإضافة إلى التَغيير في نظائر كيناز الكرياتين من الأدلى القَوية على حصول احتشاء عضلة القلب.[11]
فوسفاتاز قلوي
الفوسفاتاز القَلوي (بالإنجليزية: Alkaline phosphatase) وَيُدعى اختصاراً (ALP)، وَهوَ أَحد إِنزيمات بلازما الدم حَيث يَعمل في وَسط قَلوي (pH=9-10.5)، وَيتواجد بنسب مُرتفعه في الكَبد وَالعِظام وَالمَشيمة وَالأَمعاء الدَقيقة، ويتم استخدامه في تَقييم أمراض الكَبد والعِظام، وَيَتواجد الفوسفاتاز القَلوي في الجِسم على شَكل ثلاثة نَظائر إنزيمية، كَالتالي:
| النوع | مَكان التَواجد | ملاحظات |
|---|---|---|
| ALPI | في الأَمعاء | |
| ALPL | في الكَبد وَالعِظام وَالكِلية | يُعتبر غَير متخصص نسيجياً |
| ALPP | في المَشيمة | يُدعى ريغان آيزوزايم |
ويتم في الثدييات تَثبيط هذا النظائر باستخدام الأرجنين المتماثل [English]، ما عَدا الفوسفاتاز القلوي الموجود في المَشيمة، كَما أن هذه النظائر تَتحول إلى الشَكل غير النَشط في حال ارتفاع درجة الحَرارة إلى 65 درجة سيلسيوسية، ما عدا النّوع المتواجد في المَشيمة.
المَراجع
- ^ المعجم الطبي،الإصدار الثاني، ترجمة isoenzyme
- ^ المُعجم الطبي المُوحد، تَرجَمة Isoenzyme.
- ^ "LDLP - Librairie Du Liban Publishers". ldlp-dictionary.com. مؤرشف من الأصل في 2017-12-23. اطلع عليه بتاريخ 2017-12-22.
- ^ "LDLP - Librairie Du Liban Publishers". ldlp-dictionary.com. مؤرشف من الأصل في 2017-12-23. اطلع عليه بتاريخ 2017-12-22.
- ^ "LDLP - Librairie Du Liban Publishers". ldlp-dictionary.com. مؤرشف من الأصل في 2017-12-23. اطلع عليه بتاريخ 2017-12-22.
- ^ Altibbi.com. "نظير انزيمي - الطبي". مؤرشف من الأصل في 2016-03-05.
- ^ أ ب ت ث Richard Harvey; Denise Ferrier (2011). Lipponcott's IIIulstrated Reviews: Biochemistry (بالإنجليزية) (الخامسة ed.). p. 65. ISBN:9781608314126.
{{استشهاد بكتاب}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(help)صيانة الاستشهاد: لغة غير مدعومة (link) - ^ Isoenzyme، Arab Scientific community organization: dr.mohammad.a.b
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ المُعجم الطبي المُوحد، ترجمة Tartrate
- ^ نَظائِر الإِنزيمات، منظمة المجتمع العِلمي العَربي: أ.د محمد عيد شبير، مؤرشف من الأصل في 2017-05-29، اطلع عليه بتاريخ 2015-09-06
- ^ أ ب ت ث ج David L. Nelson (2008). Lehninger principles of biochemistry [مبادئ لاننجر في الكيمياء الحيوية] (بالإنجليزية) (الخامسة ed.). United States of America: W. H. Freeman and Company. p. 584. ISBN:978-0-7167-7108-1. Retrieved 2015-09-17.
{{استشهاد بكتاب}}: الوسيط author-name-list parameters تكرر أكثر من مرة (help)صيانة الاستشهاد: لغة غير مدعومة (link) - ^ دراسة تَغيُرات LDH وَ HBDH في مجموعات مرضية مُحددة (PDF)، جامعة تشرين/كُلية الطب البشري: د.كنده عبد الجبار جادالله، 2007، مؤرشف من الأصل (PDF) في 2016-03-07، اطلع عليه بتاريخ 2015-09-01
- ^ Lactate dehydrogenase test، Florida Cancer Specialists & Research Institute, Wellington: Todd Gersten، مؤرشف من الأصل في 2016-07-04، اطلع عليه بتاريخ 2015-09-01
- ^ Lactate dehydrogenase isoenzymes test، Janis O. Flores، مؤرشف من الأصل في 2013-10-17، اطلع عليه بتاريخ 2015-09-01
{{استشهاد}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ LDH isoenzymes، Department of Medicine, University of Washington School of Medicine: David C. Dugdale، مؤرشف من الأصل في 2016-07-04، اطلع عليه بتاريخ 2015-09-01
المصادر
- Isoenzymes-Multienzyme complex (PDF)، Abeer Abd-Al Qader، 2011، مؤرشف من الأصل (PDF) في 2020-03-14، اطلع عليه بتاريخ 2015-09-17
- Histochemical demonstration of enzymes separated by zone electrophoresis in starch gels، Hunter, R. L. and C.L. Merkert، 1957، ص. 125: 1294-1295
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - Selective cyclic nucleotide phosphodiesterase inhibitors as potential therapeutic agents، Weiss, B. and Hait، 1977، ص. 17:441-477
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - Visualisation and interpretation of plant isozymes، Wendel, JF, and NF Weeden، 1990، ص. 5-45
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - Genetics of plant isozymes، Weeden, NF, and JF Wendel، 1990، ص. 46-72
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - Enzyme electrophoresis and plant systematics، Crawford, DJ، 1989، ص. 146-164
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - Allozyme diversity in plant species، Hamrick, JL, and MJW Godt، 1990، ص. 43-63
{{استشهاد}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة)
روابط خارجية
- مَقالة عن نظائر الإنزيمات.
- تقنيات الفصل الكهربائي الهلامي للإنزيمات المتغايرة جينيا - دليل شامل للفصل الكهربائي الهلامي النشوي.
- تطور علاجات جديدة مختصة بالنظائر الإنزيمية - Fatty Acid Dioxygenases and Eicosanoid Hormones (Estonia)
| في كومنز صور وملفات عن: نظير إنزيمي |