|
تضامنًا مع حق الشعب الفلسطيني |
براسيوديميوم
هذه المقالة بحاجة لمراجعة خبير مختص في مجالها. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض رمادي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | براسوديميوم، 59، Pr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | لانثانيدات | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | n/a, 6، f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 140.90765 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Xe]; 4f3 6s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 21, 8, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 6.77 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.50 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1208 ك، 935 °س، 1715 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3793 ك، 3520 °س، 6368 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 6.89 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 331 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 27.20 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 3, 2 (أكاسيده قاعدية ضعيفة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.13 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 527 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1020 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2086 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 182 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 7±203 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | (درجة حرارة الغرفة) (ألفا، بولي) 0.700 µأوم·متر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 12.5 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | (درجة حرارة الغرفة) (ألفا، بولي) 6.7 ميكرومتر/(م·كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 2280 متر/ثانية (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | (الشكل ألفا) 37.3 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | (الشكل ألفا) 14.8 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | (الشكل ألفا) 28.8 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | (الشكل ألفا) 0.281 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 400 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 481 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-10-0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر البراسوديميوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
براسيوديميوم[2][3] أو برازوديميوم[3] (بالإنجليزية: Praseodymium) هو عنصر كيميائي رقمه الذريّ 59 ويرمز له (Pr). البراسيوديميوم هو العنصر الثالث في سلسلة اللانثانيدات، وهو أحد العناصر النادرة على كوكب الأرض. ومن الخواص الفيزيائية التي يمتاز بها البراسيوديميوم مرونته وقابليته للسحب والطرق، بالإضافة إلى المظهر المتمثل باللون الفضيّ، كما أن لهذا العنصر قيمة كبيره لما له من صفات مغناطيسية وكهربائية وكيميائية وضوئية.[4] يُعد البراسيوديميوم من العناصر نشطة التفاعل مما يجعل من الصعب العثور عليه بشكله الأصليّ، وتتكون على سطحه طبقة من الأكسيد أخضر اللّون عند تفاعله مع الهواء.[5]
دائمًا ما يتواجد البراسيوديميوم بشكل طبيعي مع العناصر النادرة الأُخرى، كما أنه العنصر الرابع الأكثر ندرة على الأرض؛ حيث يمثل تركيزه من القشرة الأرضية ما يعادل 9.1 جزء من المليون وهذه النسبة تقارب نسبة توافر البورون.[6] قام العالم الكيميائي السويدي كارل جوستاف موساندر عام 1841م باستخراج رواسب وبقايا أكسيد نادر سمّاه «ديديميوم» وذلك من رواسب ما سمّاه بـ «لانثانا»، وذلك عن طريق فصل أملاح السيريوم. وفي عام 1885م نجح البارون والكيميائي النمساويّ كارل أوير بفصل الديديميوم إلى عنصرين نتج عنهما ملحان لهما لونان مختلفان، وقد سمّاهُما «براسيوديميوم» و«نيوديميوم». وقد جاءت التسمية من الأصل الإغريقيّ لكلمة براسينوس «πράσινος» والتي تعني الأخضر، وكلمة ديديموس «δίδυμος» وتعني التوأم.[7][8]
كما هو الحال في معظم العناصر النادرة، فإنّ من السهل جدًّا للبراسيوديميوم أن يتشكل على حالة الأكسدة (+3)؛ التي تكون مستقرة فقط في المحلول المائي؛ وبالرغم من أنّ حالة الأكسدة (+4) معروفة في بعض المركبات الصلبة وفريدة بين اللانثانيدات، يمكن تحقيق حالة الأكسدة (+5) في ظروف العزل المطرسي.[9] أيونات البراسيوديميوم المائية خضراء مائلة للصفرة، وعلى نحو مماثل ينتج عن استخدام البراسيوديميوم في تركيب زجاج النظارات ظلال خضراء مصفرة متنوعة. وله العديد من الاستخدامات الصناعية لقدرته على ترشيح اللون الأصفر من مصادر الضوء.
نبذة تاريخية

في عام 1751م اكتشف عالم المعادن السويدي أكسل فريدريك كرونستيد معدنًا ثقيلًا داخل منجمٍ في باستناس، سميّ فيما بعد باسم سيريت.بعد ثلاثين عامًا، قام فيلهلم هزينجر الذي كان عمره وقتئذٍ خمسة عشر عامًا -وهو أحد أفراد العائلة المالكة للمنجم- بإرسال عينة إلى كارل فلهلم شيله، لكن هذا الأخير لم يجد أي عنصر جديد في ذلك الوقت.[10] في عام 1803م، وبعد أن أصبح عند هزينجر صاحب مصنع للحديد، عاد إلى دراسة المعدن مع يونس ياكوب بيرسيليوس وقاما بفصل أكسيد جديد أطلقا عليه اسم سيريس نسبة إلى الكوكب القزم سيريس، الذي اكتُشِف قبل عامين. وفي ألمانيا، عزل مارتن كلابروت المركب سيريس بطريقة مستقلة وفي نفس الفترة الزمنية.[11]
خلال الفترة الزمنية الممتدة بين عامي 1839 و1843م، أوضح الجراح والكيميائي كارل جوستاف موساندر الذي كان يعيش في نفس منزل بيرسيليوس أن سيريس مزيج من الأكاسيد، وقام بفصل أكسيدين أطلق عليهما اسم لانثانا وديديميا. قام موساندر بتفكيك جزئي لعينة من نترات السيزيوم من خلال تسخينه بالهواء ومن ثم معالجة الأكسيد الناتج بحمض النتريك المخفف.[10] سميت المعادن التي كونت الأكاسيد الناتجة بـ«لانثانوم» و«ديديميوم». واتضح لاحقا أن اللانثانوم عبارة عن عنصر نقي، بينما الديديميوم هو عبارة عن مزيج من عناصر اللانثانيدات المستقرة من البراسيوديميوم إلى اليوروبيوم،[11] كما كان يشك مارك ديلافونفين بعد تحليل طيف المركب، بالرغم من ضيق وقته للعمل على فصله إلى العناصر المكونة له.[12]
لم يتم فصل العنصرين الثقيلين ساماريوم ويوروبيوم سوى في عام 1879م بواسطة باول-إيميل ليكوج دي بويسباودران واستغرق الأمر حتى عام 1885م ليتمكن كارل أوير فون فيلسباتش من فصل الديديميوم إلى الباسيوديموم والنيوديميوم.[13] وبسبب أن النيوديميوم يحتل كمية أكبر من البراسيوديميوم في الديديميوم، فقد حافظ على المسمى القديم مع توضيح، في حين تم تمييز البراسيوديميوم بلون ملحه الأخضر الكراثي (الكلمة الإغريقية "πρασιος" تعني أخضر كراثي). أُقتِرحت التركيبة الطبيعية للديديميوم في عام 1882م من قبل بوهيوسلاڤ برانر، والذي لم يوضح تجريبيًا طريقة الفصل.[14]
الخصائص
الخصائص الفيزيائية
يُعتبر البراسيوديميوم العنصر الثالث من سلسلة اللانثانيدات، ويظهر في الجدول الدوريّ بين لانثانيدي: النيوديميوم على اليسار والسيريوم على اليمين وفوق أكتينيد البروتكتينيوم، إضافةً لكونه من المعادن اللدنة وذي صلابة مقاربة لصلابة الفضة.[15] إلكتروناته الـ 59 موزعة على الهيئة [Xe]4f36s2 ونظريًّا فإنّ جميع الإلكترونات الخمس الخارجية لها القدرة على التصرف كإلكترونات تكافؤ، لكن استخدام جميع هذه الإلكترونات الخمسة يتطلب شروطا مشددة وعادة ما يمنح البراسيوديميوم ثلاث إلكترونات فقط لمركباته إلا أنّه في بعض الظروف قد يعطي أربع إلكترونات.[16] كما يعد أول اللانثانيدات التي تملك توزعًا إلكترونيًّا يتوافق مع مبدأ أوفباو الذي يتنبأ أنّ المدار 4f يملك مستوى طاقة أقل من تلك التي يمتلكها المدار 5d، وهذا المبدأ لا ينطبق على اللانثانوم والسِّيريُوم لأن الانكماش المفاجئ للمدار 4f لا يحدث سوى بعد اللانثانوم، وهو غير قوي كفاية في السيريوم لتجنب شغل (ملأ) المدار الفرعي 5d. ومع ذلك فإنّ البراسيوديميوم في الحالة الصلبة يأخذ الهيئة [Xe]4f36s2 بإلكترون واحد في المدار 5d كما هو الحال في باقي اللانثانيدات ثلاثية التكافؤ -عدا اليوروبيوم والإتيربيوم اللذان يكونان ثنائيا التكافؤ في الحالة الفلزية-.[17]
كمعظم الفلزات الأخرى في سلسلة اللانثانيدات، يستخدم البراسيوديميوم ثلاثة إلكترونات كإلكترونات تكافؤ ويكون الإلكترونان المتبقيان في المدار 4f مرتبطين بشكل قوي جدًا: وهذا لأن مدارت 4f هي الأكثر اختراقا لإلكترونات لب الزينون الداخلي نحو النواة، تليها مدارات 5d و6s، ويزداد هذا الاختراق بزيادة الشحنة الأيونية. ومع ذلك فإنّ البراسيوديميوم يستطيع مواصلة فقدان إلكترون التكافؤ الرابع وأحيانًا الخامس؛ بسبب وجوده في بداية سلسلة اللانثانيدات حيث أنّ شحنة النواة ما تزال ضعيفة بالقدر الكافي والمدار الفرعي 4f يملك طاقة كافية للسماح بفقدان المزيد من إلكترونات التكافؤ.[4] وبالتالي، فإنّ البراسيوديميوم كأشباهه من أوائل سلسلة اللانثانيدات يملك بنية بلورية سدادسية مزدوجة متراصة التعبئة عند درجة حرارة الغرفة. وعند درجة حرارة تقارب 560°س. تتحول بنيته البلوريّة إلى مكعب مركزي الوجه، بينما تظهر بنية المكعب مركزي الجسم بوقت قصير قبل درجة الانصهار عند درجة حرارة 935°س.
يعتبر البراسيوديميوم كباقي اللانثانيدات (عدا اللانثانوم والإيتربيوم واللوتيشيوم؛ الذّين لا يملكون إلكترونات منفردة غير مزدوجة في المدار 4f) ذو صفات مغناطيسية مسايرة عند درجة حرارة الغرفة.[16] وخلافا لبعض المعادن الأرضية النادرة التي تُظهر خواص مغناطيسية حديدية مضادة أو مغناطيسية حديدية على الترتيب عند درجات الحرارة المنخفضة، فإنّ البراسيوديميوم يكون ذو خواص مغناطيسية مسايرة في جميع درجات الحرارة فوق 1 كلفن.
نظائر البراسيوديميوم
للبراسيوديميوم نظير واحد مستقر متواجد طبيعيًّا وهو 141Pr. وبالتالي يعتبر عنصر أحادي النويدة، كما يمكن قياس وزنه الذريّ بدقة عالية لأنه ثابت في الطبيعة. يملك هذا النظير 82 نيوترونًا وهو عدد سحري يمنحه ثباتًا إضافيًّا. ينتج هذا النظير في النجوم خلال عمليتي الالتقاط النيوترونيّ السريع والبطيء.[18]
أمّا باقي النظائر الأخرى فلها عمر النصف أقل من يوم واحد -ومعظمها أقل من دقيقة واحدة- مع استثناء واحد للنظير 143Pr حيث يصل عمر النصف الخاص به إلى 13.6 يوم، وينتج كِلا النظيرين 143Pr و141Pr عن انشطار اليورانيوم. يكون شكل الاضمحلال الأساسي للنظائر الأخف من النظير 141Pr على هيئة انبعاث البوزيترون أو ظاهرة التقاط الإلكترون إلى نظائر السِّيريُوم، في حين أنّ النظائر الأثقل من 141Pr تكون على هيئة اضمحلال بيتا إلى نظائر النيوديميوم.
الخصائص الكيميائية
يتآكل معدن البراسيوديميوم في الهواء ببطئ حيث تتشكل طبقة من شواظ الأكسيد مماثلة لصدأ الحديد، وهذا كافٍ لتآكل عينة أبعادها واحد سنتيمتر من معدن البراسوديميوم بشكل كامل خلال ما يقارب سنة.[6] إضافةً لاحتراقه بسهولة عند درجة حرارة 150° س مكوّنه أكسيد البراسوديميوم (III، IV) الذي يعد مركبًا غير متكافئ قريب من Pr6O11:[19]
- 12 Pr + 11 O2 → 2 Pr6O11
ويمكن إرجاع هذا المركب إلى أكسيد البراسيوديميوم (III) (Pr2O3) بالتفاعل مع غاز الهيدروجين.[20] في حين أنّ أكسيد البراسيوديميوم PrO2 هو الناتج الأكثر أكسدة من احتراق البراسيوديميوم ويمكن الحصول عليه إمّا عن طريق تفاعل معدن البراسيوديميوم مع الأكسجين النقي في ظرف درجة الحرارة 400° س و282 بار،[20] أو عن طريق فصل نواتج تفاعل Pr6O11 في حمض الأسيتيك المغلي. قدرة البراسيوديميوم على إعادة التفاعل وافقت التوقعات حيث أّنه أول وأكبر اللانثانيدات.[7][8]
تَظهَر العديد من أكاسيد البراسيوديميوم ذات التركيب PrO2−x بشكل غير متجانس وغير منتظم عند درجة حرارة 1000° س وعندما تتراوح قيم x بين 0 و0.25، لكن عند درجات الحرارة ما بين 400 و700°س تبدأ تظهر عيوب الأكاسيد بدلاً من انتظامها، مكونةً أطواراً حسب الصيغة العامة PrnO2n−2 بقيم n = 4، 7، 9، 10، 11، 12، ∞. هذه الأطوار PrOy عادةً ما يرمز لها ب α وβ′ (غير متكافئ)، β ( y= 1.833)، δ (1.818)، ε (1.8)، ζ (1.778)، ι (1.714)، θ، σ.[21]
يعرف البراسيوديميوم على أنّه عنصر موجب القطبية الكهربائية ويتفاعل ببطيء مع الماء البارد وبسرعة مع الماء الساخن مكونًا هيدروكسيد البراسيوديميوم (III).[8]
- 2 Pr (s) + 6 H2O (l) → 2 Pr(OH)3 (aq) + 3 H2 (g)
تتفاعل معادنه مع جميع الهالوجينات ليكون هاليدات ثلاثية:[8]
- 2 Pr (s) + 3 F2 (g) → 2 PrF3 (s) [green]
- 2 Pr (s) + 3 Cl2 (g) → 2 PrCl3 (s) [green]
- 2 Pr (s) + 3 Br2 (g) → 2 PrBr3 (s) [green]
- 2 Pr (s) + 3 I2 (g) → 2 PrI3 (s)
من المركبات المعروفة أيضًا رباعي الفلوريد PrF4، وينتج عن تفاعل خليط من فلوريد الصوديوم وفلوريد البراسيوديميوم (III) مع غاز الفلورين لينتج Na2PrF6 متبوعًا بإخراج فلوريد الصوديوم من الخليط المتفاعل مع فلوريد الهيدروجين السائل.[22] بالإضافة إلى أنّ البراسيوديميوم يشكل ثنائي ديودايد البرونز مثل ديوديدات اللانثانيوم والسيريوم الغادولينيوم، والبراسيوديميوم (III) مركب كهربائي قطبي. ويذوب البراسيوديميوم بسهولة في حمض الكبريتيك المخفف ليشكل محاليل تحتوي على أيونات خضراء مصفرّة Pr3+ تظهر على شكل معقّدات [Pr(H2O)9]3+.[23]
- 2 Pr (s) + 3 H2SO4 (aq) → 2 Pr3+ (aq) + 3 SO42- (aq) + 3 H2 (g)
ذوبان مركبات البراسيوديميوم (IV) في الماء لا ينتج عنه محاليل تحتوي على أيونات صفراء Pr4+؛[9] وذلك بسبب الموجبية العالية المعيارية لجهد الاختزال لزوجي Pr4+/Pr3+ عند +3.2 فولت، فهذه الأيونات غير مستقرة في المحلول المائي، وتتأكسد المياه لتصبح مخففة ل Pr3+. وقيمة الجهد لزوج الـــ Pr3+/Pr تساوي -2.35 فولت. مع ذلك فإنّ Pr4+ في الأوساط المائية عالية القاعدية يمكن أن تنتج عن التأكسد مع الأوزون.[24]
بالرغم من أنّ البراسيوديميوم (V) في الحالة الصلبة غير معروف، إلا أنّ وجود البراسيوديميوم في حالة الأكسدة +5 -مع توزيع إلكتروني مستقر السابق لغاز الزينون النبيل- تحت ظروف غشاء الغازات النبيل العازل تم تسجيلها في عام 2016م. تم تحديد الأصناف المحددة في حالة الأكسدة +5 كــ +[PrO2]، ونواتجها O2، وAr، وPrO2(η2-O2).[25]
تشبه مركبات البراسيوديميوم العضوية إلى حد كبير باقي اللانثانيدات، حيث أنّ كلهم يتشاركون في عدم القدرة على اجتياز / تحطيم رابطة π.[26] وبالتالي فهي في الأغلب محصورة لأغلب السيكلوبنتادينات الأيونية -مماثلة في البنية مع اللانثانيوم- ورابطة σ الألكيل البسيط والبنسيل، وبعضها قد يكون مبلمر. يكون التناسق الكيميائي في البراسيوديميوم موجود بصورة كبيرة جدًّا، الأيونات الكهروضوئية الموجبة Pr3+، وهي فعلاً مشابهة إلى حد كبير باقي اللانثانيدات الأولية مثل La3+ وCe3+ وNd3+.
وعلى سبيل المثال، فإنَّ اللانثانوم والسِّيريُوم والنيوديميوم ونترات البراسيديميوم كلها تُكوّن كلًّا من المركبات 4:3 و1:1 مع إيثر 18-تاج-6، في حين أنّ اللانثانيدات المتوسطة من البروميثيوم وصولاً إلى الغادولينيوم تستطيع فقط تكوين المركبات 4:3، ومن جهة أخرى فإنّ اللانثانيدات الأخيرة /الذيلية من التربيوم حتى اللوتيشيوم لا يمكنها النجاح في عملية ترتيب جميع روابط المركبات. تملك البراسيوديميوم أرقام تناسق عالية مع إنهّا غير مؤكدة مع ضعف في البنية الكيميائية لها باستثناءات لتلك الناتجة عن الترابطات الضخمة مثل ثلاثية التناسق [Pr{N(SiMe3)2}3]. هناك أيضًا بعض مخاليط الأكاسيد والفلوريدات التي تشتمل على البراسيوديميوم (IV)، لكنها لا تملك تناسق كيميائي ذو قيمة في هذه الحالات المؤكسدة مثل السِّيريُوم المجاور لها.[27]
التواجد والإنتاج
لا يعد البراسيوديميوم من العناصر النادرة بشكل خاص، حيث أنّه يشكل 9.1 مغ/كغ من القشرة الأرضية. هذه القيمة تتمركز بين تركيز الرصاص (13 مغ/كغ) والبورون (9 مغ/كغ) في القشرة الأرضية، ويعتبر من رابع العناصر الوفيرة من اللانثانيدات،[28] بعد السِّيريُوم (66 مغ/كغ)، والنيوديميوم (40 مغ/كغ)، واللانثانوم (35 مغ/كغ)؛ وإنّه أقل وفرة من عناصر الأرض النادرة الإتريوم (31 مغ/كغ) والسكانديوم (25 مغ/كغ).[29] جاء تصنيف البراسيوديميوم على أنه عنصر نادر في الأرض نسبة إلى «مكونات الأرض المشتركة» مثل الحجر الجيري والمنغنيز، والتي تتكون من مجموعة من العناصر المعروفة سهلة الاستخراج ومطلوبة تجاريًا. وعلى الرغم من أنّه ليس نادراً بشكل خاص، إلا أنّه لم يعتبر قط كعنصر نادرًا في القشرة الأرضية من المعادن الحاملة للبراسيوديميوم. ودائمًا ما يسبقه السِّيريُوم واللانثانيوم والنيوديميوم أيضًا.[30]
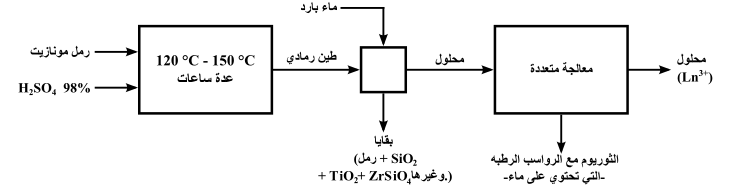
يشبه حجم أيون البراسيوديميوم الثلاثي (Pr3+) اللانثانيدات الأولى في مجموعة السيريوم (من الساماريوم إلى اليوروبيوم) التي تتبع الجدول الدوريّ، وبالتالي يميل الأيون إلى التفاعل مع مجموعة السيريوم في الفوسفات، والسيليكات، والكربونات، مثل المونازيت (MIIIPO4) والباستناسايت (MIIICO3F)، بحيث يرمز الحرف M إلى معادن الأرض النادرة ماعدا السكانكيوم والبروميثيوم المشع (معظمهم Ce، وLa، وY، والقليل من Nd، وPr). يفتقر الباستناسايت إلى الثوريوم واللانثانيدات الثقيلة، كما أن اللانثانيدات الخفيفة النقية أقل مشاركة فيه. ويعالج الخام من هذه المادة بعد تحطيمه وسحقه أولًا بحمض الكبريتيك المركز الساخن، وثاني أكسيد الكربون، وفلوريد الهيدروجين، ورباعي فلوريد السيليكون. بعد ذلك يتم تجفيف المنتج وترشيحه بالماء، تاركًا أيونات اللانثانيد الأولى، بما في ذلك اللانثانم، في محلول.[30]
يتكون المونازيت عادة من كل معادن القشرة الأرضية النادرة، والثريوم بشكل خاص. يمكن فصل المونازيت -بسبب خواصه المغناطيسية- بالفصل الكهرومغناطيسي المتكرر. ويعالج بعد إتمام عملية الفصل مع حمض الكبريتيك المركز الساخن لإنتاج كبريتات المعادن النادرة القابلة للذوبان في الماء. يتم معادلة المرشحات الحمضية جزئيًا مع هيدروكسيد الصوديوم إلى الرقم الهيدروجيني 3-4 الذي يترسب بسببه هيدروكسيد الثوريوم ثم يُزال. ومن ثم يعالج المحلول باستخدام أكسالات الأمونيوم لتحويل معادن القشرة النادرة إلى أكسالات غير قابلة للذوبان، وتُحوّل الأكسالات إلى أكاسيد عن طريق الحرارة العالية، وتذاب الأكاسيد في حمض النتريك.[30] في الخطوة الأخيرة، يستثنى أحد أهم مكونات المركب، وهو السيريوم حيث أنّ أكسيد السيريوم غير قابل للذوبان في HNO3. يجب توخي الحذر عند التعامل مع بعض الرواسب لأنها تحتوي على 228Ra، و232Th، وهما باعثان قويَّان لأشعة غاما.[30]
يمكن بعد ذلك فصل البراسيوديميوم عن اللانثانيدات الأخرى عن طريق التبادل الأيوني (كروماتوغرفيا)، أو باستخدام مذيب مثل ثلاثي بيوتيل الفوسفات حيث يزداد ذوبان Ln3+ مع زيادة الرقم الذريّ. في حالة استخدام التبادل الأيوني يتم تعبأة خليط اللانثانيدات داخل عامود من المادة الصبغية للتبادل الكاتيوني ويعبأ Cu2+ أو Zn2+ أو Fe3+ في العامود الأخر. يتم تمرير محلول مائي لعامل مركّب يعرف باسم اليونت -الذي عادةً ما يكون ثلاثي الأمونيوم- خلال الأعمدة، ثم ينقل Ln3+ من العمود الأول ويعاد وضعه في شريط متراص في أعلى العامود قبل أن يبدأ في إعادة التموضع بواسطة NH4+. تزداد طاقة غيبس الحرة لتكوين المركبات Ln(edta·H) على طول اللانثانيدات بما يقارب ربع من Ce3+ حتى Lu3+، حيث يتنزل كاتيونات Ln3+ عامود النمو في نطاق ومن ثمّ تجزأ على نحو متكرر، وتُزال من الأثقل إلى الأخف وزنًا. بعدها ترسَّب كأُكسالات غير ذائبه، ثم تحرق لتكوين أكاسيد، وأخيرًا تختزل إلى معادن.
التطبيقات
حقق ليو موسر بن لودفيغ موسر مؤسس شركة موسر للزجاج في التشيك التي تعرف الآن باسم كارلوفي فاري نجاحًا في استعمال البراسيوديميوم لتلوين الزجاج في أواخر العشرينيات من القرن الماضي، حيث قام بتلوين كوب زجاج باللون الأخضر المصفر ما يعرف باسم «براسيمِت» (بالإنجليزية: Prasemit). ورغم ذلك النجاح لم يلقى رواجًا كبيراً في تلك الفترة لوجود بدائل تعطي نفس اللون بتكلفة أقل، مع ذلك فقد تم تلوين بعض القطع. كما قام موسر بمزج البراسيوديميوم مع النيوديميوم لإنتاج زجاج الهيليوليت -وهي كلمة ألمانية الأصل-، الذي انتشر على نحوٍ واسع.[31] أول استخدام تجاري للبراسيوديميوم المنقى الذي مازال مستمراً إلى يومنا الحالي يكون شكله على هيئة صبغة برتقالية مصفرة، البراسيوديميوم الأصفر وهو لون السيراميك؛ عبارة عن محلول صلب في شبكة من الزركون. هذا اللون لا يحتوي على اللون الأخضر، وبالمقابل من الواضح بشكل جليّ أنّ زجاج البراسيوديميوم يكون لونه أخضر خالٍ من اللون الأصفر.[32]
نظرًا للتشابه الكبير بين اللانثانيدات فيمكن للبراسيوديميوم أن يحل محل معظم اللانثانيدات الأخرى دون فقدان كبير في الوظائف التي تقدمها، وفي الواقع، العديد من التطبيقات التي تشتمل على مزيج متنوع من اللانثانيدات وكميات صغيرة من البراسيوديميوم مثل السبائك الحديدية وسبائك المسكميتال. التطبيقات التالية هي تطبيقات حديثة على البراسيوديميوم على وجه الخصوص أو على البراسيوديميوم كمجموعة فرعية من اللانثانيدات:[33]
- البراسيوديميوم مع النيوديميوم، يستخدم البراسيوديميوم في إنتاج مغناطيس ذو طاقة عالية ملحوظة من حيث الصلابة والقوة.[32] بشكل عام فإنّ معظم السبائك النادرة لمجموعة السِّيريُوم -من اللانثانوم حتى السماريوم- مع المعادن الانتقالية ثلاثية الأبعاد تعطي مغانط/مغناطيس بشكل مستقر للغاية، وغالبًا ما يستخدمان في المعدات الصغيرة مثل المحركات والسماعات والطابعات وسماعات الرأس ومكبرات الصوت والتخزين المغناطيسي.[33]
- عامل مساعد في صناعة السبائك مع المغنيسيوم لإنشاء معادن عالية الصلابة تستخدم في محركات الطائرات، الإتريوم والنيوديميوم أيضًا تعتبر من البدائل.[34][35]
- يتواجد البراسيوديميوم في عناصر الأرض النادرة التي تُشكل الفلوريد الجوهر الأساسي لأضواء قوس الكربون، المستخدم في صناعة الصور المتحركة لإضاءة الأستوديوهات وأضواء عارض الصور.[36]
- مركبات البراسيوديميوم تعطي الزجاج والمينا لونًا أصفر.
- يستخدم لتلوين السيراميك الأصفر.
- البراسيوديميوم مُكَوِن من مكونات زجاج الديديوم، والذي يستخدم في صناعة أنواع من نظارات اللحام والنظارات الزجاجية.[37]
- استخدم بلورات السيليكا المحقونة بأيونات البراسيوديميوم لإبطاء نبضات الضوء إلى بضع مئات الأمتار في الثانية.
- سبائك البراسيوديميوم مع النيكل (PrNi5) استخدمت لصناعة مغناطيس قوي مكّن العلماء من الوصول لدرجة حرارة تعادل 1 ألف من درجة الصفر المطلق.[38]
- حقن البراسيوديميوم في زجاج الفلوريد سمح باستخدامه كمضخم صوتي أحادي الوضع.[39]
- يستخدم أكسيد البراسيوديميوم مع السيريا أو زيركونيا السيريا كمحفز للأكسدة.
- تستخدم أيونات البراسيوديميوم Pr3+ كمنشطات في بعض أنواع الفسفور الأحمر والأخضر والأزرق والأشعة الفوق بنفسجية.
وكذلك لدور البراسيوديميوم في صناعة المغناطيسات الدائمة فقط استخدمت في توربينات الرياح، وهذا ما يجعله أحد العناصر الرئيسية في المنافسة الجيوسياسية في العالم الذي يعمل على الطاقات المتجددة، لكن قد تعرض هذا القول لانتقادات لأن ليست كل التوربينات تستخدم مغناطيسات دائمًا.[40]
الدور البيولوجي والاحتياطات
| براسيوديميوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | Danger |
| بيانات الخطر وفق GHS | H250 |
| بيانات وقائية وفق GHS | P222, P231, P422[41] |
| NFPA 704 |
|
| تعديل مصدري - تعديل | |
وجد أنّ اللانثانيدات الأولية (مثل اللانثانوم والالسِّيريُوم والبراسيوديميوم والنيوديميوم) ضرورية ولها دور أساسيّ في بعض البكتيريا الميثانية التي تعيش في الطين البركاني مثل الميثيلاسيدفيلوم فيوماريوليكوم، ولم يثبت وجود دور بيولوجي للبراسيوديميوم في أي كائن إضافةً لكونه لا يعد سامًّا في الوقت نفسه.[5] لكن من المعروف أنّ الحقن الوريدي لعناصر الأرض النادرة يؤدي إلى ضعف وظائف الكبد، بالإضافة إلى أنّ الآثار الجانبية الرئيسية الناتجة عن استنشاق أكاسيد الأرض النادرة في البشر تظهر من شوائب الثوريوم واليورانيوم.
معرض الصور
-
براسيوديميوم المياه.
-
براسيوديميوم
المراجع
- ^ M. Jackson "Magnetism of Rare Earth" The IRM quarterly col. 10, No. 3, p. 1, 2000
- ^ المعجم الطبي الموحد. "ترجمة Praseodymium". مكتبة لبنان ناشرون. مؤرشف من الأصل في 2019-08-27. اطلع عليه بتاريخ 2019-08-27.
- ^ أ ب البعلبكي، منير (1991). "البراسوديميوم؛ البرازوديميوم". موسوعة المورد. موسوعة شبكة المعرفة الريفية. مؤرشف من الأصل في 16 أبريل 2020. اطلع عليه بتاريخ 10 أيار 2013 م.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ أ ب "Phase Diagrams of the Elements", David A. Young, UCRL-51902 "Prepared for the U.S. Energy Research & Development Administration under contract No. W-7405-Eng-48". "نسخة مؤرشفة". مؤرشف من الأصل في 2020-03-23. اطلع عليه بتاريخ 2020-04-16.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ أ ب Pol، Arjan؛ Barends، Thomas R. M.؛ Dietl، Andreas؛ Khadem، Ahmad F.؛ Eygensteyn، Jelle؛ Jetten، Mike S. M.؛ Op Den Camp، Huub J. M. (2013). "Rare earth metals are essential for methanotrophic life in volcanic mudpots". Environmental Microbiology. ج. 16 ع. 1: 255–64. DOI:10.1111/1462-2920.12249. PMID:24034209.
- ^ أ ب "Rare-Earth Metal Long Term Air Exposure Test". مؤرشف من الأصل في 2019-01-30. اطلع عليه بتاريخ 2009-08-08.
- ^ أ ب Brauer, G.؛ Pfeiffer, B. (1963). "Hydrolytische spaltung von hoheren oxiden des prasedoyms und des terbiums". Journal of Less Common Materials. ج. 5 ع. 5: 171–176. DOI:10.1016/0022-5088(63)90010-9.
- ^ أ ب ت ث Minasian, S.G.؛ Batista, E.R.؛ Booth, C.H.؛ Clark, D.L.؛ Keith, J.M.؛ Kozimor, S.A.؛ Lukens, W.W.؛ Martin, R.L.؛ Shuh, D.K.؛ Stieber, C.E.؛ Tylisczcak, T.؛ Wen, Xiao-dong (2017). "Quantitative Evidence for Lanthanide-Oxygen Orbital Mixing in CeO2, PrO2, and TbO2". Journal of the American Chemical Society. ج. 139 ع. 49: 18052–18064. DOI:10.1021/jacs.7b10361.
- ^ أ ب Sroor، Farid M.A.؛ Edelmann، Frank T. (2012). "Lanthanides: Tetravalent Inorganic". Encyclopedia of Inorganic and Bioinorganic Chemistry. DOI:10.1002/9781119951438.eibc2033. ISBN:978-1-119-95143-8.
- ^ أ ب Emsley, pp. 120–5
- ^ أ ب Greenwood and Earnshaw, p. 1424
- ^ Weeks، Mary Elvira (1932). "The Discovery of the Elements: XI. Some Elements Isolated with the Aid of Potassium and Sodium:Zirconium, Titanium, Cerium and Thorium". The Journal of Chemical Education. ج. 9 ع. 7: 1231–1243. Bibcode:1932JChEd...9.1231W. DOI:10.1021/ed009p1231.
- ^ Fontani، Marco؛ Costa، Mariagrazia؛ Orna، Virginia (2014). The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. ص. 122–123. ISBN:978-0-19-938334-4. مؤرشف من الأصل في 2020-01-27.
- ^ Fontani، Marco؛ Costa، Mariagrazia؛ Orna، Virginia (2014). The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. ص. 40. ISBN:978-0-19-938334-4. مؤرشف من الأصل في 2020-02-14.
- ^ Lide, D. R.، المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 86th)، Boca Raton (FL): CRC Press، ISBN:0-8493-0486-5
- ^ أ ب Greenwood and Earnshaw, pp. 1232–5
- ^ Greenwood and Earnshaw, pp. 1235–8
- ^ Cameron، A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. ج. 15 ع. 1: 121–146. Bibcode:1973SSRv...15..121C. DOI:10.1007/BF00172440. مؤرشف من الأصل (PDF) في 2011-10-21.
- ^ "Chemical reactions of Praseodymium". Webelements. مؤرشف من الأصل في 2019-05-09. اطلع عليه بتاريخ 2016-07-09.
- ^ أ ب Greenwood and Earnshaw, pp. 1238–9
- ^ Greenwood and Earnshaw, pp. 643–4
- ^ Greenwood and Earnshaw, p. 1240–2
- ^ Greenwood and Earnshaw, pp. 1242–4
- ^ Hobart, D.E.؛ Samhoun, K.؛ Young, J.P.؛ Norvell, V.E.؛ Mamantov, G.؛ Peterson, J. R. (1980). "Stabilization of Praseodymium(IV) and Terbium(IV) in Aqueous Carbonate Solution<". Inorganic and Nuclear Chemistry Letters. ج. 16 ع. 5: 321–328. DOI:10.1016/0020-1650(80)80069-9.
- ^ Zhang, Qingnan; Hu, Shu-Xian; Qu, Hui; Su, Jing; Wang, Guanjun; Lu, Jun-Bo; Chen, Mohua; Zhou, Mingfei; Li, Jun (6 Jun 2016). "Pentavalent Lanthanide Compounds: Formation and Characterization of Praseodymium(V) Oxides". Angewandte Chemie International Edition (بEnglish). 55 (24): 6896–6900. DOI:10.1002/anie.201602196. ISSN:1521-3773. PMID:27100273.
- ^ Greenwood and Earnshaw, pp. 1248–9
- ^ Greenwood and Earnshaw, pp. 1244–8
- ^ Patnaik، Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. ص. 444–446. ISBN:978-0-07-049439-8. اطلع عليه بتاريخ 2009-06-06.
- ^ Greenwood and Earnshaw, p. 1229–32
- ^ أ ب ت ث Hudson Institute of Mineralogy (1993–2018). "Mindat.org". www.mindat.org. مؤرشف من الأصل في 2019-07-25. اطلع عليه بتاريخ 2018-01-14.
- ^ Kreidl، Norbert J. (1942). "RARE EARTHS*". Journal of the American Ceramic Society. ج. 25 ع. 5: 141–143. DOI:10.1111/j.1151-2916.1942.tb14363.x.
- ^ أ ب Rare Earth Elements 101 نسخة محفوظة 2013-11-22 على موقع واي باك مشين., IAMGOLD Corporation, April 2012, pp. 5, 7. [وصلة مكسورة]
- ^ أ ب McGill، Ian (2005)، "Rare Earth Elements"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، ج. 31، ص. 183–227، DOI:10.1002/14356007.a22_607
- ^ Rokhlin، L. L. (2003). Magnesium alloys containing rare earth metals: structure and properties. CRC Press. ISBN:978-0-415-28414-1.
- ^ Suseelan Nair، K.؛ Mittal، M. C. (1988). "Rare Earths in Magnesium Alloys". Materials Science Forum. ج. 30: 89–104. DOI:10.4028/www.scientific.net/MSF.30.89.
- ^ Emsley, pp. 423–5
- ^ "ANU team stops light in quantum leap". مؤرشف من الأصل في 2012-05-31. اطلع عليه بتاريخ 2009-05-18.
- ^ Jha، A.؛ Naftaly، M.؛ Jordery، S.؛ Samson، B. N.؛ وآخرون (1995). "Design and fabrication of Pr3+-doped fluoride glass optical fibres for efficient 1.3 mu m amplifiers". Pure and Applied Optics: Journal of the European Optical Society Part A. ج. 4 ع. 4: 417. Bibcode:1995PApOp...4..417J. DOI:10.1088/0963-9659/4/4/019.
- ^ Borchert, Y.؛ Sonstrom, P.؛ Wilhelm, M.؛ Borchert, H.؛ وآخرون (2008). "Nanostructured Praseodymium Oxide: Preparation, Structure, and Catalytic Properties". Journal of Physical Chemistry C. ج. 112 ع. 8: 3054. DOI:10.1021/jp0768524.
- ^ Overland، Indra (1 مارس 2019). "The geopolitics of renewable energy: Debunking four emerging myths". Energy Research & Social Science. ج. 49: 36–40. DOI:10.1016/j.erss.2018.10.018. ISSN:2214-6296.
- ^ "Praseodymium 261173". مؤرشف من الأصل في 2018-10-02.
ببليوغرافيا
- Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements. دار نشر جامعة أكسفورد. ISBN:978-0-19-960563-7.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بEnglish) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
قراءة موسعة
- R. J. Callow, The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium, Pergamon Press, 1967.
روابط خارجية
| في كومنز صور وملفات عن: براسيوديميوم |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||





