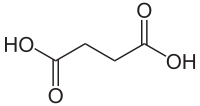
حمض السكسينيك
حمض السكسينيك (أو حمض الكهرمان أو حمض البوتانديويك وفق التسمية النظامية للمركبات العضوية) هو حمض ثنائي الكربوكسيل صيغته الكيميائية C4H6O4، والتي يمكن كتابتها على الشكل C2H4(COOH)2. يوجد المركب في الشروط القياسية على شكل بلورات عديمة اللون؛ ويطلق على أملاح واسترات هذا الحمض اسم سكسينات.
| حمض السكسينيك | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Butanedioic acid[1] |
|
| أسماء أخرى | |
Succinic acid[1] |
|
| المعرفات | |
| رقم CAS | 110-15-6 |
| الخواص | |
| الصيغة الجزيئية | C4H6O4 |
| الكتلة المولية | 118.09 غ/مول |
| المظهر | بلورات عديمة اللون |
| الكثافة | 1.56 غ/سم3 |
| نقطة الانصهار | 184 °س |
| نقطة الغليان | 235 °س |
| الذوبانية في الماء | 58 غ/ل ماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
تشتق التسمية الدارجة من اللاتينية succinum بمعنى كهرمان.
الوفرة الطبيعية والتحضير
يوجد حمض السكسينيك طبيعياً في الكهرمان، ويمكن استخلاصه منه بالتقطير، وكان يعرف تاريخياً تحت اسم روح الكهرمان.[2]
يمكن تحضير حمض السكسينيك بأساليب طبيعية بإجراء عملية تخمير من الكتلة الحيوية،[3][4] أو بأساليب صناعية عن طريق هدرجة حمض المالييك أو أنهيدريد المالييك أو حمض الفوماريك باستخدام حفازات مختلفة مثل (النيكل Ni أو النحاس Cu أو البالاديوم على كربونات الكالسيوم Pd-CaCO3).
كما يمكن أن تتم عملية التحضير أيضاً من أكسدة 4،1 - بوتانديول أو إضافة كربونيل إلى إيثيلين غليكول.[2]
الخواص
يوجد المركب في الشروط القياسية على هيئة بلورات عديمة اللون، ذات انحلالية جيدة جداً في الماء.[5]
يعطي تفاعل البلمهة (نزع الماء) مركب أنهيدريد السكسينيك (بلا ماء حمض السكسينيك).
الأهمية الحيوية
في الأوساط الحيوية يوجد حمض السكسينيك على شكل أنيون السكسينات، والذي يكون على شكل مركب وسطي استقلابي في عدد من العمليات الحيوية مثل تحلل السكر. يحول أنيون السكسينات إلى الفومارات بواسطة إنزيم نازع هيدروجين السكسينات Succinate dehydrogenase، في عملية تنتج جزيئات ATP، حيث يكون بذلك جزيء مؤشر يعكس حالة الاستقلاب الخلوي.[6][7] يتشكل أنيون السكسينات في المتقدرة الخلوية (ميتوكندريون) بواسطة دورة حمض الستريك.[8]:Section 17.4
اقرأ أيضا
المراجع
- ^ أ ب Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. ص. 747. DOI:10.1039/9781849733069-FP001. ISBN:978-0-85404-182-4.
- ^ أ ب Boy Cornils; Peter Lappe (2005), "Dicarboxylic Acids, Aliphatic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a08_523
- ^ Thakker، Chandresh؛ Martínez، Irene؛ San، Ka-Yiu؛ Bennett، George N. (7 مارس 2017). "Succinate production in Escherichia coli". Biotechnology journal. ج. 7 ع. 2: 213–224. DOI:10.1002/biot.201100061. PMC:3517001. PMID:21932253.
- ^ Otero، José Manuel؛ Cimini، Donatella؛ Patil، Kiran R.؛ Poulsen، Simon G.؛ Olsson، Lisbeth؛ Nielsen، Jens (21 يناير 2013). "Industrial Systems Biology of Saccharomyces cerevisiae Enables Novel Succinic Acid Cell Factory". PLOS ONE. ج. 8 ع. 1: e54144. DOI:10.1371/journal.pone.0054144. ISSN:1932-6203. PMC:3549990. PMID:23349810. مؤرشف من الأصل في 2018-07-20.
- ^ "Succinic Acid". Toxnet National Library of Medicine HSDB Database. 31 يناير 2005. مؤرشف من الأصل في 2018-07-20. اطلع عليه بتاريخ 2017-05-28.
- ^ Tretter، Laszlo؛ Patocs، Attila؛ Chinopoulos، Christos (1 أغسطس 2016). "Succinate, an intermediate in metabolism, signal transduction, ROS, hypoxia, and tumorigenesis". Biochimica et Biophysica Acta (BBA) - Bioenergetics. EBEC 2016: 19th European Bioenergetics Conference. ج. 1857 ع. 8: 1086–1101. DOI:10.1016/j.bbabio.2016.03.012. PMID:26971832. مؤرشف من الأصل في 2018-12-11.
- ^ Mills، Evanna؛ O'Neill، Luke A.J. (مايو 2014). "Succinate: a metabolic signal in inflammation". Trends in Cell Biology. ج. 24 ع. 5: 313–320. DOI:10.1016/j.tcb.2013.11.008. PMID:24361092. مؤرشف من الأصل في 2019-12-18.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Berg، JM؛ Tymoczko، JL؛ Stryer، L (2002). Biochemistry (ط. 5th). New York: W H Freeman. مؤرشف من الأصل في 2019-10-18.
| في كومنز صور وملفات عن: حمض السكسينيك |