قانون بويل
قانون بويل هو إحدى قوانين الغازات والتي على أساسها تم اشتقاق قانون الغازات المثالية.[1][2][3] وهو ينص على أن حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.
| قانون بويل | |
|---|---|
| تعديل مصدري - تعديل |
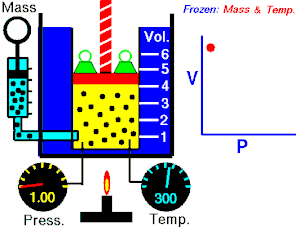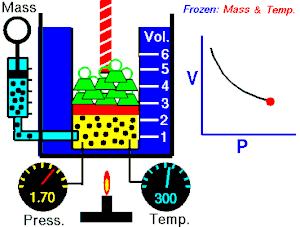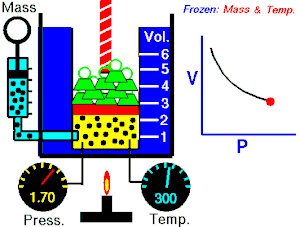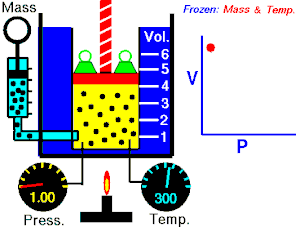
قام العالم روبرت بويل بتثبيت درجة حرارة الغاز (T) وقام بقياس تغير حجم الغاز (V) بتغير ضغطه (P)، واكتشف أن هناك علاقة تناسب عكسي بين الضغط والحجم.
بحيث يزداد حجم الغاز بنقصان الضغط الواقع عليه، ويقل حجم الغاز بزيادة الضغط الواقع عليه.
بمعنى أنه إذا زاد الضغط قل الحجم بنفس النسبة، وكلما زاد الحجم قل الضغط وذلك مع الاحتفاظ بدرجة حرارة ثابتة. تصاغ تلك العلاقة كالآتي:
- V=1/P
"عند درجة حرارة ثابتة، عندما يتغير ضغط كمية معينة من غاز يتناسب الحجم عكسيا مع تغير الضغط."
يمكن تمثيل ذلك رياضياً بالقانون:
حيث:
- P : ضغط الغاز ويقاس بعدة وحدات منها مم زئبق، أو بار ، أو باسكال ،
- V : حجم الغاز ويقاس بعدة وحدات منها لتر ، أو سنتيمتر مكعب، ديسيلتر وغيرها.
- k : ثابت
كما قام بعمل علاقة أخرى بين حجم الهواء والكثافة واكتشف ان هناك علاقه عكسيه حيث يزداد حجم الهواء كلما قلت كثافته .
اقرأ أيضا
مراجع
- ^ Draper، John William (1861). A Textbook on chemistry. ص. 46. مؤرشف من الأصل في 2019-12-17.
- ^ Gerald James Holton (2001). Physics, the Human Adventure: From Copernicus to Einstein and Beyond. Rutgers University Press. ص. 270–. ISBN:978-0-8135-2908-0. مؤرشف من الأصل في 2019-12-17.
- ^ Jap.physiology.org Online.) نسخة محفوظة 27 أكتوبر 2010 على موقع واي باك مشين.
| قانون بويل في المشاريع الشقيقة: | |