|
تضامنًا مع حق الشعب الفلسطيني |
مخلقة الغلوتامين
| ليغاز الغلوتامات—أمونيا | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
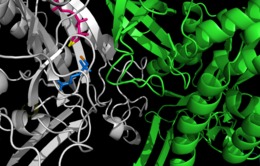 موقع نشط بين موحودَيْ مخلقة الغلوتامين من السلمونيلة التيفية. موقعا ارتباط الكاتيون بالأصفر والبرتقالي، الـADP بالوردي،و الفوسفينوثريسين بالأزرق.[1] | |||||||||||
| أرقام التعريف | |||||||||||
| رقم التصنيف الإنزيمي | 6.3.1.2 | ||||||||||
| رقم التسجيل CAS | 9023-70-5 | ||||||||||
| قواعد البيانات | |||||||||||
| قاعدة بيانات الإنزيم | راجع IntEnz | ||||||||||
| قاعدة بيانات براونشفايغ | راجع BRENDA | ||||||||||
| إكسباسي | راجع NiceZyme | ||||||||||
| موسوعة كيوتو | راجع KEGG | ||||||||||
| ميتاسيك | المسار الأيضي | ||||||||||
| بريام | ملف التعريف | ||||||||||
| تركيب بنك بيانات البروتين | RCSB PDB PDBe PDBsum | ||||||||||
| الأونتولوجيا الجينية | AmiGO / EGO | ||||||||||
| |||||||||||
مخلِّقة الغلوتامين (بالإنجليزية: Glutamine synthetase) (GS) ( ر.ت.إ 6.3.1.2 )[2] هو إنزيم يلعب دورا أساسيا في أيض النيتروجين بتحفيز تكثيف الغلوتامات والأمونيا لتشكيل الجلوتامين:
غلوتامات + ATP + NH3 ← جلوتامين + ADP + فوسفات

تستخدم مخلقة الغلوتامين الأمونيا المنتَجَة بواسطة اختزال النترات، تحلل الحمض الأميني والتنفس الضوئي.[3] مجموعة الأميد في الغلوتامات هي مصدر للنيتروجين في المسار الأيضي لمستقلب الغلوتامين.[4]
يمكن أن تحدث تفاعلات أخرى عبر مخلقة الغلوتامين. المنافسة بين أيون الأمونيوم والماء، ألفة ارتباطهما وتركيز أيون الأمونيوم عوامل تؤثر في تخليق الغلوتامين وحلمأته. يتشكل الغلوتامين إذا هاجم أيون أمونيوم وسيط أسيل-فوسفات، أو حين تتم إعادة تكوين الغلوتامات إذا هاجم الماء الوسيط.[5][6] يرتبط أيون الأمونيوم بشكل أقوى من الماء مع مخلقة الغلوتامين بسبب القوى الإلكتروساتية بين كاتيونٍ وجيب ارتباط سالب الشحنة.[3] تفاعل آخر محتمل تقوم به مخلقة الغلوتامين هو عند ارتباط NH2OH بها بدل NH4+ وينتج γ-غلوتاميل هيدروكسيمات.[5][6]
البنية
مراجع
- ^ ببب: 1FPY; Gill HS، Eisenberg D (فبراير 2001). "The crystal structure of phosphinothricin in the active site of glutamine synthetase illuminates the mechanism of enzymatic inhibition". Biochemistry. ج. 40 ع. 7: 1903–12. DOI:10.1021/bi002438h. PMID:11329256.
- ^ Eisenberg D، Almassy RJ، Janson CA، Chapman MS، Suh SW، Cascio D، Smith WW (1987). "Some evolutionary relationships of the primary biological catalysts glutamine synthetase and RuBisCO". Cold Spring Harb. Symp. Quant. Biol. ج. 52: 483–90. DOI:10.1101/sqb.1987.052.01.055. PMID:2900091.
- ^ أ ب Liaw SH، Kuo I، Eisenberg D (نوفمبر 1995). "Discovery of the ammonium substrate site on glutamine synthetase, a third cation binding site". Protein Sci. ج. 4 ع. 11: 2358–65. DOI:10.1002/pro.5560041114. PMC:2143006. PMID:8563633.
- ^ Liaw SH، Pan C، Eisenberg D (يونيو 1993). "Feedback inhibition of fully unadenylylated glutamine synthetase from Salmonella typhimurium by glycine, alanine, and serine". Proc. Natl. Acad. Sci. USA. ج. 90 ع. 11: 4996–5000. DOI:10.1073/pnas.90.11.4996. PMC:46640. PMID:8099447.
- ^ أ ب Eisenberg D، Gill HS، Pfluegl GM، Rotstein SH (مارس 2000). "Structure-function relationships of glutamine synthetases". Biochim Biophys Acta. ج. 1477 ع. 1–2: 122–45. DOI:10.1016/S0167-4838(99)00270-8. PMID:10708854.
- ^ أ ب Liaw SH، Eisenberg D (يناير 1994). "Structural model for the reaction mechanism of glutamine synthetase, based on five crystal structures of enzyme-substrate complexes". Biochemistry. ج. 33 ع. 3: 675–81. DOI:10.1021/bi00169a007. PMID:7904828.