|
تضامنًا مع حق الشعب الفلسطيني |
تقشر الأنسجة المتموتة البشروية التسممي
| تقشر الأنسجة المتموتة البشروية التسممي | |
|---|---|
| تعديل مصدري - تعديل |
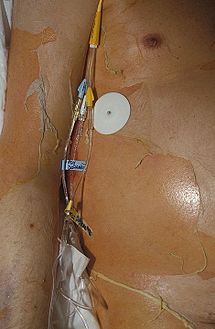
تَقَشُّرُ الأَنْسِجَةِ المُتَمَوِّتَةِ البَشْرَوِيَّةِ التَّسَمُّمِيّ بالإنجليزية: Toxic epidermal necrolysis تُختصر (TEN) أو متلازمة ليل Lyell's syndrome[1]
حالة جلدية نادرة ومهددة للحياة تحدث غالباً نتيجة تفاعل ضد عقارٍ ما.[2] يتسبب المرض في انفصال الطبقة الخارحية للجلد (البشرة) عن طبقة الأدمة التي تحتها، في جميع أنحاء الجسم، مما يترك الجسم عرضةً للالتهابات الحادة. تتراوح نسبة حالات الوفيات بين 25 إلى 30٪، وعادة ما تحدث الوفاة نتيجة لتعفن الدم وفشل الأعضاء المتعدد الذي يحدث لاحقاً. ينطوي العلاج في المقام الأول على التوقف عن استخدام العوامل المسببة، والرعاية الداعمة إما في وحدة العناية المركزة أو وحدة الحروق في المستشفى.[3][4]
تتراوح نسبة حدوث تقشر الأنسجة المتموّتة البشرَوية التسممي بين 0.4 ل 1.9 حالة لكل مليون من كل عام.[5] تقشر الأنسجة المتموّتة البشرَوية التسممي (TEN) يحدث على سلسلة وثيقة مع متلازمة ستيفنس جونسون (SJS). تعرف الحالة ب (TEN) إذا كان أكثر من 30% من مساحة سطح الجسم متأثراً. وتعرف ب (SJS) إذا كان أقل من 10٪ من مساحة سطح الجسم مُصاباً. إذا كانت النسبة المتأثرة من سطح الجسم بين 10 ل 30%، في تلك الحالة يُطلق عليها "SJS/TEN."[6][7] على الرغم من أن هناك نقاش في البداية حول ما إذا كان (TEN) و (SJS) يقعان في نفس طيف الأمراض التي تشمل الحمامي متعددة الأشكال، إلا أنها الآن تعتبر حالات منفصلة.[5][8][9]
العلامات والأعراض

البادرة
غالبا ما يكون لدى الناس بوادر تشبه الإنفلونزا، مع سعال، سيلان الأنف، حمى، انخفاض الشهية والشعور بالضيق. كما أنه يوجد تاريخ تناول دواءٍ ما خلال 14 يومًا تقريبًا (مابين أسابيع) قبل ظهور الأعراض، ولكن العلامات قد تظهر في غضون يومين إذا كان هناك تعرّض للدواء المسبب مرة أخرى.
علامات الجلد
العلامات الأولية التي تظهر على الجلد تكون عبارة عن بقع مسطحة، حمراء أرجوانية وداكنة تبدأ على جذع الجسم ثم تنتشر. قد تتحول تلك البقع إلى نُفَط كبيرة. بعد ذلك يصبح الجلد المتضرر نخريّ أو يتدلى من الجسم ثم ينفصل ويتقشر في صورة مساحات كبيرة.[3]
علامات الغشاء المخاطي
تقريباً كل المرضى بتقشر الأنسجة المتموتة البشروية التسممي لديهم اكتناف فمي، عيني وتناسلي. قد تظهر قشور وتقرحات مؤلمة على أي سطح مخاطي.[10] يصبح الفم مليئاً بالبثور ومتآكلاً مما يجعل من تناول الطعام أمراً صعباً وقد يتطلب التغذية من خلال أنبوب أنفي معدي عن طريق الأنف أو أنبوب مَعدِيّ عن طريق الفم. يمكن أن تصبح العينان منتفخة وقشرية ومتقرحة، مما يؤدي إلى العمى المحتمل. التهاب الملتحمة الحاد هو أكثر المشاكل التي تصيب العينين شيوعاً.[11]
الأسباب
وُجد أن نحو 80-95٪ من حالات تقشر الأنسجة المتموتة البشروية التسممي يكون سببها ردة فعل أو تفاعل ضد عقارٍ ما.[5]
الأدوية الأكثر تورطاً في حدوث (TEN):
- المضادات الحيوية
- سلفوناميد (السلفابيريدين، سلفاميثوكسازول)
- مضادات بيتا-لاكتام (سيفالوسبورينات، بنسلين، كاربابينيم)
- مضادات الالتهاب اللاستيرويدية
- الألوبورينول
- مضاد المستقلب (ميثوتركسيت)
- مضادات الفيروسات القهقري
- الكورتيكوستيرويد
- مضادات القلق
- مضادات الصرع (فينوباربيتال، فينيتوين، كاربامازيبين، وحمض الفالبرويك).[2]
وجد أن تقشر الأنسجة قد يحدث نتيجة الإصابة بفيروس الضنك والمفطورة الرئوية.
فيروس نقص المناعة البشري المكتسب
الأشخاص المصابون بفيروس نقص المناعة البشري المكتسب عُرضة للإصابة بتقشر الأنسجة المتموتة البشروية التسممي أكثر 1000 مرة مقارنةً ببقية الناس. السبب وراء ذلك مازال غير واضح.[3]
الوراثة
توجد عوامل وراثية مرتبطة بزيادة خطر الإصابة بتقشر الأنسجة المتموتة البشروية التسممي. على سبيل المثال بعض الأنواع من مستضدات الكريات البيضاء البشرية مثل HLA-B*1502,[12] HLA-A*3101,[13] and HLA-B*5801,[14] وُجد ارتباطهم بحدوث المرض إذا تم التعرض لأنواع معينة من الأدوية.
نشأة المرض
الدور الذي يؤدّيه الجهاز المناعي في نشأة تقشر الأنسجة المتموتة البشروية التسممي مازال غير واضح إلى الآن. يتضح أنّ أنواعًا معيّنة من الخلايا المناعية كخلية تي قاتلة مسؤولة بشكل رئيسي عن موت الخلايا الكيراتينية وما يتبعه من انفصال الجلد. ومن الفرضيّات أن الخلايا المناعية CD8 + تصبح أكثر نشاطًا عن طريق التحفيز من الأدوية أو نواتج أيضها. ثم تُنتج تلك الخلايا بعض المواد التي تؤدي لموت الخلايا الكيراتينية مثل
التشخيص
الهستولوجيا
التشخيص النهائي للمرض غالبا ما يتطلب تأكيدا بأخذ خزعة من الجلد.
التشخيص التفريقي
- متلازمة الجلد المسموط العنقودية
- احمرار الجلد
- داءُ الطُّعْمِ حِيَالَ الثَّوِيّ graft versus host disease
- بُثَارُ طَفَحِيّ حاد مُتَعَمِّم acute generalized exanthematous pustulosis
العلاج
العلاج الرئيسي ل تقشر الأنسجة المتموتة البشروية التسممي هو إيقاف العامل (العوامل) المسببة، الإحالة المبكرة والمعالجة في وحدات الحروق أو وحدات العناية المركزة، العلاج الداعم، والدعم التغذوي.[3]
توقعات سير المرض
نسبة الوفاة من تقشر الأنسجة المتموتة البشروية التسممي تتراوح بين 25-30%. فقدان الجلد يترك المريض عرضةً عرضة للعدوى من الفطريات والبكتيريا، الأمر الذي يؤدي إلى تعفّن الدم (إنتان الدم)، السبب الرئيسي للوفاة بالمرض. سبب الوفاة يكون إمّا من العدوى أو من الضائقة التنفسية والتي قد تكون بسبب الالتهاب الرئوي أو تلف بطانات المجرى الهوائي. التحليل المجهري للأنسجة يلعب دوراً في تحديد سير المرض في الحالات الفردية.
مقياس الخطورة
درجة خطورة المرض لتقشر الأنسجة المتموتة البشروية التسممي "Severity of Illness Score for Toxic Epidermal Necrolysis" تختصر (SCORTEN) هو نظام قياس تم تطويره لتقييم شدة المرض والتنبؤ بالوفيات في المرضى المصابين بتقشر الأنسجة المتموتة البشروية التسممي الحاد.
يتم إعطاء درجة واحدة لكل من العوامل الآتية:
- العمر> 40
- معدل ضربات القلب أكثر من 120 نبضة / دقيقة
- تم تشخيص المريض بالسرطان
- نسبة انفصال البشرة أكثر من عشرة في المئة من مساحة سطح الجسم في يوم الأول.
- نيتروجين يوريا الدم >28 mg/dL
- الجلوكوز >252 mg/dL
- البيكربونات <20mEq/L
التقييم
من 0 إلى 1 - نسبة الوفاة 3.2٪
2 – نسبة الوفاة 12.2٪
3 - نسبة الوفاة 35.3٪
4 - نسبة الوفاة 58.3٪
≥5 - نسبة الوفاة 90٪
يكون هذا النظام ذا أهمية كبرى في اليوم الأول والثالث من إدخال المريض إلى المستشفى، وقد يقدّر معدل الوفيات بقيمة أقل في المرضى الذين يعانون من أعراض تنفُسيَّة.
المضاعفات طويلة الأجل
الناجون من المرحلة الحادة من تقشر الأنسجة المتموتة البشروية التساممي يعانون من مضاعفات طويلة المدى تصيب الجلد والعينين. تشمل الأعراض الجلدية التندّب، شامات طفحية، تضيّق فرجي مهبلي وعسر الجماع. المضاعفات الأكثر شيوعاً تصيب العين، بنسبة تصل إلى حوالي 20-79% من المصابين بالمرض. وتشمل الأعراض:رهاب الضوء، التهاب القرنية والملتحمة الجاف أو جفاف العينين، تندّب القرنية أو جفافها، تليّف تحت الملتحمة، انحراف الأهداب، انخفاض في حدة الإبصار والعمى.
المراجع
- ^ Rapini, Ronald P.؛ Bolognia, Jean L.؛ Jorizzo, Joseph L. (2007). Dermatology: 2-Volume Set. St. Louis: Mosby. ISBN:1-4160-2999-0.
- ^ أ ب Garra, GP (2007). "Toxic Epidermal Necrolysis". Emedicine.com. Retrieved on December 13, 2007. نسخة محفوظة 01 ديسمبر 2008 على موقع واي باك مشين.
- ^ أ ب ت ث Schwartz، RA؛ McDonough، PH؛ Lee، BW (أغسطس 2013). "Toxic epidermal necrolysis: Part II. Prognosis, sequelae, diagnosis, differential diagnosis, prevention, and treatment". Journal of the American Academy of Dermatology. ج. 69 ع. 2: 187.e1-16, quiz 203–4. DOI:10.1016/j.jaad.2013.05.002. PMID:23866879.
- ^ Research Directions in Genetically-Mediated Stevens-Johnson Syndrome/Toxic Epidermal Necrolysis - National Human Genome Research Institute (NHGRI) نسخة محفوظة 10 أغسطس 2017 على موقع واي باك مشين.
- ^ أ ب ت Schwartz، RA؛ McDonough، PH؛ Lee، BW (أغسطس 2013). "Toxic epidermal necrolysis: Part I. Introduction, history, classification, clinical features, systemic manifestations, etiology, and immunopathogenesis". Journal of the American Academy of Dermatology. ج. 69 ع. 2: 173.e1-13, quiz 185–6. DOI:10.1016/j.jaad.2013.05.003. PMID:23866878.
- ^ Nirken، Milton. "Stevens-Johnson syndrome and toxic epidermal necrolysis: Pathogenesis, clinical manifestations, and diagnosis". UpToDate. Wolters Kluwer. مؤرشف من الأصل في 2018-05-04. اطلع عليه بتاريخ 2014-11-21.
- ^ Bastuji-Garin، S؛ Rzany، B؛ Stern، RS؛ Shear، NH؛ Naldi، L؛ Roujeau، JC (يناير 1993). "Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme". Archives of dermatology. ج. 129 ع. 1: 92–6. DOI:10.1001/archderm.129.1.92. PMID:8420497.
- ^ Carrozzo M، Togliatto M، Gandolfo S (1999). "Erythema multiforme. A heterogeneous pathologic phenotype". Minerva Stomatol. ج. 48 ع. 5: 217–26. PMID:10434539.
- ^ Farthing P، Bagan J، Scully C (2005). "Mucosal disease series. Number IV. Erythema multiforme". Oral Dis. ج. 11 ع. 5: 261–7. DOI:10.1111/j.1601-0825.2005.01141.x. PMID:16120111.
- ^ Roujeau، JC؛ Stern، RS (10 نوفمبر 1994). "Severe adverse cutaneous reactions to drugs". The New England Journal of Medicine. ج. 331 ع. 19: 1272–85. DOI:10.1056/nejm199411103311906. PMID:7794310.
- ^ Morales، ME؛ Purdue، GF؛ Verity، SM؛ Arnoldo، BD؛ Blomquist، PH (أكتوبر 2010). "Ophthalmic Manifestations of Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis and Relation to SCORTEN". American journal of ophthalmology. ج. 150 ع. 4: 505–510.e1. DOI:10.1016/j.ajo.2010.04.026. PMID:20619392.
- ^ Hung، SI؛ Chung، WH؛ Jee، SH؛ Chen، WC؛ Chang، YT؛ Lee، WR؛ Hu، SL؛ Wu، MT؛ Chen، GS؛ Wong، TW؛ Hsiao، PF؛ Chen، WH؛ Shih، HY؛ Fang، WH؛ Wei، CY؛ Lou، YH؛ Huang، YL؛ Lin، JJ؛ Chen، YT (أبريل 2006). "Genetic susceptibility to carbamazepine-induced cutaneous adverse drug reactions". Pharmacogenetics and genomics. ج. 16 ع. 4: 297–306. DOI:10.1097/01.fpc.0000199500.46842.4a. PMID:16538176.
- ^ McCormack، M؛ Alfirevic، A؛ Bourgeois، S؛ Farrell، JJ؛ Kasperavičiūtė، D؛ Carrington، M؛ Sills، GJ؛ Marson، T؛ Jia، X؛ de Bakker، PI؛ Chinthapalli، K؛ Molokhia، M؛ Johnson، MR؛ O'Connor، GD؛ Chaila، E؛ Alhusaini، S؛ Shianna، KV؛ Radtke، RA؛ Heinzen، EL؛ Walley، N؛ Pandolfo، M؛ Pichler، W؛ Park، BK؛ Depondt، C؛ Sisodiya، SM؛ Goldstein، DB؛ Deloukas، P؛ Delanty، N؛ Cavalleri، GL؛ Pirmohamed، M (24 مارس 2011). "HLA-A*3101 and carbamazepine-induced hypersensitivity reactions in Europeans". The New England Journal of Medicine. ج. 364 ع. 12: 1134–43. DOI:10.1056/nejmoa1013297. PMID:21428769.
- ^ Tohkin، M؛ Kaniwa، N؛ Saito، Y؛ Sugiyama، E؛ Kurose، K؛ Nishikawa، J؛ Hasegawa، R؛ Aihara، M؛ Matsunaga، K؛ Abe، M؛ Furuya، H؛ Takahashi، Y؛ Ikeda، H؛ Muramatsu، M؛ Ueta، M؛ Sotozono، C؛ Kinoshita، S؛ Ikezawa، Z؛ Japan Pharmacogenomics Data Science، Consortium (فبراير 2013). "A whole-genome association study of major determinants for allopurinol-related Stevens-Johnson syndrome and toxic epidermal necrolysis in Japanese patients". The pharmacogenomics journal. ج. 13 ع. 1: 60–9. DOI:10.1038/tpj.2011.41. PMID:21912425.
| في كومنز صور وملفات عن: تقشر الأنسجة المتموتة البشروية التسممي |