|
تضامنًا مع حق الشعب الفلسطيني |
نتريد الليثيوم
اذهب إلى التنقل
اذهب إلى البحث
| نتريد الليثيوم | |
|---|---|
| الاسم النظامي (IUPAC) | |
نتريد الليثيوم |
|
| المعرفات | |
| رقم CAS | 26134-62-3 |
| بوب كيم (PubChem) | 520242 |
| الخواص | |
| الصيغة الجزيئية | Li3N |
| الكتلة المولية | 34.83 غ/مول |
| المظهر | بلورات حمراء بنية |
| الكثافة | 1.38 غ/سم3 |
| نقطة الانصهار | 845 °س |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
نتريد الليثيوم مركب كيميائي له الصيغة Li3N، ويكون على شكل بلورات حمراء بنية. وهو النتريد الثابت الوحيد من بين نتريدات الفلزات القلوية.
التحضير
يحضر نتريد الليثيوم من تفاعل العنصرين المكونين للمركب، وذلك بتسخين الليثيوم في جو من غاز النيتروجين.[2]
أو بمفاعلة غاز النيتروجين مع الليثيوم المنحل في مصهور الصوديوم.[3] وتعطي الطريقة الأخيرة ناتجاً له نقاوة جيدة.
الخواص
- نتريد الليثيوم مركب ثابت عند التعرض للرطوبة والهواء [4] وهو ناقل أيوني جيد.[5] ويكون لأيون النتريد قاعدية قوية، وذلك بشكل أكبر حتى من الهدريد، حيث يتفاعل نتريد الليثيوم مع الهيدروجين مشكلا أميد الليثيوم حسب المعادلة:
- يتفاعل نتريد الليثيوم عند التماس مع الماء بتفاعل حلمهة مشكلا هيدروكسيد الليثيوم والأمونياك [2] حسب المعادلة:
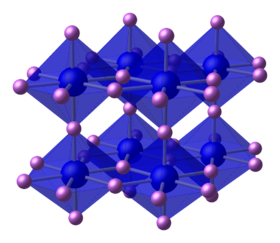
البنية
تشكل ذرات الليثيوم حلقات سداسية مشابهة للغرافيت تتوضع ذرات النيتروجين في منتصفها، أي أن كل ذرة نيتروجين يحيط بها ثمانية ذرات ليثيوم على شكل هرم سداسي مضاعف.[2][6]

الاستخدامات
- يستخدم نتريد الليثيوم في علم الفلزات من أجل إدخال النيتروجين في السبائك.[7]
- تجرى أبحاث حالياً للكشف عن مدى مقدرة نتريد الليثيوم على تخزين الهيدروجين، وهو أمر مهم بالنسبة لخلايا الوقود حيث أن المركب يتفاعل مع الهيدروجين، ويمكن أن يتخلى عنه عند درجات حرارة أعلى من 270°س. لقد تم التمكن من تخزين 11.5% وزناً من غاز الهيدروجين.[8]
مراجع
- ^ Lithium nitride −80 mesh, ≥99.5% | Sigma-Aldrich نسخة محفوظة 22 سبتمبر 2020 على موقع واي باك مشين.
- ^ أ ب ت A. F. Holleman, E. Wiberg, N. Wiberg, Lehrbuch der Anorganischen Chemie 1995, 101. Auflage, de Gruyter. ISBN 3-11-012641-9, S. 1153.
- ^ Barker M.G., Blake A.J, Edwards P.P., Gregory D.H., Hamor T. A., Siddons D. J., Smith S. E. (1999). "Novel layered lithium nitridonickelates; effect of Li vacancy concentration on N co-ordination geometry and Ni oxidation state". Chem. Commun.: 1187–1188. DOI:10.1039/a902962a.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ بيانات نتريد الليثيوم في صفحة Chemetalllithium.com نسخة محفوظة 10 مارس 2016 على موقع واي باك مشين.
- ^ "Definition: Superionenleiter - Meyers Lexikon online". web.archive.org. مؤرشف من الأصل في 2020-09-22. اطلع عليه بتاريخ 2009-04-02.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Struktur von Li3N نسخة محفوظة 19 يوليو 2012 على موقع واي باك مشين.
- ^ D. L. Perry, S. L. Phillips: Handbook of Inorganic Compounds: An Electronic Database. CRC Press, 1995, ISBN 978-0-8493-8671-8, S. 228
- ^ Ping Chen, Zhitao Xiong, Jizhong Luo, Jianyi Lin and Kuang Lee Tan (2002). "Interaction of hydrogen with metal nitrides and imides". Nature. ج. 420: 302–304. DOI:10.1038/nature01210.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link)
| نتريد الليثيوم في المشاريع الشقيقة: | |