|
تضامنًا مع حق الشعب الفلسطيني |
منظم مستقبل غابا-أ الإيجابي التفاغري
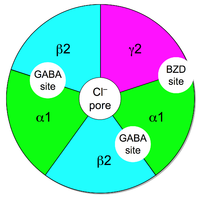
في علم الأدوية، منظمات مستقبل غابا-أ الإيجابية التفاغرية هي جزيئات مُنظِّمة إيجابية تفاغرية تزيد نشاط بروتين مستقبل غابا-أ في الجهاز العصبي المركزي للفقاريات.
غابا هو ناقل عصبي مُثبِّط رئيسي في الجهاز العصبي المركزي. يحرض ارتباطه بمستقبل غابا-أ على فتح قناة الكلوريد للسماح بدخول أيونات الكلوريد إلى الخلية العصبية ما يجعل هذه الخلية مفرطة الاستقطاب وبالتالي أقل احتمالًا للتنبيه. تزيد منظمات مستقبل غابا-أ الإيجابية التفاغرية تأثير غابا من خلال فتح القناة بتواتر أكبر أو لفترات أطول. على أي حال، لا يكون لها أي تأثيرات إذا لم يكن غابا أو أي شاد آخر موجودًا.
بعكس شادات مستقبل غابا-أ، لا ترتبط منظمات مستقبل غابا-أ الإيجابية التفاغرية بنفس الموقع الفعال الذي ترتبط به جزيئة الناقل العصبي حمض الغاما أمينو-بيوتيريك بل تؤثر على المستقبل من خلال الارتباط بموقع مختلف على سطح البروتين. يدعى ذلك بالتنظيم التفاغري.
في علم النفس الدوائي، تُستخدَم منظمات مستقبل غابا-أ الإيجابية التفاغرية كأدوية يكون لها بشكل أساسي تأثيرات مهدئة ومضادة للقلق. تشمل الأمثلة على منظمات مستقبل غابا-أ الإيجابية التفاغرية: الكحول (الإيتانول)، والبنزوديازيبينات مثل ديازيبام (فاليوم) وألبرازيبام (كزانتاكس)، والأدوية Z مثل زولبيديم (أمبين)، وأدوية الباربيتورات.
التاريخ
لقد كانت مستقبلات غابا-أ تاريخيًا هدفًا لأبحاث العلاج الدوائي. كانت المركبات الأقدم عبارة عن أيونات مثل البروميد.
الباربيتورات
في 1903، صُنِّع أول مشتق فعال نفسيًا لحمض الباربيتورات، وسُوِّق له من أجل علاج الصداع. خلال 30 يوم، طُوِّرت باربيتورات أخرى عديدة، ووُجِد أنها تُستخدَم كمهدئات، ومساعدات على النوم، ومخدرات عامة. رغم أن الباربيتورات قد فقدت شعبيتها إلا أنها لا تزال تُستخدَم كأدوية مخدرة قصيرة الأمد ومضادات للاختلاج.
البنزوديازيبينات
اكتشِفت البنزوديازيبينات عام 1955، وحلت محل الباربيتورات على نطاق واسع لأن مؤشرها العلاجي أكبر. في البداية، اعتبِرت البنزوديازيبينات مهدئات أعصاب آمنة وفعالة، لكنها انتقِدت بعد ذلك بسبب تأثيراتها المُحدِثة للاعتماد. تعطي عدة بنزوديازيبينات فعالة خيارات حول الشكل الصيدلاني المعادل للجرعة (وحدة الجرعات)، وطول مدة العمل، والتداخل الاستقلابي، والأمان.[1][1]
تعمل البنزوديازيبينات من خلال الارتباط بموقع البنزوديازيبين الموجود على سطح معظم، وليس جميع، مستقبلات غابا-أ. يكون تنظيم غابا-أ من خلال شادات موقع البنزوديازيبين محددًا لذاته. لا يكون توصيل القناة أكبر في حال وجود كل من البنزوديازيبين وغابا من توصيلها في حال وجود تراكيز عالية من غابا فقط. بالإضافة إلى ذلك، فإنه في غياب غابا، لا يؤدي وجود البنزوديازيبين لوحده إلى فتح قناة الكلوريد.
إن بعض مستقلبات البروجسترون والديوكسي كورتيكوستيرون هي منظمات تفاغرية فعالة وانتقائية لمستقبل حمض الغاما أمينو-بيوتيريك نمط أ. أثبت هانس سيلي عام 1940 أن بعض ستيرويدات البريغنان قد تحدث كلًا من التخدير والتهدئة، لكن بعد 40 عام ظهرت الآلية الجزيئية لتفسر تأثيرها المسبب للاكتئاب.[2]
في شريحة دماغ الفئران، عزز الستيرويد الصنعي ألفاكسالون كلًا من تثبيط المنبهات المُحفِّزة وتأثيرات موسيمول المُعطَى من مصدر خارجي، وهو شاد انتقائي لغابا-أ.
التطبيقات
الباربيتورات
لم تُحدَّد مواقع عمل الباربيتورات بدقة حتى الآن. يبدو أن الإطارين الثاني والثالث العابرين للغشاء من تحت الوحدة بيتا مهمين، قد يشمل الارتباط جيبًا تشكله تحت الوحدة بيتا ميثيونين 286، بالإضافة إلى تحت الوحدة ألفا ميثيونين 236.[3]
الأرق
قُدِّمت الباربيتورات في البداية كمنوم لدى المرضى المصابين بالفصام. إنها تحرض حالة من النوم العميق والمطوّل. لكن ذلك لم يُستخدَم مدة طويلة بسبب تأثيراتها الجانبية السلبية.[4]
مضاد اختلاج
كان فينوباربيتال أول دواء فعال حقًا ضد الصرع. اكتشِف بالصدفة عندما أعطِي لمرضى الصرع لمساعدتهم على النوم. كانت التأثيرات الجانبية الإيجابية عبارة عن خصائص مضادة للاختلاج تؤدي إلى نقص عدد النوبات وشدتها.
تهدئة
يُستخدَم الباربيتورات كمسكن للألم عندما لا يكون هناك حاجة للتخدير. يُستخدَم غالبًا في التصوير المقطعي المحوسب عندما تكون هناك حاجة للتهدئة. إنه فعال، وآمن، ووقت التعافي منه قصير. في 2013، لا يزال الدوائين الباربيتوريين فينوباربيتال وبوتاباربيتال يستخدمان كمهدئين في حالات معينة، بالإضافة إلى معاكسة تأثيرات أدوية مثل إفريدين وثيوفيلين. يُستخدَم الفينوباربيتال في حالات متلازمة سحب دواء ما. يُستخدَم كعلاج عادي وإسعافي في بعض حالات الصرع.[5]
المراجع
- ^ أ ب López-Muñoz F، Ucha-Udabe R، Alamo C (ديسمبر 2005). "The history of barbiturates a century after their clinical introduction". Neuropsychiatric Disease and Treatment. ج. 1 ع. 4: 329–43. PMC:2424120. PMID:18568113.
- ^ Lambert JJ، Belelli D، Peden DR، Vardy AW، Peters JA (سبتمبر 2003). "Neurosteroid modulation of GABAA receptors". Progress in Neurobiology. ج. 71 ع. 1: 67–80. DOI:10.1016/j.pneurobio.2003.09.001. PMID:14611869.
- ^ Egawa K، Fukuda A (2013). "Pathophysiological power of improper tonic GABA(A) conductances in mature and immature models". Frontiers in Neural Circuits. ج. 7: 170. DOI:10.3389/fncir.2013.00170. PMC:3807051. PMID:24167475.
- ^ Hosie AM، Wilkins ME، Smart TG (أكتوبر 2007). "Neurosteroid binding sites on GABA(A) receptors". Pharmacology & Therapeutics. ج. 116 ع. 1: 7–19. DOI:10.1016/j.pharmthera.2007.03.011. PMID:17560657.
- ^ Perrais D، Ropert N (يناير 1999). "Effect of zolpidem on miniature IPSCs and occupancy of postsynaptic GABAA receptors in central synapses". The Journal of Neuroscience. ج. 19 ع. 2: 578–88. DOI:10.1523/JNEUROSCI.19-02-00578.1999. PMC:6782193. PMID:9880578.
| منظم مستقبل غابا-أ الإيجابي التفاغري في المشاريع الشقيقة: | |