|
تضامنًا مع حق الشعب الفلسطيني |
منتسخة عكسية
| Reverse transcriptase (RNA-dependent DNA polymerase) | |
|---|---|
| |
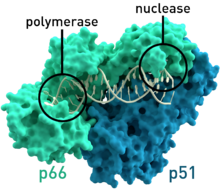
| البنية التخطيطية البلورية لإنزيم النسخ العكسي لفيروس فيروس العوز المناعي البشري-1 حيث أن الوحدتين الفرعيتين p51 و p66 تظهران ملونتين ويظهر الموقع النشط لكل من إنزيم النسخ وإنزيم النيوكلييز بشكل بارز.[1] | |
| معرف | |
| رمز | RVT_1 |
| قاعدة بيانات عوائل البروتينات | PF00078 |
| قاعدة بيانات عوائل البروتينات clan | CL0027 |
| إنتربرو | IPR000477 |
| بروسايت | PS50878 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1hmv |
إنزيم النسخ العكسي أو المنتسخة العكسية (بالإنجليزية: Reverse transcriptase or RT) هو إنزيم يستخدم لتوليد الحمض النووي التكميلي (cDNA) من قالب الحمض النووي الريبي، وهي عملية تسمى النسخ العكسي. يستخدم النسخ العكسية بواسطة فيروسات مثل فيروس نقص المناعة البشرية والتهاب الكبد B لتكرار جينوماتها، عن طريق العناصر الوراثية المتنقلة التي تنتقل عبر جينوم المضيف، وعن طريق الخلايا حقيقية النواة لتمديد التيلوميرات في نهايات كروموسوماتها الخطية. خلافًا للاعتقاد السائد، لا تنتهك العملية تدفق المعلومات الجينية كما هو موصوف في العقيدة المركزية الكلاسيكية، حيث من الممكن صراحة نقل المعلومات من الحمض النووي الريبي إلى الحمض النووي.
يحتوي إنزيم النسخ العكسي على ثلاثة أنشطة كيميائية حيوية متتابعة: نشاط بوليميريز DNA المعتمد على الحمض النووي الريبي، وريبونوكلياز H RNase H، ونشاط بوليميراز الحمض النووي. بشكل جماعي، تمكن هذه الأنشطة الإنزيم من تحويل الحمض النووي الريبي أحادي الجديلة إلى (كدنا) مزدوج الشريطة. في الفيروسات القهقرية واللينقولات العكسية، يمكن أن يندمج هذا الحمض النووي (cDNA) في جينوم المضيف، والذي يمكن من خلاله عمل نسخ جديدة من الحمض النووي الريبي عبر نسخ الخلايا المضيفة. يستخدم نفس تسلسل التفاعلات على نطاق واسع في المختبر لتحويل الحمض النووي الريبي إلى الحمض النووي لاستخدامه في الاستنساخ الجزيئي أو تسلسل الحمض النووي الريبي أو تفاعل البوليميراز المتسلسل (PCR) أو تحليل الجينوم.
تاريخيًا
اكتشف النسخ العكسية من قبل هوارد تيمين في جامعة ويسكونسن-ماديسون في ساركوما روس وعزلها ديفيد بالتيمور بشكل مستقل في عام 1970 في معهد ماساتشوستس للتكنولوجيا من اثنين من فيروسات ورم الحمض النووي الريبي: فيروس سرطان الدم الفئران وفيروس ساركوما روس مرة أخرى.[2][3] لإنجازاتهم، تقاسموا جائزة نوبل في علم وظائف الأعضاء أو الطب لعام 1975 (مع ريناتو دولبيكو).
تشمل النسخ العكسية المدروسة جيدًا ما يلي:
- تحتوي النسخة العكسية للنسخة العكسية لفيروس HIV-1 من النوع الأول من فيروس نقص المناعة البشرية (PDB: 1HMV) على وحدتين فرعيتين، والتي لها أوزان جزيئية خاصة بها تبلغ 66 و 51 كيلو دالتون.[4]
- إن إنزيم النسخ العكسي M-MLV من فيروس ابيضاض الدم في الفئران مولوني هو مونومر واحد 75 كيلو دالتون.[5]
- يحتوي النسخ العكسي لـ AMV من فيروس داء الأرومة النقوية للطيور أيضًا على وحدتين فرعيتين، وحدة فرعية 63 كيلو دالتون ووحدة فرعية 95 كيلو دالتون.
- إنزيم النسخ العكسي للتيلوميراز الذي يحافظ على تيلوميرات الكروموسومات حقيقية النواة.[6]
الوظيفة في الفيروسات
ترمز الإنزيمات واستخدامها من قبل الفيروسات التي تستخدم النسخ العكسي كخطوة في عملية النسخ المتماثل. تستخدم فيروسات الحمض النووي الريبي النسخ العكسي، مثل الفيروسات القهقرية، الإنزيم لعكس نسخ جينومات الحمض النووي الريبي الخاصة بها إلى الحمض النووي، والتي تدمج بعد ذلك في جينوم المضيف وتكرر معه. يمكن لفيروسات DNA النسخ العكسي كفيروسات الكبد مثلًا، أن تسمح لـ RNA بالعمل كقالب في تجميع وصنع خيوط الحمض النووي. يصيب فيروس نقص المناعة البشرية البشر باستخدام هذا الإنزيم. بدون النسخ العكسي، لن يكون الجينوم الفيروسي قادرًا على الاندماج في الخلية المضيفة، ما يؤدي إلى فشل التكاثر.
عملية النسخ العكسي أو المنتسخة العكسية
يُنشئ إنزيم النسخ العكسي DNA مزدوج الشريطة من قالب RNA.
في أنواع الفيروسات ذات النسخ العكسية التي تفتقر إلى نشاط بوليميراز الحمض النووي المعتمد على الحمض النووي، يمكن أن تنشأ DNA مزدوج الشريطة عن طريق بوليميراز الحمض النووي المشفر بالمضيف δ، مع الخلط بين DNA-RNA الفيروسي من أجل التمهيدي وتوليف DNA مزدوج الشريطة بواسطة a آلية مماثلة كما هو الحال في إزالة التمهيدي، حيث يحل DNA المركب حديثًا محل قالب RNA الأصلي.
عملية النسخ العكسي، والتي تسمى أيضًا النسخ الرجعي، معرضة جدًا للخطأ، وخلال هذه الخطوة قد تحدث الطفرات. قد تسبب هذه الطفرات مقاومة الأدوية.
النسخ العكسي للفيروسات القهقرية
الفيروسات القهقرية، التي يشار إليها أيضًا باسم فيروسات الفئة VI ssRNA-RT، هي فيروسات النسخ العكسي للحمض النووي الريبي مع وسيط DNA. تتكون جينوماتها من جزيئين من الحمض النووي الريبي أحادي الجديلة موجب الاتجاه مع كاب (قبعة) 5 وكاب 3 ذيل متعدد الأدينيلات. تشمل أمثلة الفيروسات القهقرية فيروس نقص المناعة البشرية (HIV) وفيروس T-lymphotropic البشري (HTLV). يحدث تكوين DNA مزدوج الشريطة في العصارة الخلوية كسلسلة من الخطوات التالية:[7]
- يعمل Lysyl tRNA بمثابة مادة أولية ويهجن إلى جزء مكمل من جينوم RNA للفيروس يسمى موقع الربط التمهيدي أو PBS.
- ثم يضيف النسخ العكسي نيوكليوتيدات الحمض النووي على الطرف 3 من التمهيدي، ويخلق الحمض النووي المكمل لـ U5 (المنطقة غير المشفرة) ومنطقة R (تكرار مباشر موجود في طرفي جزيء الحمض النووي الريبي) من الحمض النووي الريبي الفيروسي.
- مجال على إنزيم النسخ العكسي يسمى RNAse H يحط من U5 وR في نهاية 5 من الحمض النووي الريبي.
- ثم يقفز tRNA التمهيدي إلى الطرف الثالث من الجينوم الفيروسي، وتهجن خيوط DNA المركبة حديثًا إلى منطقة R التكميلية على RNA.
- يتمدد الحمض النووي التكميلي (cDNA) المضاف في (2) بشكل أكبر.
- تتحلل غالبية الحمض النووي الريبي الفيروسي بواسطة RNAse H، تاركة فقط تسلسل PP.
- يبدأ تركيب خيط DNA الثاني، باستخدام جزء PP المتبقي من الحمض النووي الريبي الفيروسي كأساس.
- يترك التمهيدي الحمض النووي الريبي (tRNA) ويحدث قفزة. يتهجين البّي بي سي من الخيط الثاني مع بّي بي سي مكمل على الخيط الأول.
- يتمدد كلا الخيطين لتشكيل نسخة كاملة من الحمض النووي مزدوج الشريطة من جينوم الحمض النووي الريبي الفيروسي الأصلي، والذي يمكن بعد ذلك دمجه في جينوم المضيف عن طريق الإنزيم المتكامل.
يتضمن إنشاء DNA مزدوج الشريطة أيضًا نقل الشريط، حيث يوجد انتقال لمنتج DNA قصير من تخليق DNA الأولي المعتمد على RNA إلى مناطق قالب متقبل في الطرف الآخر من الجينوم، والتي يتم الوصول إليها لاحقًا ومعالجتها بواسطة النسخ العكسي لنشاط الحمض النووي المعتمد على الحمض النووي.[8]
ترتب Retroviral RNA في نهاية 5 إلى 3. يُطلق على الموقع الذي يتم فيه التصلب التمهيدي إلى الحمض النووي الريبي الفيروسي موقع ربط التمهيدي (PBS). يسمى RNA 5 الذي يصل إلى موقع PBS باسم U5، ونهاية RNA 3 إلى PBS تسمى القائد. يتم فك التمهيدي tRNA بين 14 و22 نيوكليوتيد ويشكل قاعدة مزدوجة مزدوجة مع الحمض النووي الريبي الفيروسي في PBS. حقيقة أن PBS يقع بالقرب من الطرف الخامس للحمض النووي الريبي الفيروسي أمر غير معتاد لأن النسخ العكسي يقوم بتوليف الحمض النووي من 3 نهاية التمهيدي في اتجاه 5 إلى 3 (فيما يتعلق بحبل الحمض النووي المركب حديثًا). لذلك، يجب نقل النسخة الأولية والنسخة العكسية إلى نهاية 3 من الحمض النووي الريبي الفيروسي. من أجل إنجاز هذا التغيير، هناك حاجة إلى خطوات متعددة وإنزيمات مختلفة بما في ذلك بوليميريز الحمض النووي، ريبونوكلياز H RNase H وفك عديد النوكليوتيد.[9][10]
يحتوي النسخ العكسي لفيروس العوز المناعي البشري أيضًا على نشاط ريبونوكلياز يعمل على تحطيم الحمض النووي الريبي الفيروسي أثناء تخليق (كدنا)، بالإضافة إلى نشاط بوليميريز الحمض النووي المعتمد على الحمض النووي الذي ينسخ الإحساس (كدنا) إلى الحمض النووي المضاد للحساسية لتشكيل الحمض النووي الفيروسي مزدوج السلسلة (vDNA).[11]
المراجع
- ^ ببب: 3KLF; Tu X, Das K, Han Q, Bauman JD, Clark AD Jr, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E (سبتمبر 2010). "Structural basis of HIV-1 resistance to AZT by excision". Nat. Struct. Mol. Biol. ج. 17 ع. 10: 1202–9. DOI:10.1038/nsmb.1908. PMC:2987654. PMID:20852643.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Baltimore D (يونيو 1970). "RNA-dependent DNA polymerase in virions of RNA tumour viruses". Nature. ج. 226 ع. 5252: 1209–11. DOI:10.1038/2261209a0. PMID:4316300. S2CID:4222378.
- ^ Temin HM، Mizutani S (يونيو 1970). "RNA-dependent DNA polymerase in virions of Rous sarcoma virus". Nature. ج. 226 ع. 5252: 1211–3. DOI:10.1038/2261211a0. PMID:4316301. S2CID:4187764.
- ^ Ferris AL، Hizi A، Showalter SD، Pichuantes S، Babe L، Craik CS، Hughes SH (أبريل 1990). "Immunologic and proteolytic analysis of HIV-1 reverse transcriptase structure" (PDF). Virology. ج. 175 ع. 2: 456–64. DOI:10.1016/0042-6822(90)90430-y. PMID:1691562. مؤرشف من الأصل (PDF) في 2020-01-30.
- ^ Konishi A، Yasukawa K، Inouye K (يوليو 2012). "Improving the thermal stability of avian myeloblastosis virus reverse transcriptase α-subunit by site-directed mutagenesis" (PDF). Biotechnology Letters. ج. 34 ع. 7: 1209–15. DOI:10.1007/s10529-012-0904-9. hdl:2433/157247. PMID:22426840. S2CID:207096569. مؤرشف من الأصل (PDF) في 2021-04-29.
- ^ Autexier C، Lue NF (يونيو 2006). "The structure and function of telomerase reverse transcriptase". Annual Review of Biochemistry. ج. 75 ع. 1: 493–517. DOI:10.1146/annurev.biochem.75.103004.142412. PMID:16756500.
- ^ Bio-Medicine.org - Retrovirus Retrieved on 17 Feb, 2009 نسخة محفوظة 2021-04-28 على موقع واي باك مشين.
- ^ Telesnitsky A، Goff SP (1993). "Strong-stop strand transfer during reverse transcription". Reverse transcriptase (ط. 1st). New York: Cold Spring Harbor. ص. 49. ISBN:978-0-87969-382-4.
- ^ Bernstein A، Weiss R، Tooze J (1985). "RNA tumor viruses". Molecular Biology of Tumor Viruses (ط. 2nd). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory.
- ^ Moelling K، Broecker F (أبريل 2015). "The reverse transcriptase-RNase H: from viruses to antiviral defense". Annals of the New York Academy of Sciences. ج. 1341 ع. 1: 126–35. Bibcode:2015NYASA1341..126M. DOI:10.1111/nyas.12668. PMID:25703292. S2CID:42378727.
- ^ Kaiser GE (يناير 2008). "The Life Cycle of HIV". Doc Kaiser's Microbiology Home Page. Community College of Baltimore Count. مؤرشف من الأصل في 2010-07-26.
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الفيروسات
| في كومنز صور وملفات عن: منتسخة عكسية |