|
تضامنًا مع حق الشعب الفلسطيني |
حمض نووي مجسور
الحمض النووي المجسور هو نيوكليوتيد حمض نووي ريبوزي معدل. يشار إليها أحيانًا أيضًا باسم جزيئات الحمض النووي الريبوزي المقيدة أو التي يتعذر الوصول إليها. يمكن أن تحتوي مونومرات BNA على بنية مكونة من خمسة أعضاء أو ستة أعضاء أو حتى من سبعة أعضاء جسور مع تجعيد سكر إندو C3 "ثابت".[1] تم دمج الجسر صناعياً في الموضع 2 '، 4' من الريبوز لتوفير مونومر 2 '، 4'-BNA. يمكن دمج المونومرات في الهياكل البوليمرية قليلة النوكليوتيد باستخدام كيمياء الفسفوميدت القياسية. BNAs عبارة عن نيوكليوتيدات قليلة صلبة من الناحية الهيكلية مع زيادة تقارب الارتباط والاستقرار.
الهياكل الكيميائية
الهياكل الكيميائية لمونومرات BNA التي تحتوي على جسر في موضع الريبوز 2 '، 4'-BNA لتوفير مونومر 2' ، 4'-BNA كما تم تصنيعه بواسطة مجموعة تاكيشي إيمانيشي.[2][3][4][5][6][7] يمكن أن تختلف طبيعة الجسر باختلاف أنواع المونومرات. تم استخدام الهياكل ثلاثية الأبعاد لـ A-RNA و B-DNA كقالب لتصميم مونومرات BNA. كان الهدف من التصميم هو العثور على مشتقات تمتلك ارتباطات ارتباط عالية مع RNA التكميلي و/ أو خيوط DNA.
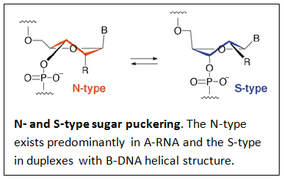




ينتج عن زيادة عدم المرونة التوافقية لشق السكر في النيوكليوسيدات (قليلة النيوكليوتيد) اكتساب تقارب ارتباط عالي مع RNA التكميلي أحادي السلسلة و / أو DNA مزدوج السلسلة. تم تصنيع أول مونومرات 2',4'-(BNA (LNA
لأول مرة بواسطة مجموعة تاكيشي إيمانيشي في عام 1997[2] وتبعها بشكل مستقل مجموعة جيسبر وينجل في عام 1998.[8]
يمكن دمج نيوكليوتيدات BNA في قليل النيوكليوتيد DNA أو RNA في أي موضع مرغوب فيه. يتم تصنيع قليلة القسيمات هذه كيميائيًا وهي الآن متاحة تجاريًا. يعزز شكل الريبوز المجسور التراص الأساسي وينظم بشكل مسبق الصلب لقليلة النيوكليوتيد مما يزيد بشكل كبير من خصائص التهجين.
يسمح دمج BNAs في قليلة النيوكليوتيد بإنتاج قليلة النوكليوتيد اصطناعية معدلة مع تقارب ارتباط مساوٍ أو أعلى ضد مكمل DNA أو RNA مع قوة تمييز ممتازة أحادية عدم التطابق؛ حيث تكون أفضل ارتباط انتقائي RNA؛ أقوى وأكثر تسلسلًا انتقائيًا لشخصيات تشكيل ثلاثية؛ وضوحا أعلى مقاومة نوكلياز، حتى أعلى من نظائرها Sp- فوسفوروثيوات؛ وقابلية ذوبان مائية جيدة لقليلة النوكليوتيد الناتجة عند مقارنتها بقليلة النوكليوتيد DNA أو RNA.
تم تصميم نظائر BNA الجديدة التي قدمتها مجموعة إيمانشي من خلال أخذ طول الجزء المجسور في الاعتبار. تم تصميم هيكل مجسور مكون من ستة أعضاء مع ميزة هيكلية فريدة (رابطة N-O) في جزء السكر للحصول على ذرة نيتروجين. تعمل هذه الذرة على تحسين تكوين الدوبلكس والثلاثي عن طريق تقليل التنافر بين فوسفات االصلب سالب الشحنة. تسمح هذه التعديلات بالتحكم في الانجذاب نحو الخيوط التكميلية، وتنظيم المقاومة ضد تدهور النيوكلياز وتوليف الجزيئات الوظيفية المصممة لتطبيقات محددة في علم الجينوم. تم التحقيق في خصائص هذه النظائر ومقارنتها بخصائص قليلة النوكليوتيدات المعدلة السابقة 2 '، 4'-(BNA (LNA) بواسطة مجموعة إيمانيشي. تظهر نتائج إيمانيشي أن "قليلة النوكليوتيدات المعدلة 2 '، 4'-BNANC مع هذه الملامح تظهر واعدة كبيرة للتطبيقات في تقنيات مضادات المعنى ومولدات الضد."
الآلية المقترحة لعمل AONs
ياماماتو ات آل. في عام 2012[9] أظهر أن العلاجات المضادة للحساسية المستندة إلى BNA تمنع تعبير النوعِ التاسع سبتيليزين/كيكسين كونفيرتاز طليعة البروتين (PCSK9) الكبدي، مما أدى إلى انخفاض كبير في مستويات البروتين الدهني منخفض الكثافة (LDL-C) في الدم لدى الفئران. دعمت النتائج الفرضية القائلة بأن PCSK9 هو هدف علاجي محتمل لفرط كوليسترول الدم ، وتمكن الباحثون من إظهار أن قليل النوكليوتيدات المستندة إلى BNA (AONs) تسبب في خفض الكوليسترول في الفئران المصابة بفرط كوليسترول الدم. لوحظت زيادة معتدلة في مستويات الأسبارتات أمينوترانسفيراز، ناقلة أمين الألانين (ALT)، ومستويات نيتروجين اليوريا في الدم بينما أظهر تحليل الأنسجة المرضية عدم وجود سمية كبدية شديدة. أفادت نفس المجموعة، أيضًا في عام 2012، أن التناظرية 2 '، 4'-BNANC [NMe] عند استخدامها في قليلة النوكليوتيدات المضادة للحساسية أظهرت أنشطة مثبطة أقوى بشكل ملحوظ والتي تكون أكثر وضوحًا في قليلة النوكليوتيدات الأقصر (13 إلى 16 مللي). قادت بياناتهم الباحثين إلى استنتاج أن نظير 2 '، 4'-BNANC [NMe] قد يكون أفضل.
فوائد تقنية BNA
تتضمن بعض فوائد BNAs مثالية للكشف عن أهداف قصيرة(سطح يوجه نحوه تيار من الجسيمات) من RNA وDNA؛ زيادة الاستقرار الحراري للطباعة على الوجهين. قادرة على تمييز النيوكليوتيدات الفردية؛ يزيد من الاستقرار الحراري للثلاثي؛ مقاومة نيوكليازات خارجية وداخلية تؤدي إلى ثبات عالي للتطبيقات في الجسم الحي وفي المختبر؛ زيادة تخصيص الهدف؛ تسهيل تسوية Tm؛ يتيح غزو حبلا الكشف عن العينات "التي يصعب الوصول إليها"؛ متوافق مع العمليات الأنزيمية القياسية.
تطبيق تقنية BNA
تشمل تطبيقات BNAs :
- أبحاث RNA صغيرة .
- تصميم وتوليف أبتامرات RNA.
- حمض نووي ريبوزي متداخل صغير( siRNA).
- تحقيقات مضادة.
- التشخيص.
- عزل.
- تحليل المصفوفة الدقيقة.
- لطخة نورثرن.
- تفاعل البوليمراز المتسلسل بالزمن الحقيقي.
- تهجين في الموقع.
- تحليل وظيفي.
- اكتشاف واستخدام تعدد أشكال النوكليوتيدات المفردة (SNP) كمولدات ضد.
- العديد من التطبيقات الأخرى لقاعدة النيوكليوتيدات.
المراجع
- ^ Saenger, W. (1984) Principles of Nucleic Acid Structure, Springer-Verlag, New York, (ردمك 3-540-90761-0).
- ^ أ ب Obika، S.؛ Nanbu، D.؛ Hari، Y.؛ Morio، K. I.؛ In، Y.؛ Ishida، T.؛ Imanishi، T. (1997). "Synthesis of 2′-O,4′-C-methyleneuridine and -cytidine. Novel bicyclic nucleosides having a fixed C3, -endo sugar puckering". Tetrahedron Letters. ج. 38 ع. 50: 8735. DOI:10.1016/S0040-4039(97)10322-7.
- ^ Obika، S.؛ Onoda، M.؛ Andoh، K.؛ Imanishi، J.؛ Morita، M.؛ Koizumi، T. (2001). "3'-amino-2',4'-BNA: Novel bridged nucleic acids having an N3'-->P5' phosphoramidate linkage". Chemical Communications (Cambridge, England) ع. 19: 1992–1993. DOI:10.1039/b105640a. PMID:12240255.
- ^ Obika، Satoshi؛ Hari، Yoshiyuki؛ Sekiguchi، Mitsuaki؛ Imanishi، Takeshi (2001). "A 2′,4′-Bridged Nucleic Acid Containing 2-Pyridone as a Nucleobase: Efficient Recognition of a C⋅G Interruption by Triplex Formation with a Pyrimidine Motif". Angewandte Chemie International Edition. ج. 40 ع. 11: 2079. DOI:10.1002/1521-3773(20010601)40:11<2079::AID-ANIE2079>3.0.CO;2-Z.
- ^ Morita، K.؛ Hasegawa، C.؛ Kaneko، M.؛ Tsutsumi، S.؛ Sone، J.؛ Ishikawa، T.؛ Imanishi، T.؛ Koizumi، M. (2001). "2'-O,4'-C-ethylene-bridged nucleic acids (ENA) with nuclease-resistance and high affinity for RNA". Nucleic Acids Research. Supplement. ج. 1 ع. 1: 241–242. DOI:10.1093/nass/1.1.241. PMID:12836354.
- ^ Hari، Y.؛ Obika، S.؛ Sekiguchi، M.؛ Imanishi، T. (2003). "Selective recognition of CG interruption by 2′,4′-BNA having 1-isoquinolone as a nucleobase in a pyrimidine motif triplex formation". Tetrahedron. ج. 59 ع. 27: 5123. DOI:10.1016/S0040-4020(03)00728-2.
- ^ Rahman، S. M. A.؛ Seki، S.؛ Obika، S.؛ Haitani، S.؛ Miyashita، K.؛ Imanishi، T. (2007). "Highly Stable Pyrimidine-Motif Triplex Formation at Physiological pH Values by a Bridged Nucleic Acid Analogue". Angewandte Chemie International Edition. ج. 46 ع. 23: 4306–4309. DOI:10.1002/anie.200604857. PMID:17469090.
- ^ Koshkin، A. A.؛ Singh، S. K.؛ Nielsen، P.؛ Rajwanshi، V. K.؛ Kumar، R.؛ Meldgaard، M.؛ Olsen، C. E.؛ Wengel، J. (1998). "LNA (Locked Nucleic Acids): Synthesis of the adenine, cytosine, guanine, 5-methylcytosine, thymine and uracil bicyclonucleoside monomers, oligomerisation, and unprecedented nucleic acid recognition". Tetrahedron. ج. 54 ع. 14: 3607. DOI:10.1016/S0040-4020(98)00094-5.
- ^ Koizumi، M. (2006). "ENA oligonucleotides as therapeutics". Current Opinion in Molecular Therapeutics. ج. 8 ع. 2: 144–149. PMID:16610767.
روابط خارجية
- https://web.archive.org/web/20130126055902/http://www.rockefeller.edu/labheads/tuschl/sirna.html
- http://www.sanger.ac.uk/resources/software/
- Pfundheller، Henrik M.؛ Lomholt، Christian (2002). Current Protocols in Nucleic Acid Chemistry. ص. 4.12.1–4.12.16. DOI:10.1002/0471142700.nc0412s08. ISBN:978-0471142706. PMID:18428894.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة)