|
تضامنًا مع حق الشعب الفلسطيني |
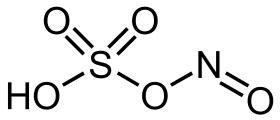
حمض نتروزيل الكبريتيك
| حمض نتروزيل الكبريتيك | |
|---|---|
| الاسم النظامي (IUPAC) | |
Nitrosylsulfuric acid |
|
| أسماء أخرى | |
Nitrosylsulfuric acid |
|
| الخواص | |
| الصيغة الجزيئية | HNO5S |
| الكتلة المولية | 127.08 غ/مول |
| المظهر | صلب أصفر |
| الكثافة | 1.61 غ/مل في محلول حمض الكبريتيك 40% |
| نقطة الانصهار | >70 °س يتفكك |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | يتفكك |
| الذوبانية | حمض الكبريتيك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض نتروزيل الكبريتيك هو مركب كيميائي صيغته HNO5S، والتي يمكن كتابتها على الشكل NOHSO4، ويمكن أن يعزل على شكل بلورات صفراء اللون.[1]
يمكن أن يصنف هذا المركب على أنه ناتج تكاثف حمضي النتروز والكبريتيك.
التحضير
يحضر المركب من إذابة نتريت الصوديوم في حمض الكبريتيك على البارد؛[2][3] كما يمكن أن تتم عملية التحضير من تفاعل حمض النتريك مع ثنائي أكسيد الكبريت.[4]
كان هذا المركب ينتج سابقاً ضمن عملية غرف الرصاص لتحضير حمض الكبريتيك.
الخواص
يمكن أن يعزل حمض نتروزيل الكبريتيك على شكل بلورات صفراء اللون،[1] وهي تتفكك عند التماس مع الماء، لكنها تذوب في محلول من حمض الكبريتيك 40%.
الاستخدامات
يستخدم حمض نتروزيل الكبريتيك أثناء عملية إنتاج الكابرولاكتام،[5] وهو يستخدم في الكيمياء العضوية في تفاعلات إضافة النتروزيل (Nitrosylation) وفي تحضير مركبات الديازونيوم (الديأزة)، وبكونه من المؤكسدات.[1]
مراجع
- ^ أ ب ت George A. Olah, G. K. Surya Prakash, Qi Wang, Xing-Ya Li (2001). Nitrosylsulfuric Acid. DOI:10.1002/047084289X.rn060. ISBN:978-0471936237.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ (1955)"1,4-Dinitronaphthalene". Org. Synth.; Coll. Vol. 3: 341. (diazodization followed by treatment with nitrite)
- ^ (1943)"1,2,3-Triiodo-5-nitrobenzene". Org. Synth.; Coll. Vol. 2: 604. (diazodization followed by treatment with iodide)
- ^ Coleman, G. H.؛ Lillis, G. A.؛ Goheen, G. E. (1939). Nitrosyl Chloride. Inorganic Syntheses. ج. 1. ص. 55–59. DOI:10.1002/9780470132326.ch20. ISBN:9780470132326..
- ^ Ritz, J.؛ Fuchs, H.؛ Kieczka, H.؛ Moran, W. C. (2002). "Caprolactam". Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a05_031. ISBN:978-3527306732.
| حمض نتروزيل الكبريتيك في المشاريع الشقيقة: | |