|
تضامنًا مع حق الشعب الفلسطيني |
حماض نبيبي كلوي قاصي
حماض نبيبي كلوي قاصي |
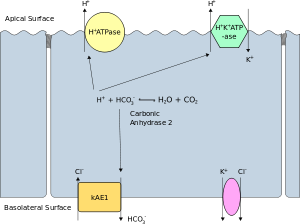
الحماض النبيبي الكلوي القاصي أو الحماض الأنبوبي الكلوي البعيد، هو الشكل التقليدي للحماض النبيبي الكلوي لكونه أول الأنماط الموصوفة. يتميز المرض بعدم قدرة الخلايا المقحمة ألفا الموجودة ضمن القناة الجامعة القشرية التابعة للأنبوب البعيد على إفراز الأحماض، وهذا يحدث نتيجةً لأسباب عديدة. يؤدي ما سبق إلى فقدان الكلى القدرة على تحميض البول لدرجة أقل من 5.3.
الأعراض والعلامات
يعتبر الإطراح الكلوي الوسيلة الأساسية للتخلص من الأحماض، ولهذا تميل درجة حموضة الدم إلى الارتفاع في هذا المرض. يسبب ما سبق السمات السريرية للحماض النبيبي الكلوي القاصي:[1]
- حماض أيضي طبيعي الفجوة.
- نقص بوتاسيوم الدم.
- تشكل حصيات كلوية مرتبطة بالبول القلوي وفرط كالسيوم البول وانخفاض السيترات فيه.[2]
- الكلاس الكلوي أو ترسب الكالسيوم في الكلى.
- إزالة تمعدن العظام، وهذا يسبب الكساح عند الأطفال وتلين العظام عند البالغين.
تتنوع أعراض ومضاعفات الحماض النبيبي الكلوي القاصي. قد يكون المرض دون أعراض تمامًا، ولكنه قد يسبب ألم في الخاصرة وبيلة دموية ناجمة عن الحصيات الكلوية وفشل في النمو وكساح شديد عند الأطفال، وقد يؤدي في بعض الحالات إلى القصور الكلوي والموت.
يسبب الحماض النبيبي الكلوي القاصي انخفاض في صوديوم المصل ونقص في حجم سوائل الجسم، وهذا يقود إلى ارتفاع مستويات الألدوستيرون فيه كرد فعل. يزيد الألدوستيرون امتصاص الصوديوم وفقدان البوتاسيوم في القنوات الجامعة، ولهذا السبب يحدث نقص بوتاسيوم الدم الذي يعتبر من السمات الشائعة للحماض النبيبي الكلوي القاصي.[3]
الأسباب
- أمراض المناعة الذاتية وخاصةً متلازمة شوغرن، ولكنه يرتبط أيضًا بالذئبة الحمامية الجهازية والتهاب المفاصل الروماتويدي وفرط غاما غلوبولين الدم. يكون نقص بوتاسيوم الدم شديد في هذه الحالات.
- أسباب وراثية تشمل طفرات النطاق 3، وهو بروتين ناقل للبيكربونات يتوضع ضمن الغشاء القاعدي الجانبي للخلايا المقحمة. يشيع انتقال تلك الطفرات عبر الوراثة السائدة في أوروبا الغربية وعبر الوراثة المتنحية في جنوب شرق آسيا. ترتبط حالات جنوب شرق آسيا بحدوث نقص بوتاسيوم دم أكثر شدة. تشمل الأسباب الوراثية الأخرى حدوث طفرات في الوحدات الفرعية لمضخة البروتون القمية (vH+ -ATPase). تنتقل الأخيرة عبر الوراثة المتنحية، وقد تترافق مع صمم حسي عصبي.[4]
- تشمع الكبد.
- الكلاس الكلوي الذي قد يكون نتيجة للحماض النبيبي الكلوي القاصي أو سبب له. يحدث ذلك نتيجة الضرر الذي يلحقه الكالسيوم بالقنوات الجامعة القشرية.
- زرع الكلى.
- فقر الدم المنجلي.
- سموم كالإيفوفوسفاميد (يسبب حماض نبيبي كلوي داني عادةً) وكربونات الليثيوم والأمفوتيريسين ب.[5][6]
- انسداد المجاري البولية المزمن.[7]
- يسبب التولوين حماض أيضي طبيعي الفجوة مع نقص بوتاسيوم الدم وفجوة صواعد إيجابية بالبول على نحو مشابه للحماض النبيبي البعيد، ولكنه لا يترافق بأي اضطراب في إفراز الحمض، ويكون الحماض الموجود نتيجة لاستقلاب التولوين.[8]
العلاج
يتضمن العلاج تصحيح حموضة الدم عبر إعطاء بيكربونات الصوديوم أو سيترات الصوديوم أو سيترات البوتاسيوم عن طريق الفم. يساهم ذلك بتصحيح حموضة الدم ومعاكسة إزالة تمعدن العظام. يعالج نقص بوتاسيوم الدم وتشكل الحصيات والكلاس الكلوي عبر أقراص سيترات البوتاسيوم التي تساهم بتعويض البوتاسيوم وتمنع إفراز الكالسيوم؛ وبالتالي لا تؤدي إلى تفاقم تشكل الحصيات على عكس بيكربونات الصوديوم وسيتراته.[9]
المراجع
- ^ Laing CM، Toye AM، Capasso G، Unwin RJ (2005). "Renal tubular acidosis: developments in our understanding of the molecular basis". Int. J. Biochem. Cell Biol. ج. 37 ع. 6: 1151–61. DOI:10.1016/j.biocel.2005.01.002. PMID:15778079.
- ^ Buckalew VM Jr (1989). "Nephrolithiasis in renal tubular acidosis". The Journal of Urology. ج. 141 ع. 3 (part 2): 731–737. DOI:10.1016/S0022-5347(17)40997-9. PMID:2645431.
- ^ Wein، Alan, J (2011). Campbell-walsh Urology Expert Consult (PDF) (ط. 10th). Philadelphia, PA: W B Saunders Co. ص. 1045. ISBN:978-1-4160-6911-9. مؤرشف من الأصل (PDF) في 2016-03-03.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Karet FE، Finberg KE، Nelson RD، وآخرون (1999). "Mutations in the gene encoding B1 subunit of H+-ATPase cause renal tubular acidosis with sensorineural deafness". Nat. Genet. ج. 21 ع. 1: 84–90. DOI:10.1038/5022. PMID:9916796.
- ^ Boton R، Gaviria M، Batlle DC (1987). "Prevalence, pathogenesis, and treatment of renal dysfunction associated with chronic lithium therapy". Am. J. Kidney Dis. ج. 10 ع. 5: 329–45. DOI:10.1016/s0272-6386(87)80098-7. PMID:3314489.
- ^ Skinner R، Pearson AD، English MW، وآخرون (1996). "Risk factors for ifosfamide nephrotoxicity in children". Lancet. ج. 348 ع. 9027: 578–80. DOI:10.1016/S0140-6736(96)03480-0. PMID:8774570.
- ^ McCurdy DK، Frederic M، Elkinton JR (1968). "Renal tubular acidosis due to amphotericin B". N. Engl. J. Med. ج. 278 ع. 3: 124–30. DOI:10.1056/NEJM196801182780302. PMID:5634966.
- ^ Carlisle، E. J.؛ Donnelly، S. M.؛ Vasuvattakul، S.؛ Kamel، K. S.؛ Tobe، S.؛ Halperin، M. L. (فبراير 1991). "Glue-sniffing and distal renal tubular acidosis: sticking to the facts". Journal of the American Society of Nephrology. ج. 1 ع. 8: 1019–1027. ISSN:1046-6673. PMID:1912400.
- ^ Walsh SB، Shirley DG، Wrong OM، Unwin RJ (2007). "Urinary acidification assessed by simultaneous furosemide and fludrocortisone treatment: an alternative to ammonium chloride". Kidney Int. ج. 71 ع. 12: 1310–6. DOI:10.1038/sj.ki.5002220. PMID:17410104.