|
تضامنًا مع حق الشعب الفلسطيني |
جان بيير شانجو
| جان بيير شانجو | |
|---|---|
| معلومات شخصية | |
| تعديل مصدري - تعديل |
جان بيير تشانجوكس (من مواليد 6 أبريل 1936-)، عالم أعصاب فرنسي، اشتهر بأبحاثه في العديد من مجالات علم الأحياء، بدءًا من بنية ووظيفة البروتينات (مع التركيز على البروتينات التفارغية)، كما تعمق في التطور المبكر للجهاز العصبي، ووسع خبرته لتشمل الوظائف المعرفية. على الرغم من شهرة نموذج مونود-وايمان-تشانجوكس [English] في العلوم البيولوجية الذي وضعه، إلا أن أبرز انجازاته العلمية هو تحديد وتنقية مستقبلات الأستيل كولين النيكوتينية ونظرية التخلق اللاجيني عن طريق اختيار المشبك. يُعرف تشانجوكس من قبل الجمهور غير العلمي بأفكاره المتعلقة بالعلاقة بين العقل والدماغ الجسدي، وقد ذكر في كتابه (محادثات حول العقل والمادة والرياضيات) بأنه يدعم بقوة وجهة النظر القائلة بأن الجهاز العصبي يعمل بأسلوب إسقاطي وليس بأسلوب رد الفعل وأن التفاعل مع البيئة (بدلاً من أن يكون مفيدًا) قد يؤدي إلى الاختيار من بين مجموعة متنوعة من التمثيلات الداخلية الموجودة مسبقًا. جان بيير تشانجوكس هو عضو في أكاديمية العلوم منذ عام 1986.[1]
السيرة الذاتية
إلتحق شانجو بمدرسة الأساتذة العليا في عام 1995، و أخد إجازته بها عام 1957 ثم ديبلومه في الدراسات العليا عام 1958، وكان تخصصه هو تجميع العلوم الطبيعية. بدأ حياته العلمية و هو لا يزال في مدرسة الأساتذة العليا، حيث مارس عدة تدربيات في مختبر أركو للطفيليات (بالفرنسية:Argo) في Banyuls-sur-Mer، حيث أنه حدد نوعا جديداً من الطفيليات. و قد كتب أطروحته في معهد باستور بإشراف جاك مونو و فرانسوا جاكوب. و من ثم أخذ دكتوراه في عام 1964، ومن ثم غادر شانجو فرنسا ليكمل دراساته ما بعد الدكتوراه في جامعة كاليفورنيا (بيركلي) (1965-1966) ، و من ثم انتقل إلى جامعة كولومبيا كلية الأطباء والجراحين . وبعد ذلك عاد إلى فرنسا كمدير أو مساعد رئيس البيولوجيا الجزيئية التي يحتلها جاك مونو في كلية فرنسا. وفي عام 1972، عُين شانجو مديراً لوحدة علم الأعصاب الجزيئي في معهد باستور، حيث أصبح أستاذاً في عام 1975. و في العام نفسه، انتخب شانجو أستاذاً في كوليج دو فرانس، حيث عمل بها حتى عام 2006.
الإنجازات العلمية
طوال حياته المهنية، شانجو كان وفيا لتصور أحادي للدماغ البشري للجمع بين المستويات الجزيئية والخلوية والمعرفية. فيقول شانجو أنه إذا أردنا العثور على موضوع موحد، فهو الاعتقاد بأن التحديد هو أساس وقاعدة العمليات الحيوية بدلاً من التعليمات. بدأت خطط شانجو في البحث كمنهجيات منفصلة، لكنها اجتمعت في العقود الأخيرة لتعطي تصورا حول التفارغية باعتبارها كدور أساسي مستقبلات النواقل العصبية في الوظائف المعرفية.
ومن إنجازات شانجو العلمية :
التفارغية
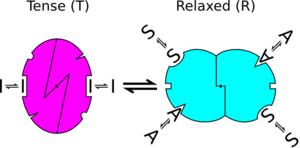
خلال العمل على اطروحته، التي أجريت تحت إشراف جاك مونو و فرانسوا جاكوب، درس شانجو تفارغية خصائص الإنزيمات التي تنظم البكتيريا، النشاط الذي يتم عن طريق تضمين إشارات من التركيب الكيميائي . [2][3][4] عمله أدى إلى تطوير نموذج الانتقال التفارغي للبروتين (في الصورة) .[5][6] و الفكرتين الرئيسيتين في هذه النظرية :
- البروتينات يمكن أن تتواجد تحت مختلف التشكلات في التوازن الحراري وفي غياب إشارة تحكم، و تنظيمات التفارغية هي مجرد تحول في التوازن بين تلك التشكلات قبل استقرار واحد.
- تواجد جميع الوحدات الفرعية للبروتين متناظرة، والانتقالية تجري بطريقة منسقة. و يوضح النموذج (في الصورة) تضافر البروتينات التنظيمية دون تغيير تدريجي للمعايير الفيزيائية الحيوية.
هذا الإطار المفاهيمي لا يزال يستخدم لشرح خصائص البروتينات التنظيمية مثل الهيموغلوبين.
هيكل المستقبل النيكوتيني

في عام 1970، قام شانجو بعزل المستقبل النيكوتيني للأستيل كولين عن الجهاز الكهربائي الخاص بأحد السكينيات، وهو أول مستقبل تم عزله[8]، وهذا راجع لخصائص سكينيات الشكل الضعيفة.[9] وقد ذكر في وقت لاحق أن تمت عملية عزل مشابهة لنفس المستقبل من طرف ريكاردو ميليدي.[10] عمل شانجو على تحسين أساليب التقنيات وتطيرها داخل مجموعة من العلماء الأخرين[11]، قد تم الوصول إلى اقتراح أن المستقبل النيكوتيني كان عبارة عن بروتين بنتاميكي.[12]
طوال الثمانينات والتسعينات، تقنيات البيولوجيا الجزيئية المستخدمة في مختبر شانجو قد أدت إلى الوصول للنتائج التالية :
- تفكيك الهياكل العليا ورباعية العصر للمستقبل.
- تحديد موقع المسام الأيونية، التي تتألف من الجزء الثاني للمجال الترانسميمبراني.[13]
- الأساس الجزيئي للانتقائية الأيونية قد صنف ضمن المجال الترانسميمبراني.[14][15][16]
- بنية الموقع الملزم للأستيل كولين والنيكوتين تم تحديدها في مجال التفاعل بين الوحدات الفرعية المجاورة.[17][18][19]
مراجع
- ^ Jean-Pierre Changeux , النسخة الفرنسية , 4 يونيو 2018
- ^ Changeux J.-P. (1961). The feedback control mechanism of biosynthetic L-threonine deaminase by L-isoleucine. Cold Spring Harbor. Symp. Quant. Biol. 26: 313-318.
- ^ Changeux J.-P. (1963). Allosteric Interactions on biosynthetic L-theonine deaminase from E. coli K12. Cold Spring Harb Symp Quant Biol, 28: 497-504
- ^ Monod J., Changeux J.-P., and Jacob. F. (1963). Allosteric proteins and cellular control systems. J. Mol. Biol. 6: 306-329
- ^ Monod J., Wyman J., and Changeux J.-P. (1965). On the nature of allosteric transitions: a plausible model. J. Mol. Biol. 12: 88-118.
- ^ Rubin M.M., Changeux J.-P. (1966). On the nature of allosteric transitions ; implications of non-exclusive ligand binding. J. Mol. Biol. 21: 265-274.
- ^ Le Novère N., Grutter T., Changeux J.-P. (2002). Models of the extracellular domain of the nicotinic receptors and of agonist and Ca++ binding sites. Proc. Natl. Acad. Sci. USA, 99: 3210-3215.
- ^ Changeux J.-P., Kasai M., Huchet M., Meunier J.-C. (1970). Extraction à partir du tissu électrique de gymnote d'une protéine présentant plusieurs propriétés caractéristiques du récepteur physiologique de l'acétylcholine. C. R. Acad. Sci. 270D: 2864-2867.
- ^ Changeux J.-P., Kasai M., and Lee C.Y. (1970). The use of a snake venom toxin to characterize the cholinergic receptor protein. Proc. Natl. Acad. Sci. USA 67: 1241-1247.
- ^ Miledi R., Molinoff P., Potter L.T. (1971). Isolation of the cholinergic receptor protein of Torpedo electric tissue. Nature 229:554-557.
- ^ Olsen R., Meunier J.C., Changeux J.-P. (1972). Progress in purification of the cholinergic receptor protein from Electrophorus electricus by affinity chromatography. FEBS Lett. 28., 96-100.
- ^ Hucho F., Changeux J.-P. (1973). Molecular weight and quaternary structure of the cholinergic receptor protein extracted by detergents from Electrophorus electricus electric tissue. FEBS Lett. 38: 11-15
- ^ Giraudat J., Dennis M., Heidmann T., Chang J.Y., Changeux J.-P. (1986). Structure of the high affinity site for noncompetitive blockers of the acetylcholine receptor: serine-262 of the delta subunit is labeled by [3H]-chlorpromazine. Proc. Natl. Acad. Sci. USA 83: 2719-2723.
- ^ Galzi J.-L., Devillers-Thiery A., Hussy N., Bertrand S., Changeux J.-P., Bertrand D. (1992). Mutations in the ion channel domain of a neuronal nicotinic receptor convert ion selectivity from cationic to anionic. Nature 359: 500-505.
- ^ Bertrand D., Galzi J.-L., Devillers-Thiéry A., Bertrand S., Changeux J.-P. (1993). Mutations at two distinct sites within the channel domain M2 alter calcium permeability of neuronal alpha7 nicotinic receptor. Proc. Natl. Acad. Sci. USA 90: 6971-6975.
- ^ Corringer P.-J., Bertrand S., Galzi J.-L., Devillers-Thiéry A., Changeux J.-P., Bertrand D. (1999). Mutational Analysis of the Charge Selectivity Filter of the a7 Nicotinic Acetylcholine Receptor. Neuron 22: 831-843.
- ^ Dennis M., Giraudat J., Kotzyba-Hibert F., Goeldner M., Hirth C., Chang J.Y., Lazure C., Chrétien M., Changeux J.-P. (1988). Amino acids of the Torpedo marmorata acetylcholine receptor subunit labeled by a photoaffinity ligand for the acetylcholine binding site. Biochemistry 27: 2346-2357.
- ^ Galzi J.-L., Revah F., Black D., Goeldner M., Hirth C., Changeux J.-P. (1990). Identification of a novel amino acid a-Tyr 93 within the active site of the acetylcholine receptor by photoaffinity labeling: additional evidence for a three-loop model of the acetylcholine binding site. J. Biol. Chem. 265: 10430-10437.
- ^ Galzi J.-L., Bertrand D., Devillers-Thiéry A., Revah F., Bertrand S., Changeux J.-P. (1991). Functional significance of aromatic amino acids from three peptide loops of the alpha 7 neuronal nicotinic receptor site investigated by site-directed mutagenesis. FEBS Lett. 294: 198-202.
| في كومنز صور وملفات عن: جان بيير شانجو |
- أساتذة كوليج دو فرانس
- أعضاء أجانب في الأكاديمية الوطنية الأمريكية للعلوم
- أعضاء الأكاديمية السويدية الملكية للعلوم
- أعضاء الأكاديمية الفرنسية للعلوم
- أعضاء الأكاديمية الوطنية للطب
- أعضاء هيئة تدريس جامعة كولومبيا
- حائزون على جائزة ألبرت أينشتاين العالمية للعلوم
- حائزون على جوائز الأكاديمية الوطنية للعلوم
- خريجو المدرسة العليا للأساتذة
- علماء أحياء فرنسيون
- علماء أعصاب فرنسيون
- علماء وراثة فرنسيون