|
تضامنًا مع حق الشعب الفلسطيني |
ثييران
| ثييران | |
|---|---|
 |
 |
| تسمية الاتحاد الدولي للكيمياء | |
Thiirane[1] |
|
| أسماء أخرى | |
2,3-Dihydrothiirene[1] Ethylene sulfide[1] |
|
| المعرفات | |
| رقم CAS | 420-12-2 |
| بوب كيم (PubChem) | 9865 |
| الخواص | |
| الصيغة الجزيئية | C2H4S |
| الكتلة المولية | 60.12 غ/مول |
| المظهر | سائل أصفر |
| الكثافة | 1.01 غ/سم3 |
| نقطة الانصهار | −109 °س |
| نقطة الغليان | 55–56 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
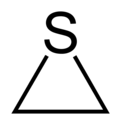
ثييران هو مركب عضوي حلقي غير متجانس مشبع له الصيغة الكيميائية C2H4S.
يتألف المركب بنيوياً من حلقة ثلاثية حاوية على ذرة كبريت واحدة، وهو يعد أبسط المركبات الحلقية الحاوية على الكبريت،[2] وتسمى مشتقات المركب باسم ثييرانات.
التحضير
يحضر الثييران من تفاعل كربونات الإيثيلين مع ثيوسيانات البوتاسيوم؛[3] حيث يعالج KSCN حرارياً لينصهر في الأول تحت الفراغ لإزالة الماء، ويتشكل سيانات البوتاسيوم بالإضافة إلى ثنائي أكسيد الكربون:
كما يمكن أن تتم عملية التحضير من تفاعل أكسيد الإيثيلين (الأكسيران) مع ثيويوريا في وسط مائي وبالتبريد، ويحصل على اليوريا كناتج ثانوي في العملية:[4]
الخواص
يوجد مركب ثييران في الشروط القياسية على شكل سائل أصفر اللون له رائحة منفرة. يبلغ طول الرابطة كربون-كبريت 181.9 بيكومتر، أما الرابطة كربون-كربون في المركب فطولها 149.2 بيكومتر؛ قي حين أن زاوية الرابطة C-S-C تبلغ 65°.[5]
يتفاعل الثييران مع النكليوفيلات (محبات النوى) في تفاعل فاتح للحلقة، والذي يستخدم في تحضير الثيولات.
فعلى سبيل المثال يحدث تفاعل إضافة مع الأمينات ليشكل مركبات 2-مركبتو إيثيل أمين،[6] والتي تعد من الربيطات المتمخلبة الجيدة.
أما مع الإيمينات فيتفاعل ليشكل مشتقات ثيازوليدين.[7]
ديثييران
تعرف مركبات ديثييران Dithiiranes عندما يكون هناك ذرتي كبريت في الحلقة الثلاثية؛ ويحصل عليها عند أكسدة ديثييتان (حلقة رباعية مشبعة حاوية على ذرتي كبريت).[8]
اقرأ أيضاً
المراجع
- ^ أ ب ت ث "thiirane (CHEBI:30977)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. مؤرشف من الأصل في 2016-03-04.
- ^ Warren Chew; David N. Harpp (1993). "Recent aspects of thiirane chemistry". Journal of Sulfur Chemistry. ج. 15 ع. 1: 1–39. DOI:10.1080/01961779308050628.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ (1973)"Ethylene Sulfide". Org. Synth.; Coll. Vol. 5: 562.
- ^ J. F. Olin, F. B. Dains in: J. Am. Chem. Soc. 1930, 52, 3322–3327. دُوِي:10.1021/ja01371a047
- ^ G. L. Cunningham, A. W. Boyd, R. J. Myers, W. D. Gwinn in: J. Chem. Phys. 1951, 19, 6, 676–685; دُوِي:10.1063/1.1748331.
- ^ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0-471-95512-4.
- ^ M. D. Rozwadowska, A. Sulima in: Tetrahedron 2001, 57, 3499–3506. دُوِي:10.1016/S0040-4020(01)00224-1
- ^ Ahhiko Ishii, Masamatsu Hoshino, and Juzo Nakayama "Recent Advances in Chemistry of Dithiirane and Small Ring Compounds Containing Two Chalcogen Atoms" Pure & Appl. Chem., 1996, volume 68, pp. 869-874.دُوِي:10.1002/chin.199650272
| ثييران في المشاريع الشقيقة: | |


