|
تضامنًا مع حق الشعب الفلسطيني |
ثيان (مركب كيميائي)
| ثيان | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Thiane |
|
| أسماء أخرى | |
Tetrahydro-2H-thiopyran |
|
| المعرفات | |
| رقم CAS | 1613-51-0 |
| بوب كيم (PubChem) | 15367 |
| الخواص | |
| الصيغة الجزيئية | C5H10S |
| الكتلة المولية | 102.19 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.99 غ/سم3 |
| نقطة الانصهار | 19 °س |
| نقطة الغليان | 140–142 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثيان هو مركب عضوي حلقي غير متجانس مشبع له الصيغة الكيميائية C5H10S.
يتألف المركب بنيوياً من حلقة سداسية حاوية على ذرة كبريت واحدة؛ ويطلق على مشتقاته اسم ثيانات.
التحضير
يحضر الثيان من تفاعل 5،1-ثنائي برومو البنتان مع كبريتيد الصوديوم.[1][2]
كما يمكن أن تتم عملية التحضير من تحلّق مركب 5-برومو-1-بنتانثيول في وسط قاعدي.[3]
الخواص
يوجد المركب في الشروط القياسية على شكل سائل عديم اللون، وهو سهل التصلب والتبلور. يوجد الثيان في الحالة الصلبة على شكل بلورات ذات نظام بلوري مكعب تبلغ قيمة ثابت الشبكة البلورية فيه 869 بيكومتر؛ وتكون هناك أربع وحدات صيغة في كل وحدة خلية.[4]
يتفاعل الثيان مع النكليوفيلات (الكواشف المحبة للنوى)، وخاصة في وجود مجموعات مغادرة جيدة.
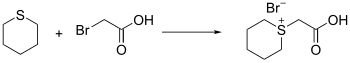
اقرأ أيضاً
المراجع
- ^ K. Nagasawa, A. Yoneta: Chemistry. II. Use of Dimethyl Sulfoxide – a Facile Synthesis of Cyclic Sulfides in Chem. Pharm. Bull. 1985, 33, 5048–5052,, doi:10.1248/cpb.33.5048, pdf. نسخة محفوظة 17 نوفمبر 2016 على موقع واي باك مشين.
- ^ E. V. Whitehead, R. A. Dean, F. A. Fidler "The Preparation and Physical Properties of Sulfur Compounds Related to Petroleum. II. Cyclic Sulfides" J. Am. Chem. Soc., 1951, volume 73, pp 3632–3635. دُوِي: 10.1021/ja01152a022
- ^ M. B. Anderson, M. G. Ranasinghe, J. T. Palmer, P. L. Fuchs: Cytochalasin support studies. 10. Nucleophilic and electrophilic mercaptanylations via 2-(trimethylsilyl)ethanethiol-derived reagents in: J. Org. Chem. 1988, 53, 3125–3127, دُوِي:10.1021/jo00248a045.
- ^ S. Kondo in: Bull. Chem. Soc. Jpn. 1956, 29, 999.
- ^ E. Ziegler, H. Wittmann, H. Sterk in: Monatsh. Chem. 1987, 118, 115–126.
| ثيان في المشاريع الشقيقة: | |