|
تضامنًا مع حق الشعب الفلسطيني |
التئام
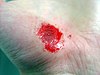
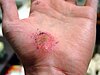
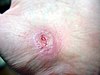
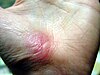
| التئام الجرح في اليد | ||||
|
|
|
| |
| مراحل التئام الجرح خلال الايام التاليه. | ||||
| 0 | 3 | 17 | 30 | |
الالتئام أو التحام[1] (ويعني حرفيًا الاكتمال[2])،التئام الجروح هي عملية طويلة ومعقدة يقوم خلالها الجلد أو انسجة الجسم الأخرى بتصليح نفسها بسبب جرح حدث لها. في الجلد الطبيعي والمكون من طبقتين هي البشرة (الطبقة الخارجية) والادمة (الطبقة الداخلية) يعملان كطبقة واقية للجسم من البيئة الخارجية المحيطة. عندما تُصاب أو تُجرح هذه الطبقة الواقية (الجلد)، سوف تتفعل سلسلة منظمة من التفاعلات الكيموحيوية حتى يعاد إصلاح ما تم اتلافه بسبب الجرح.[3][4] وهذا العمليات هي:تجلط الدم (hemostasis)، الالتهاب، مرحلة نمو النسيج (proliferation) وإعادة تنظيم وترتيب له (maturation). في بعض الاحيان يعتبر تجلط الدم جزء من مرحلة الالتهاب وليس مرحلة منفصلة.[5]
- تجلط الدم: (hemostasis)تبدأ خلال الدقائق الأولى بعد حدوث الجرح، الصفائح الدموية الموجودة في الدم تبدأ تتجمع وتلتصق في مكان الجرح، وخلال هذه العملية تطرأ تغيرات على الصفائح نفسها فيتم تنشيطها لتحدث بعض التغيرات في هذه العملية. يتغير شكلها لتصبح غير منتظمة الشكل، أكثر ملائمة لعملية التجلط، وتبدأ أيضًا بافراز رسائل أو اشارات كيميائية لكي تعزز عملية التجلط. وهذا يؤدي إلى تفعيل الفبرين (fibrin) الذي يكون شبكة تعمل كمادة لاصقة، تلصق وتربط الصفائح الدموية بعضها ببعض. وهذا ينتج خثرة تعمل كسدادة تغلق فيها الفتحات التي حدثت للاوعية الدموية بسبب الجرح، لكي تقلل أو تمنع النزيف الذي حصل بسبب الجرح.[6][7]
- الالتهاب: خلال هذه المرحلة تزال الخلايا الميتة والتالفة من منطقة الجرح، ويزال معها البكتيريا والحطام ومسببات الأمراض الأخرى. وهذا يحدث خلال عملية تدعي بلعمة أو الالتقام (phagocytosis) تقوم خلالها خلايا الدم البيضاء بابتلاع البكتيريا والحطام، وافراز عوامل النمو (Growth Factor) مشتقة من الصفيحات إلى مكان الجرح والتي تؤثر على الخلايا لتجعلها تهاجر وتنقسم إلى خلايا أكثر خلال مرحلة النمو.
- عمليه نمو نسيج جديد: (Proliferation) في هذه المرحلة يبدأ تكون الانسجه الدمويه، وذلك من خلال افرازت خلايا من بطانة الاوعية الدموية لتكوين اوعية دموية جديدة[8]، اما في عمليه تكوين النسيج الحُبيبي والليفي، فان الحُبيبات تكون وتنمو من خلال الانسجة الخلوية الخارجية (ECM) بواسطة افراز الكولاجين والفبرونيكتين.[9] في نفس الوقت اعاده تكوين نسيج الضهاره (epidermis)تحدث من خلال نمو وزحف خلايا نسيج الضهاره إلى اعلى الجرح مغطيه الانسجه الجديده.[8]
- تتقلص منطقه الجرح من خلال تقلص خلايا الاليف العضليه في حجمها بالتالي انقباض الجرح من الحواف في آليه تشبه كالتي في العضلات الملساء.في حين الخلايا غير مفيده تموت في عمليه الموت البرمجي (apoptosis).
- عمليه النضج أو اعاده التشكيل النسيجي (maturation): تحدث من خلال إعادة ترتيب الكولاجين بخطوط متوترة وقتل الخلايا غير المفيدة من خلال الموت البرمجي.
عمليه التئام الجرح عملية معقدة وهشة، في حاله أي تداخل أو فشل خلال هذه العملية قد يتاذى الجرح ويتحول إلى جرح مزمن غير قبل للشفاء. هنالك بعض العوامل التي تؤثر على التئام الجروح هي: السكري، امراض الاوعية الدموية وامراض اختلال العمليات الأيضية التي تصيب كبار السن.[10]
العناية بالجرح تشجع وتزيد من سرعة شفاء الجرح وذلك عن طريق التنظيف والحماية من الإصابة بجرح مرة أخرى أو حدوث أي عدوى. بالنظر إلى كل مريض وحاجاته، تتراوح تلك العناية من شكلها الابسط «الاسعافات الاولية» إلى متخصصي التمريض الشامل من تمريض الجروح والفغر (ostomy) (جرح صناعي في الجلد لاستئصال عضو ما) والتمريض الخاص بمرضى التحكم اللاإرادي لللافراز الشرجي والبولي الزائد (Continence nursing) ومركز رعاية الحروق.

أما في الطب النفسي وعلم النفس، فإن الالتئام هو عملية يتم من خلالها معالجة العصاب والذهان وصولًا للدرجة التي يستطيع عندها المريض القدرة على الحياة بطريقة طبيعية أو إتمام عملية الوجود دون أن يخضع لظاهرة نفسية مرضية. قد تشمل هذه العملية العلاج النفسي والعلاج بالأدوية ومعالجة المناهج الروحية التقليدية بطريقة متزايدة.
التجديد
يجب أن تكون الخلية المصابة من النوع القادر على التكاثر لالتئام أي جرح من خلال تجدد الأنسجة. تحتاج الخلايا أيضًا إلى إطار من الكولاجين بجانب النمو. جنبًا إلى جنب مع معظم الخلايا هناك غشاء قاعدي أو شبكة الكولاجين التي تتم عن طريق أرومة ليفية التي تتحكم في نمو الخلايا. بما أن الإقفار ومعظم التوكسينات لا تدمر الكولاجين، فسيستمر وجودها حتى اختفاء الخلايا الموجودة حولها.
مثال
النخر الأنبوبي الحاد (ATN) في كلية (عضو) هي حالة يتم فيها مداواة الخلايا بالكامل عن طريق التجديد. يحدث النخر الأنبوبي الحاد عند تهتك الخلايا الظهارية التي تبطن الكلية بسبب نقص الأكسجين (مثل ما هو موجود في صدمة نقص حجم الدم، عندما ينخفض الدم المتدفق للكلية انخفاضًا كبيرًا) أو عن طريق السموم (مثلما هو في بعض المضادات الحيوية أوالفلزات الثقيلة أو رباعي كلوريد الكربون).
على الرغم من أن العديد من تلك الخلايا الظهارية تكون ميتة، فعادة ما يظهر نخر غير مكتمل، مما يعني وجود بقع للخلايا الظهارية لا تزال حية. إضافة إلى ذلك، يظل الإطار الكولاجيني للأنابيب سليمًا.
يمكن استنساخ الخلايا البشرية الحالية واستخدام الغشاء القاعدي كموجه لذلك، مما يؤدي في النهاية إلى رجوع الكلية لحالتها الطبيعية. بعد إتمام عملية التجديد، يكون التلف غير قابل للكشف، حتى باستخدام المجهر.
يجب أن تتم عملية الالتئام عن طريق عملية الإصلاح في حالة إصابة الخلايا غير القادرة على التجديد (أي عضلة أو أعصاب القلب). أيضًا، إصابة شبكة الكولاجين (مثل ما يتم عن طريق (الإنزيمات التهتك البدني) أو الانهيار الكلي (مثل ما قد يحدث في الاحتشاء) الذي يتسبب في عملية الالتئام عن طريق الإصلاح.
المرحلة الأولى ومرحله التكوين النسيجي

عمليه التئام الجروح تنقسم إلى أربعة مراحل وهي: تجلط الدم، الالتهاب، عمليه تكوين النسيج الجديد وعمليه النضج أو إعادة تكوين النسيج. لكن مؤخرا تم بناء وصف نموذجي يوضح هذه العملية ولكن بمرحلتين بدلا من اربعه كما ذكر سابقاً، وهما المرحلة الاوليه ومرحله تكوين الخلايا الجديده. المرحلة الاوليه والتي تبدأ مباشره بعد حدوث الجرح والتي تتضمن أحداث خلويه وجزيئيه تؤدي إلى تجلط الدم وتكوين أولي لانتقال المواد الخارجيه الخلويه التي توفر بناء هيكلي لتماسك الخلوي اولاً والتكوين النسيجي لاحقا. أما مرحله بناء الخلايا فهي تتضمن أنواع مختلفه من الخلايا التي تعمل مع بعضها البعض لتشكل استجابه التهابيه وتشكيل النسيج الخلايا الحُبيبيه وتستعيد الخلايا الضهاريه. هذه المرحلة تنقسم إلى عده اجزاء فرعية منها: 1) خلايا البلعمة ومكونات الالتهاب (من 1-2 يوم)و 2)تفاعل الخلايا الضهاريه الوسيطه (تغير شكل النسيج الضهاري في ساعات هجرة الخلايا تبدأ من يوم أول أو ثاني يوم)،3) خلايا النسيج الحبيبي والخلايا الليفيه: محاذاه تقدميه وإنتاج الكولاجين وتقلص المواد (بين يوم 4 و 14)، 4) الخلايا الباطنية وعمليه تكوين الأوعية الدموية تبدا من اليوم الرابع، 5) المواد الموجوده في الطبقة الجلديه والمواد التصنيعيه تبدأ من اليوم الرابع وتنتهي بعد أسبوعين، أما التغير وإعادة التكوين فتبدأ بعد الأسبوع الثاني وتنتهي بعد أشهر معتمده على حجم الجرح.
الوقت وتكوين الطبقة الضهارية
الوقت مهم جداً لالتئام الجرح والأهم من ذلك هو الوقت التي تتكون فيه الطبقة الضهاريه، ففي حالة تكون هذه الطبقة بشكل بطيء فإن نسبة تكون ندبه تكون عالية حيث تبقى لأسابيع أو أشهر [12][13]، أما في حالة تكون هذه الطبقة بوقت سريع فإن إعادة بناء الأنسجة ستكون أسرع وفرص أقل في ظهور ندبه.[13]
مرحله الالتهاب
عندما تبدا مرحلة الالتهاب يتم تنشيط سلسلة من عناصر التخثر عن طريق خثرة فبرين لكي تقلل من خسارة الدم عن طريق الجرح المحدث، بعد ذلك يتم إفراز العديد من العناصر الالتهابية والبلعمية لتقوم بإزالة الحطام والبكتيريا والنسيج المتلف وبالإضافة إلى افراز العديد من الاشارات الخلوية التي تحفز بدء طور النمو من التئام الجرح.
تضيق وتوسيع الأوعية الدموية
عندما يجرح الجلد أو أي نسيج من الجسم فان الدم يختلط مع الكولاجين، وبالتالي يُفَعل الصفائح الدمويه لأفراز العوامل الالتهابيه وافراز البروتينات السكرية glycoproteins التي تلتصق على غشاء الخلايا تؤدي إلى التصاق الخلايا ببعضها متجمعة مشكله كتله.[14] الفبرين والفبرونكتين يعملان معا لتشكيل هذه الكتلة لسد الجرح ومنع نزف المزيد من الدماء وفقدان البروتينات حتى يُشكل الكولاجين.[8] الخلايا المهاجرة تستخدم هذه الكتلة لتزحف من خلالها، أما الصفائح الدمويه تلتصق بها وتفرز العوامل المهمة. في النهاية هذه الكتلة تتحلل لتستبدل بالنسيج الحُبيبي ولاحقا بالكولاجين.[15]
مباشرة بعد خرق الاوعيه الدمويه، ينفجر جدار الخلية ويفرز عناصر التهابيه هما البروستاغلاندينات والثرومبوكسين التي تعمل على تشنج الاوعيه الدمويه وتقليل أو منع النزف مع تجمع الخلايا والعناصر الالتهابيه في المنطقة.[14] تضيق الاوعيه يستمر لمده خمس إلى عشر دقائق من بدايه الجرح حيث بعد ذلك يحصل توسيع للاوعيه الدمويه الذي يستمر ل 20 دقيقة بعد الجرح بسبب عوامل تفرزها الصفائح الدمويه من اهمها الهستامين[5][14]، الهستامين يجعل الاوعيه الدمويه ناضحه حتى تتورم الانسجه المحيطه لسماح بالبروتينات وخلايا الدم البيض في الدم للدخول إلى الانسجه وإلى المنطقة الخارجيه الخلويه.[16][17]
خلايا المتعادله المتعدده النوى (Polymorphonuclear neutrophil)
تصل هذه الخلايا إلى الجرح بعد ساعه من حدوثه وتبقى لمده يومين حيث تصبح هي الخلايا السائده وتحديدا في اليوم الثاني[18] والتي تجلب إلى المنطقة بواسطه الفبرونكتين وعوامل النمو والكينينات.هذه الخلايا تبلعم الحطام وتقتل البكتيريا بإفراز بعض الجذريات الذرية الحرة، وتسمى هذه العملية بالانفجار التنفسي.[19][20] أيضا تقوم الخلايا بتنضيف الجرح بافراز انزيم البروتييز (proteases)والذي يحطم الانسجه التالفه. تعيش الخلايا المتعادله الفعالة لمده يومين ومن ثم تموت عن طريق الموت البرمجي وتبلع بواسطه الخلايا البلعميه بعد انتهاء وضيفتها.[21] ومن الخلايا الدم البيض الأخرى التي تدخل إلى منطقة الجرح هما الخلايا T المساعده والتي تفرز السيتوكينات والتي تعمل على انقسام المزيد من الخلايا التائية وتزيد من الالتهاب وزياده توسيع ونفاذيه الاوعيه الدمويه.[16][22] لسماح للخلايا البلعميه بالنفاذ منها. والخلايا التائية أيضا تزييد من فاعلية الخلايا البلعمية.[16]
الخلايا البلعميه (Macrophages)
دور الخلايا البلعميه في ألتئام الجرح هو بلع[23] الخلايا المستهلكة التي من ضمنها خلايا المتعادلة المتعددة النوى والبكتيريا واللانسجة المُتلفة.[18] انها أيضا مساهمه في عمليه اعاده بناء الاوعيه الدمويه[18] وبناء النسيج الضهاري[24][25] بواسطه افراز بعض العناصر التي تؤدي إلى شفاء أو التام الجرح عبر مراحل مختلفه وهنالك بعض الظروف تعمل على تحفيزها كوجود كميات قليلة من الاكسجين.وقد اكتشف مؤخرا منبعض العلماء على ان هذه الخلايا تساعد على تشنج حواف الجرح. تنتهي مرحل الاتهاب عندما تنخفض نسبه الخلايا الدم البيض والعناصر الالتهابيه عند منطقه الجرح، مما يؤدي إلى منع تشنج اوانقباض الجرح بسبب نسبه خلايا البلعمة المساهمة في ذلك. في حال اطاله هذه المرحلة فان عمليه قتل وبلع الانسجه التالفه قد تزداد ويتحول الجرح إلى جرح مزمن يشكل نُدبة.
الطحال يحتوي على نصف وحيدات الجسم (monocytes)مخزنة على استعداد لنشرها في الأنسجة المصابة.[26][27] جذبت إلى مكان الجرح بواسطة عوامل النمو الصادرة عن الصفائح الدموية وخلايا أخرى، تدخل وحيدات من مجرى الدم المنطقة من خلال جدران الأوعية الدموية.[28] العديد من وحيدات الخلية تزداد حيث تصل إلى ذروة خلال يوم اويوم ونصف بعد حدوث الإصابة.[22] وبمجرد وجودهم في مكان الجرح، تنضج وحيدات الخلية إلى خلايا بلعمة. تفرز خلايا البلعمة أيضا عدد من العوامل مثل عوامل النمو والسيتوكينات الأخرى، وخصوصا خلال 3- 4 أيام بعد الإصابة. هذه العوامل تجذب الخلايا المشاركة في مرحلة النمو إلى المنطقة.[14]
في عملية التئام الجروح التي تؤدي إلى إصلاح ناقص، تحدث ندبة الانكماش، وبذلك تدرجات مختلفة من العيوب الهيكلية، وتشوهات ومشاكل مع المرونة.[29] الخلايا البلعمية قد تحد من مرحلة الانكماش.[25] وقد أفاد العلماء أن إزالة الخلايا البلعمية من حيوان السلمندر أدى في فشل استجابة التجدد نموذجية (تجدد الأطراف)، بدلا من ذلك عملت على استجابة الإصلاح الا وهو تكوين الندبة.[30][31]
عمليه تكوين النسيج الجديد
هذه العملية تبدأ بعد يومين أو ثلاثه أيام من حدوث الجرح، حتى انها قد تبدا قبل ان تنتهي المرحلة الالتهابيه.[32] والتي تتضمن:
عمليه تكوين الاوعيه الدمويه
عمليه تكوين الاوعيه الدمويه[33] تبدأ بالتزامن مع تكوين الخلايا الحُبيبيه عندما تهاجر الخلايا الباطنية إلى المنطق المجروحه.[33] بسبب وضيفه الخلايا الحُبيبيه والخلايا الضهاريه حيث ان كلا منهما يحتاج إلى الاكسجين والاغذيه، فإن هذه المرحلة مهمه لبقيه مراحل التئام الجرح مثل هجره الخلايا الحُبيبيه وخلايا البشرة الخارجيه.والنسيج الذي مر بهذه المرحلة يكون لونه مائل للحمرة بس وجود الشعيرات الدموية [33]، هذه المرحلة تحدث أيضا في عده مراحل فرعيه وهي:
- المرحلة الكامنه: خلال مرحل الالتهابات ومرحله تجلط الدم، توسعه ونفاذيه الاوعيه الدمويه تسمح للخلايا الدم البيض بأن تخرج من الاوعيه الدمويه إلى الانسجه المحيطه وبلع الانسجه المتلفة بالاضافه إلى تعقيم المنطقة المجروحه. انتفاخ الانسجه يساعد لاحقاً على تكون الاوعيه الدمويه بواسطه توسع وارتخاءللمنطقه الخلويه الخارجيه الكولاجينية .
- تنشيط الخلايا الباطنية: في هذه المرحلة تتحول الخلايا البلعميه من خلايا التهابيه إلى خلايا التآميه، حيث تبدأ بأفراز ماده باطنيه كيميائيه وعوامل نمو لجذب الخلايا الباطنية الضهاريه المجاورة. الخلايا الباطنية المنشطه تستجيب بواسطه سحب وتقليل من التقاطعات الخلويه مما يؤدي إلى ارتخاء نفسها من الخلايا الباطنية المنغمسه. تشخص هذه الخلايا بأحتوائها نواه كبيره.
- انحلال الطبقة القاعديه لنسيج الخلايا الباطنية: في هذه المرحلة تقوم كل من خلايا البلعمة والخلايا البدينه والخلايا الباطنية بإفراز انزيم البروتيرز لتحطيم الصفيحة القاعديه للوعاء الدموي الموجود.
- نمو الاوعيه الدمويه: بعد تحطيم الصفيحة القاعديه للاوعيه الدمويه، فأن الخلايا المنحله من الشعيرات الدمويه الموجوده مسبقاً أو الناتجة عن تكوين شعيرات جديدة يمكن ان تنقسم وتهاجر مجذوبة عن طريق العوامل الكيميائية إلى المنطقة المجروحه حيث تبطنها اوعيه دمويه جديده. نمو الاوعيه الدمويه يمكن ان يحصل بمساعده نقص التاكسج المحيطي وانخفاض قلويه الدم في محيط الجرح، حيث ان نقص التأكسج يؤدي إلى تحفيز عامل النسخ للخلايا الباطنية (HIF)العامل المحفز لنقص التأكسج لتفعيل جينات الاوعيه لدمويه مثل VEGF و 1GLUT .نمو الاوعيه الدمويه يمكن ان يكون نفسه تكوننا لمعيا ويدمج القنوات العمياء لتكون شبكه وعائيه دمويه جديده.
- نضج الاوعيه الدمويه: بطانه الاوعيه الدمويه تنمو بواسطه فرش الخلايا الباطنية الخارجيه الخلويه الجديده ومن بعد ذلك تكوين الصفيحة القاعديه وأخيرا الوعاء الدموي ينشأ طبقه من الخلايا الحوطيه.
الخلايا الجذعيه وخلايا الباطنية التي نُشئت من اوعيه دمويه غير مصابه، تكون لها اقدام كاذبه تدفعها خلال المحيط الخارجي للخليه في المنطقة المجروحه لتكوين وعاء دموي جديد.[34] الخلايا الباطنية تنجذب إلى المنطقة المجروحه بواسطه الفبرونكتين الموجود في الفبرين وكيميائيا بواسطه عوامل أخرى تفرز بواسطه خلايا أخرى.[32] لتهاجر الخلايا الباطنية تحتاج إلى عده انزيمات منها الكولاجينيزيز collagenases وممفعل البلاومنوجين plasminogen activator لتحليل التخثر وجزء من المحيط الخارجي الخلوي. الانزيم المعتمد على الزنك هو انزيم يهضم الغشاء القاعدي والمحيط الخارجي الخلوي ليسمح هجره الخلايا واعاده التكوين وتكوين الاوعيه الدمويه. عندما يعود التاكسج إلى مستواه الطبيعي فأن الخلايا البلعميه والخلايا التي تفرز عوامل نمو أخرى تمتلئ البيئة بحمض اللاكتيك [19] وتتوقف الخلايا عن افراز العوامل المؤثره على الاوعيه الدمويه.بالتالي تغذى الانسجه بالدم بصوره كافيه، الهجرة واعاده تكوين الانسجه الدمويه الباطنية تقل.واخيرا الاوعيه الدمويه الغير محتاجه تموت باسطه الموت البرمجي.[34]
تكوين النسيج الليفي والنسيج الحُبيبي
بالتزامن مع عمليه تكوين الاوعيه الدمويه، الخلايا الليفيه تبدا بالتجمع في المنطقة المجروحه. تيدأ الخلايا الليفيه بالدخول إلى المنطقة المجروحه من 2 إلى 5 أيام بعد حدوث الجرح عندما تنتهي المرحلة الالتهابيه، وعددها يزداد بعد الاسبوع الأول والثاني.[18] في نهايه الاسبوع الأول تكون خلايا الليفيه هي الخلايا الرئيسيه.[5] تكون النسيج الليفي ينتهي في الاسبوع الثاني. عمليه تكون النسيج الليفي كنموذج توصف بانها عمليه مماثله لعمليه تكوين الاوعيه الدمويه، فقط نوع الخلية هو الخلليه الليفيه بدلا من الخلية الباطنية. بداية المرحلة الكامنه عندما تفرز البلازما خارج منطقه الجرح، التطهير الالتهابي والتنظيف. التورم يزيد من قابليه الجرح النسيجيه على هجره الخلايا الليفيه في وقت لاحق، ثانيا، عندما تقترب عمليه الالتهابيه من الانتهاء، تفرز خلايا البلعمة والخلايا البدينه من الانسجه المجاورة عوامل كيميائيه وعوامل نمو الخلايا الليفيه.الخلايا الليفيه ترتخي من الخلايا المجاورة ومن المحيط الخارجي الخلوي. خلايا البلعمة تفرز انزيم هاضم (protease) الذي يحلل المحيط الخلوي الخارجي للانسجه المحيطه، محررا الخلايا الليفيه المنشطه لاعاده تكوين والهجرة إلى المنطقة المجروحه. الفرق بين نمو الاوعيه الدمويه واعاده تكوين الخلايا الليفيه هو ان الأول معزز بننقص الاكسجين، في حال الآخر يٌمنع بنقص التأكسج. النسيج الليفي الضام المترسب ينضج عن طريق افراز المواد الخلويه الخارجيه الي المنطقة الخلويه الخارجيه مكونه النسيج الحبيبي. اخيرا الكولاجين يترسب في المنطقة الخلويه الخارجيه (ECM). في الايام الثلاثة الأولى بعد الجرح، الخلايا الليفيه تهاجر وتنضج، لاحقاً هذه الخلايا تجمع الكولاجين في المنطقة المجروحه.[5] المنشأ لهذه الخلايا يُعتقد ان يكون من الانسجه المجاورة غير المٌتأذيه (على الرغم من ان بعض الادله انها مستمده من الدم الموجود في المناطق المجاورة).[35] في البداية الخلايا الليفيه تستخدم الياف الفبرين في الجرح (بشكل جيد في نهايه مرحله الالتهابات) لتهاجر عبر الجرح، ولاحقا التمسك بالفيبرونيكتين.[34] بعد ذلك تفرز الخلايا الليفية بعض المواد القاعديه في الجرح وبعد ذلك يُفرز الكولاجين التي سوف تلتصق به بعد الهجرة.[14] يعمل النسيج الحُبيبي كنسيج بدائي وتبدأ بالظهور في الجرح خلال المرحلة الالتهابيه بعد اثنين إلى خمسه أيام من حدوث الجرح، ويستمر في النموالى ان يتم تغطيه الجرح كاملاً.النسيج الحبيبي يتألف من الاوعيه الدمويه الجديده والخلايا الليفية والخلايا الالتهابية والخلايا الباطنية والخلايا العضليه ومكونات المحيط الخلوي الخارجي الجديده.المحيط الخلوي الخارجي المؤقت يختلف عن المحيط الخلوي العادي ومكوناته تنشأ من الخلايا الليفيه[36]، وهذه المكونات هي الفيبرونكتين، الكولاجين، الجلايكوسامينوجلايسين، الالاستين، الجلايكوبروتين، والبروتوجلايكين.[34] ولكن المكون الرئيسي هو الفيبرونيكتين وحمض الهيالورونيك واللذان يكونان مصفوفه رطبه ويسهلان هجران الخلية.[28] مؤخرا هذه المحيط الخلوي الخارجي البدائي يبدل بمحيط خلوي خارجي اخر يشابه الموجود في المنطقة غير المجروحه. عوامل النمو (PDGF، TGF-β) والفيبرونيكتين يشجعون على تكوين نسيج جديد والهجرة إلى المنطقة المجروحه وانتاج جزيئات المحيط الخلوي الخارجي بواسطه الخلايا الليفيه. الخلايا الليفيه أيضا تفرز عوامل نمو تؤدي إلى جذب الخلايا الضهاريه إلى المنطقة المجروحه.نقص التأكسج أيضا يعد مساهما في عمليه تكوين الخلايا الليفية وافراز عوامل النمو، مع ان قله الاوكسجين تؤدي إلى منع نمو وافرز النسيج الخارجي الخلوي والذي يؤدي إلى حدوث ندب ليفي شديد.
إفراز الكولاجين
من أهم الوظائف التي تقوم بها الخلايا الليفيه هي إنتاج الكولاجين.[33] عمليه افرازالكولاجين هي عمليه مهمه لانها تزيد من قوه المنطقة المجروحه، قبل ان يُفرز الكولاجين تكون هذه المنطقة مغطاه بطبقه رقيقه من الجلطة المكونه من الفبيرين والفيبرونيكتين، والتي لا توفر القوه الكافيه لتحميها من الحوادث الأخرى.أيضا[19]، الخلايا المشاركة في مرحله الالتهاب، وعمليه تكوين الاوعيه الدمويه، وعمليه تكوين النسيج الضام الملتص به والتي تنمو وتتميز على الكولاجين تُضع بواسطه الخلايا الليفيه.[37] الكولاجين نوع الثالث والفيبرونيكتين بصوره عامه يبدئون باللإفراز في كميات محدوده في خلال 10 ساعات[38] و 3 أيام[34] اعتمادا على حجم الجرح.انتشارهما يرتفع من الاسبوع الأول إلى الاسبوع الثالث.[36] حيث انهما هما المسيطران على مواد الشد إلى اخر مرحله من مرحله النمو والتي هي المرحلة الي يُستبدل بها هذا الكولاجين بنوع اخر وهو كولاجين نوع الثالث الذي يعد اقوى من الأول. مع ان الخلايا الليفية تفرز الكولاجين الا انها ايضاً تفرز انزيم الكولاجينيزيز collagenasesو الذي يحلل الكولاجين. بعد وقت قصير من حدوث الجرح عمليته تصنيع الكولاجين تعلو على عمليه هدمه، لهذا نسبته تزداد في المنطقة، لكنها أيضا تعود إلى وضعها الطبيعي في وقت لاحق.[19] في عمليه التجلط هنا تشير الي بدايه نهايه عمليه النضج.تكوين النسيج الحُبيبي يبدأ بالتوقف والخلايا الليفيه تقل في عددها عندما تنتهي وضيفتها.[39] في نهايه مرحله تكوين النسيح الحُبيبي، الخلايا الليفيه تبدأ بالموت البرمجي وتحول النسيج حُبيبي من محيط مليء بالخلايا إلى محيط مليء بالكولاجين[5]
تكوين النسيج الضهاري
تكوين النسيج الحُبيبي في الجرح المفتوح يحث على عمليه اعاده تكوين النسيج الضهاري للبدء، فخلايا النسيج الضهاري تهاجر من النسيج الجديد لتكون حاجز بين الجرح والمنطقة المحيطه.الخلايا الاساسيه المساهمة في تكوين النسيج الضهاري واللذان يكونان في حافه الجرح هما الخلايا الكيراتينه القاعديه (Basalkeratinocytes) ولواحق الجلد (dermal appendages) والذي يشمل بويصلات الشعر وغدد العرق والغدد الدهنية[39]، حيث يتقدمون على شكل غطاء من حافه الجرح ويلتقون في الوسط، عند ذلك تتوقف الحركة في تلك المنطقة.في نهايه الالتئام سوف يتكون ندبة، بويصلات شعر، خلايا عرقيه [40][41] واعصاب لم تتكون بعد. مع قله بويصلات الشعر والغدد العرقيه والاعصاب، الجرح سوف يُكون ندبه الذي يعد تحدي للسيطرة على درجه الحرارة[41] خلايا الكيراتين تهاجر قبل ان تنمو اولاً.[42] هذه الهجرة تبدأ في الساعات الأولى من حدوث الجرح. ولكن الخلايا الضهاريه تتطلب نسيج حي لتهاجر من خلاله، حيث ان لو كان الجرح عميق، يجب ان يكون مليء بالنسيج الحبيبي اولاً.[43] لهذا وقت هجران الخلايا متراوح ويمكن ان يبدأ من اليوم الأول.[44] اطراف الجرح تبدأ بالنمو في اليوم الثاني أو الثالث لتوفر خلايا أكثر للهجره إلى المنطقة.[36] في حاله ان الجدار القاعدي لم يُحطم، الخلايا الضهاريه تُستبدل خلال ثلاثه أيام بواسطه الانقسام والهجرة إلى الاعلى في الطبقة القاعديه stratum basale في نفس المبدأ الذي في المنطقة السليمه.[34] لكن في حاله خرق الجدار القاعدي فإن تكوين النسيج الضهاري يكون من حواف الجر ومن لواحق الجلد كبويصلات الشعر وغدد العرق والغدد الدهنيه التي تدخل الطبق التحت الجلديه المغطاة بالخلايا الكيراتينيه الحيه.[36] في حال ان الجرح كان عميقا جدا فإن لواحق الجلد قد تكون تأذت أيضا، بالتلي تصبح حواف الجلد هو المكان الوحيد لهجره الخلايا.[43] تحفز هجره الخلايا الكيراتينيه من فوق الجرح بواسطه نقصان في منع الاتصال وبواسطه بعض المواد الكيميائيه كأكسيد النتريك.[45] قبل ان تهاجر هذه الخلايا يجب ان تدمر الجسيمات الرابطة فيما بينها (desmosomes و hemidesmosomes)، والتي عادةً تتمركز الخلايا بواسطه الخيوط الوسطيه intermediate filaments في هياكل الخلايا والمحيط الخارجي للخليه.[22] المستقبلات البروتينيه عبر الغشائيه المسماة ب (integrins) والتي مصنوعه من البروتينات السكرية وعاده تمركز الخلية قي الجدار القاعدي بواسطه هيكل الخلية نفسها، تٌفرز من الخيوط الوسطيه للخليه وتُحول إلى خيوط الآكتين (actin filaments) لتعمل كرابط للمحيط الخارجي للخليه للاقدام الكاذبه خلال الهجرة.[22] وبالتالي الخلايا الكيراتينيه تنفصل من الجدار القاعدي وتصبح قادره على الدخول إلى المنطقة المجروحه.[32] الخلايا الكيراتينيه تغير من شكلها قبل ان تهاجر حيث تصبح أطول وأرق وتمد بعض الامتدادات الخلويه كالصفائح القدميه (lamellipodia) وامتدادات أخرى عريضه أيضا التي تبدو كالاغصان.[28] الخيوط الاكتينيه والاقدام الكاذبه تشكل في هذه المرحلة.[32] خلال هجره المستقبل البروتيني (integrins)التي على الاقدام الكاذبه الملتصقه بالمحيط الخارجي للخليه والخيوط الاكتينيه الممتده تسحب الخلية معها.[22] التداخل مع الجزيئات الموجوده في المحيط الخارجي الخلوي والمستقبلات البروتينية تشجع على تكوين الخيوط الاكتينيه والصفائح القدميه والاقدام الكاذبه.[22] تتسلق الخلايا الضهاريه الواحده فوق الأخرى لتهاجر من مكانها[39] لتكون طبقه من هذه الخلايا تدعى باللسان الضهاري.[42] أول خليه تمسك الغشاء القاعدي تكون الطبقة القاعدية.هذه الخلايا القاعديه تستمر بالهجران من خلال الجرح والخلايا الضهاريه تمتد من فوقها أيضا.[42] كلما كانت عمليه هجران الخلايا اسرع كلما قلت نسبه وجود ندبه بعد الجرح.[46] الفيبرين والفيبرونيكتين والكولاجين في المحيط الخلوي الخارجي قد تقوم بإرسال اشارات إلى الخلايا لتنقسم وتهاجر. مثل الخلايا الليفيه، الخلايا الكيراتينيه المهاجرة تستخدم الفيبرونيكنتين مع الفبرين المترسبه في الالتهاب كرابط لتزحف من خلال المنطقة.[34][39][47][48]

عندما تهاجر الخلايا الكيراتينيه فانها تزحف فوق النسيج الحُبيبي ولكن تحت الطبقة المكونه فوق الجرح (في حال كانت موجوده) لتعزل هذه الطبقة عن الانسجه الموجوده بالاسفل.[44][49] الخلايا الضهاريه لها القدرة على بلع البكتيريا والتلف الي قد تسبب في منع سير العملية بالاتجاه الصحيح.لان الطبقة التي تغطي الجرح يجب ان تزال، هجره الخلايا الكيراتينيه يُحسن بواسطه البيئة الرطبة، لان البيئة الجافه تكون ندبه كبيره وخشنه.[39] أيضا تقوم الخلايا باتلاف الاوساخ والجلطة التي تمنع طريقها من العبور خلال الجرح في المنطق المحيطه بالخلية. حيث انها تفرز انزيم البلازمينوجين المنشط الذي يفعل البلازمينوجين ويحوله إلى بلازمين والذي بدوره يقوم بتحليل الطبقة المغطيه لجرح.الخلايا تهاجرفوق الانسجه الحيه فقط[39]، لذلك يجب ان تفرز انزيم الكولاجينيز والبروتريز مثل انزيم ميتالوبروتريز (matrix metalloproteinases (MMPs)) لتحلل المناطق التالفة في المحيط الخلوي الخارجي التي في طريقها، خصوصا في واجهه الطبقة المهاجرة.[44] تقوم أيضا الخلايا الكيراتينيه بذوبان الغشاء القاعدي مستخدمةً المحيط الخلوي الخارجي الجديد الذي فٌرش بواسطه الخلايا الليفيه لتزحف من خلاله.[47] كما تواصل الخلايا الكيراتينه الزحف، فأنها تستبدل ببعض الخلايا الضهاريه الجديده التي تكونتت من حواف الجرح ليتم استبدالها لاحقا وتامين خلايا جديدة للطبقة الجديدة.[47] النمو من بعد الخلايا الكيراتينيه عادهً يبدأ بعد أيام قليله من الجرح.[43] ويتصاعد نسبته إلى أكثر من 17 مره من الموجوده في الانسجه العاديه.[47] الخلايا الضهاريه هي الوحيده التي تتكاثر من حواف الجرح إلى ان يتم تغطيه الجرح كاملا.[42] عوامل النمو تفرز بواسطه الانتغرنز و MMPs لتجعل الخلايا تبدأ بالتكاثر من حواف الجرح. خلايا الكيراتينه نفسها تنتج وتفرز عوامل من ضمنها عوامل نمو وبروتينات الغشاء القاعدي واللذان يعملان على تكوين النسيج الضهاري في المراحل الأخرى من التآم الجرح.[50] عوامل النمو أيضا مهمه لتفعيل الدفاع المناعي الاولي للمنطقه المجروحه بواسطه افرازات التي تنتج بيبتيدات المضادات الحيويه والسيتوكينات الكيميائيه المتعادله في الخلايا الكيراتينيه. الخلايا الكيراتينيه تستمر بالهجرة من خلال الجرح لحد ان يلتقي الطرفان في وسط الجرح في نقطه عندما يقوم مثبط الاتصال بوقف هجره الخلايا.[28] عندما تنتهي هجره الخلايا تقوم الخلايا الكيراتينيه بفرز بعض البروتينات من الغشاء القاعدي.[28] بعد ذلك تقوم الخلايا بعكس العمليات البايولوجيه حيث تقوم بصنع الروابط الخلويه desmosomes و hemidesmosomes وتصبح المتمركزه مره أخرى في الغشاء القاعدي.[22] الخلايا القاعديه تبدأ بالانقسام والتميز في نفس النمط الذي في الجلد الطبيعي لتكون طبقه strata الموجوده في الجلد ذو النسيج الضهاري الجديد.[28]
التقلص (Contraction)
الشد أو التقلص هو مفتاح مرحله التئام الجرح للإصلاح . إذا طالت مده التقلص قد يؤدي ذلك إلى تشويه وعدم القدرة إلى اداء الوظيفة.[29] بالتالي هناك فائده عظيمه من فهم بايولوجية انكماش الجرح.والتي يمكن ان توضع في نموذج باستخدام تقلص الكولاجين في مشروع أو نموذج مقارب للطبقه الجلديه.[25][51] التقلص يبدأ تقريبا بعد اسبوع من حدوث الجرح عندما تتميز الخلايا الليفيه وتتحول إلى خلايا عضليه[52]، في حاله الجروح السميكه فإن التقلص يبلغ حده من اليوم الخامس إلى اليوم الخامس عشر[34]، كما انه يمكن ان يبقى لعده اسابيع[43] ويستمر إلى ان يتم تكوين نسيج ضهاري جديد على الجرح.[5] الجرح الكبير يمكن ان يتقلص بنسبه 40% إلى 80% اصغر.[28][34][39][52] كما ان الجروح تتقلص بمعدل 0.75 ملم باليوم الواحد، معتمده على ارتخاء النسيج للمنطقه المجروحه.[53] لا يحصل الانكماش بصوره متناظره بل في اغلب الحالات يكون له محور الانكماش الذي يسمح لتنظيم تنسيق الخلايا مع الكولاجين بشكل اعظم.[53]
يحصل التقلص في البداية بدون مشاركه الخلايا العضليه.[29] لاحقا الخلايا الليفيه تُحفز بواسطه عوامل النمو وتتميز إلى خلايا عضليه. الخلايا العضليه مسؤولة عن الانكماش وهي شبيه بالخلايا العضلية الملساء[47]، حيث انها تحتوي على نفس الاكتين الموجود في الخلايا العضليه الملساء.[53] الخلايا العضليه تنجذب بواسطه الفيبرونيكتين وعوامل النمو حيث انهم يتحركون مع الفيبرونيكتين المتصل بالفبرين في المحيط الخارجي للخليه من اجل الوصول إلى حواف الجرح[53]، ويشكلون اتصال مع المحيط الخلوي الخارجي مع حواف الجرح، حيث يشكلون وصل بين بعضهم وبين حواف الجرح بواسطه روابط الخلية. desmosomes)fibronexus)أيضا عند الالتحام يجلب الفيبرونيكسس الاكتين الموجود في الخلايا العضليه مرتبط بجدار الخلية مع جزيئات من المحيط الخلوي الخارجي مثل الفيبرونيكتين والكولاجين.[53] الخلايا العضليه لديها العديد من الالتحامات التي تسمح بسحب المحيط الخلوي الخارجي عندما يتقلص الجرح مما يصغر حجم المنطقة.[29] في هذا الجزء من الشد، الاغلاق يحصل اسرع من الجزء المعتمد على الخلايا العضلية.[53] عندما يتقلص الاكتين في الخلية العضليه فان حواف الجرح تجلب مع بعض. اما الخلايا الليفية فهي تضع الكولاجين لتعزز الجرح عندما تنقبض الخلايا العضليه.[5] هذه المرحلة تنتهي من المرحلة النمو عندما تتوقف الخلايا العضليه عن الانقباض وتموت.[29] تحلل المصفوفه المؤقته يؤدي إلى نقص في حمض (chondroitin sulfateالهيالورونيك وزيادة سلفات الكوندرويتين) ، والذي يؤدي تدريجيا إلى وقف هجرة وتكاثرالخلايا الليفية.[18] هذه الأحداث تشير إلى بداية مرحلة النضج في عمليه التئام الجروح.
النضج واعاده البناء
عتدما تتعادل مستوى بناء وهدم الكولاجين، فٌان عمليه النضج تبدأ.[19] خلال هذه المرحلة الكولاجين من النوع الثالث الذي يكون هو السائد خلال النمو يٌستبدل بالكولاجين نوع الأول.[16] يعاد ترتيب الكولاجين غير المصفوف وربطه واعاده ترتيبه إلى جانب خطوط الشد أو التوتر.[28] بدايه مرحله النضج تتراوح بشكل واسح حيث انها تعتمد على الجرح إذا كان فد اغُلق أو بقي مفتوحاً[36]، متراوحا من ثلاثه أيام [38] إلى ثلاثه اسابيع.[54] هذه المرحلة يمكن ان تستمر لسنه أو أطول معتمده على نوع الجرح ايضاً.[36][55] كما تتقدم المرحلة فٌان قوه شد الجرح تزداد أيضا مع ندبه قويه بنسبه 80% من قوه النسيج الطبيعي.[36] وبانخفاض النشاط عند منطقه المجروحه، تفقد الندبة مضهرها المحمر بسبب موت الاوعيه الدمويه لانتهائها من وظيفتها.[19] عادهً مراحل التأم الجرح تكونه مُتنبئه وفي وقت معين، ان لم تكن كذلك فإن الجرح قد يكون مزمن[8][56][57] كالقرحة الوريديه أو ندبه جدريه.
عوامل تؤثر على التئام الجرح
عده عوامل تسيطر على فعاليه وسرعه وطريقه شفاء الجرح وهم يكون عوامل محليه أو شامله.[4]
عوامل محليه
- عوامل ميكانيكيه
- التورم
- نقص الترويه الدمويه وموت الانسجه
- اجسام غريبه
- نقص في الاكسجين
عوامل جهازية
- قله النضح
- ألتهاب
- السكري
- التغذية
- امراض الأيض
- نقص المناعة
- خلل في النسيج الضام
- التدخين
الابحاث والتطور
قبل العقد الماضي كان النموذج الكلاسيكي لالتئام الجروح الذي يحتوي على الخلايا الجذعيه التي تقتصر على اجهزه معينه، لم يكن تؤخد على محمل الجد.من بعد ذلك، مفهموم الخلايا الجذعيه البالغه الحاويه على الليونة الخلويه وعلى قدرتها على التميز إلى خلايا لا تنتسب اليها، ظهر كتفسير بديل.[3] أكثر وضوحاَ، الخلايا الاصليه المكونه لدم (التي تساهم في نمو الخلايا في الدم) يُمكن ان يكون لها القدرة على التميز مره أخرى إلى خلايا جذعيه دمويه و/أو تتحول إلى خلايا غير منتسبه اليها كالخلايا الليفيه[35]
الخلايا الجذعيه وليونه الخلايا
الخلايا الجذعيه البالغه المتعدده لها القدرة على ان تجدد نفسها وان تنتج خلايا أخرى مختلفه.حيث انها تنتج خليا اصليه ايضاً، التي هي لا تسطيع ان تجدد نفسها ولكن تستطيع ان تنتج خلايا من نوع مختلف. مدى مشاركه الخلايا الجذعيه في الاجزاء العميقه من الجلد خلال النئام الجرح هي مشاركه معقده وغير مفهومه بشكل كامل. كان يُعتقد ان البشرة والادمة يٌعد تنظيمها من خلال الانقسام النشط للخلايا الجذعيه الموجوده في قمه التلال الشبكية التي تعرف ل الخلايا الجذعيه القاعديه (rete ridges التضخم لبويصلات الشعر (خلايا الجذعيه لبويصلات الشعر) وشعيرات الادمه (خلايا الجذعيه الادميه).وعلاوه على ذلك نخاع العظم يمكن ان يحتوي على خلايا جذعيه التي تلعب دور كبير في التئام الطبقة تحت الجلد. في حالات نادره، مثل الجروح الجلديه العميقه، تُحفز بعض المجوعات الفرعيه ذو التجديد الذاتي لتشارك في عمليه الالتئام، حيث تحفز على إنتاج خلايا التي بدورها تقوم بانتاج الكولاجين ليلعب دورا مهما في اعاده ترميم الجرح. هاتان المجموعاتان الفرعيتان هما 1) الخلايا الجذعيه الوسيطه المشتقه من نخاع العظم، 2)الخلايا الجذعيه المكونه للدم. نخاع العظم ايصا يحتوي على بعض المجموعات الفرعيه المولده (الخلايا البطانية المولده)، والتي تٌحرك في نفس الاعداد لتساعد في عمليه بناءوتكوين الاوعيه الدمويه.[3] وعلاوه على ذلك، فقد اُعتقد ان الجروح الجلديه العميقه يُشجع على هجره بعض أنواع الفرعيه من خلايا الدم البيض لتساعد في عمليه التئام الجرح وهذه الخلايا هي الخلايا الليفيه.[3]
إصلاح الجرح وتجديده
الجرح هو انقطاع في شكل و/أو وظيفه نسيج معين. بعد الجرح، فأن الانسجه الهيكليه تعاد تجديدها بشكل جزئي أو كامل.[58][59] من ناحيه أخرى، النسيج الذي لا يُقطع تشكيله قد يعاد ترميمه بصوره كامله. على سبيل المثال، اعاد تجديد أو بناء جرح غير مصاب في تشكيلته يعتبر نسيج غير مجروح مثل الجلد.[60] فخلايا الجلد غير المجروح تتجدد بصوره كامله وباستمرار.[60] والفرق بين الإصلاح والتجديد هو فرق دقيق[3][58][59]، حيث أن الإصلاح هو تجديد جزئي أو غير كامل.[58] الإصلاح أو التجديد الجزئي هو تكيف فيزيولوجي للعضو للاستمرار بعد حدوث جرح بدون تبديل كامل للانسجه المفقوده أو التالفه.[58] أما التجديد الحقيقي أو الكامل فهو تبديل للانسجه التالفه أو المفقوده بانسجه مثلها تماماً من حيث الشكل والوظيفة.[59] مع هذا فالثديات عندما تصاب الجرح فانها تعيد تجديد نفسها بنفسها، وعاده لا تجدد نفسها بصوره كامله. غشاء بطانه الرحم هو مثال على الاغشيه التي تعاد تجديدها بصوره كامله بعد حوث تدخل في شكلها أو وظيفتها، حيث انه بعد ان يُتلف عند المحيض يلتأم بتجديد كامل.[59] في بعض الحالات بعد تلف الانسجه كالجلد فأن التجديد المقارب لتجديد الكامل قد حُفز بواسطه استخدام مجموعه (glycoaminoglycan-ollagenc) من الموادالقابلة للتحلل. هذه السقالات مشابه لتركيب الخلوي الخارجي في تركيبها الموجود في الانسجه الطبيعيه أو غيرالتالفه.[60] ومن المثير للاهتمام هو ان الشروط الاساسيه لتجديد الانسجه تعارض الشروط الواجبه لأصلاح الجرح، والتي تتضمن منع تفعيل الصفيحات الدموية ومنع الالتهاب ومنع الشد أو تقلص الجرح.[61] بالاضافه إلى دعم التماسك بين الخلايا الليفيه والخلايا الباطنه، فإن السقالات القابله لتحلل تمنع انكماش الجرح، بالتالي تسمح للمنطقه بأن تجدد بدون ندبه. بعض العقاقير الطبيه قد تحقق منها انها قد تكنه تمييز الخلايا العضليه الي تسبب الشد.[62] (heparin sulfate)هناك فكره جديده استوحت من كبريتات الهيبارين والتي تلعب دور رئيسي في توازن الانسجه: وهي العملية التي تُبدل الخلايا الميتة بخلايا أخرى مشابهه. في مناطق الجرح وعندما تفقد كبريتات الهيبارين فان عملية توازن الانسجة تتوقف فتمنع تبديل الخلايا الميتة بخلايا أخرى جديدة. نظائر كبريتات الهيبارين لا يمكن ان تهدم أو تحلل بواسطه كل من انزيمي الهبيارنيزيز والكولاجينيزيز وترتبط بالمناطق الشاغره المخصصه لكبريتات الهيبارين في الصفائح الخلويه الخارجيه، بالتالي تحفظتوازن النسيج الطبيعي وتمنع حدوث ندبه بعد شفاء الجرح[63][64][65]
اصلاح أو تجديد مع العامل المحفز لنقص التاكسج ، في الحالات الطبيعيه بعد الجرح فأن العامل المحفز لنقص (prolyl hydroxylases)التاكسج يتلف بواسطه انزيم البروليل هيدروكساكسليزيز. فقد وجد العلماء انه عمليه تنظيم عامل التاكسج بواسطه زيادة الانزيم الذي ذكر سابقا يجدد الانسجه المفقوده والتالفه في الثديات التي لها القدرة على الاستجابة للإصلاح، واستمراريه تنظيم هذا العمل عن طريق تقليل الانزيم ينتج عن التئام الجرح مع وجود ندبه من العمليات التجديد السابقه. هذا العامل يمكن ان ينشط أو يثبط بواسطه المركز الاساسي لتجديد في الثديات.[66][67]
التئام الجرح بدون تكون ندبه
شفاء الجرح بدون ندبة هو مبدأ معتمد على شفاء أو اصلاح الجلد (أو أي عضو) بهدف التئام النسيج المتوقع باقل ندبة ممكنة . هذا المبدا مختلط مع مبدأ الشفاء بدون ندبه تماماً، لانمبدأ الشفاء بدون ندبه ينتج عن التئام الجرح بدون أي نسيج مندب تماما. المبدأ المعاكس لشفاء بدون تكوين ندبه تماما هو التندب والذي عرف بشفاء الجرح وتكوين ندبه. تاريخيا، بعض الثقافات تعتبر ان الندبة امر جذاب[68]، ولكن، هذه ليست الحالة في المجتمع الغربي المعاصر، حيث ان بعض المرضى يُقبلون على عمليات تجميليه مع توقعات غير واقعيه. اعتمادا على نوع الندبة فأن العلاج يمكن ان يكون بتدخل جراحي (الحقن بالستيرويد أو الجراحة) و/أو العلاجات الوقائية (علاج بالضغط، مرهم السيليكون، والعلاج بالشعاع الضوئي أو الاشعاعي).[69] الحكم الطبي ضروري لتحقيق توازن فوائد هذه الطرق المختلفه من الحلول مع الاستجابة والمضاعفات الناتجه عنه وعدد كبير من هذه العلاجات قد يكون لها تأثير وهمي والادله على استخدامها هي ادله ضعيفة.[70]
في العقود الماضيه، توسعت العمليات الاساسيه البيولوجية المشاركة في اصلاح الجرح بسبب تقدم العلم البايولوجي الخلوي والجزيئي.[71] حالياً الهدف النهائي من التئام الجروح البيولوجي هو للحث على إعادة ترميم واغلاق أكثر بصورة اسرع باقل صورة ممكنه من التندب في منطقة الجرح.[72] ولكن الهدف الرئيسي من شفاء الجرح هو للحث على ترميم أفضل للمنطقه المتأثره. شفاء الجرح بدون ندبه يحدث عند الثديات في انسجة الجنين[73]، حيث ان التجديد الكامل محدوده على الفقاريات مثل السلمندر واللافقاريات.[74] اما عند الإنسان البالغ، الانسجه المجروحه تصلح بإضافه بعض الكولاجين واعادة تنظيمه واخيرا تكوين ندبه، حيث يعتقد ان شفاء الجروح عند الجنين يكون اقل تندبا أو بدون ندبه.[73] لهذا قد يستخدم شفاء جروح الجنين كنموذج شفاء الجرح عند الثديات للحصول على أفضل استجابه عند الكبار.بهدف الحصول على الادله. بعض الدراسات قد تحقق منها حيث وُجد ان شفاء الجرح عند الجنين يكون اسرع وأكثر كفاءة كما ان النسيج الناتج هو نسيج مجدد بطريقه تامة. اصل مصطلح الشفاء بدون تكون ندبه له تاريخ طويل.[75][76][77] حيث وُجد في بدايه القرن العشرين طباعه عليها مبدأ الشفاء بدون ندبه والتي ظهرت في مجله لانسيت لندن. هذه العملية تتضمن قطع مائل جراحي، بدلا من الزاوية الصحيحه . وهذه قد وصفت في بعض الصحف.[75][76][77]
تحفيز التئام الجرح من منظور النمو
جهود كبيرة قد كُرست لفهم العلاقات الفيزيائيه التي تحكم التئام الجرح وتكون الندبة، مع النماذج الرياضيه والمحفزات لوضع توضيح لهذه العلاقات.[78] نمو النسيج المحيط بالمنطقة المجروحة هو نتيجه هجره الخلايا وتحفيزها على نشر الكولاجين في المنطقة، الياف الكولاجين المصفوفة هي التي تحدد درجه التندب ، حيث ان درجه تموج ودوران الكولاجين هو من مواصفات الجلد الطبيعي ، في حال الكولاجين المصفوف هو الموجود في الانسجه المتندبه.[79] لقد وجد بأنه نمو النسيج ومدى تشكيل الندبة يمكن ان يُسيطر عليها عن طريق تخفيف الإجهاد على المنطقة المجروحه[80] كما انه يمكن ان يحفز نمو الانسجه بواسطه العلاقات الكيمياء الحيويه التي تم ذكرها سابقا المواد الكيميائيه ذات النشاط البايولوجي الفعال التي تلعب دوراً مهماً في التئام الجرح قد وضعت في نموذج معFickian diffusion لتوليد ملفات ركزة. معادله التوازن للانظمه المفتوحه عندما يضم النموذج كتله لنمو بسبب الخلايا المهاجرة وانتشارها.وهنا المعادلة Dtρ0 = Div (R) + R0 حيث ρ تعني كثافه الكتلة تدفق (هجره الخلايا)R[81] مصدر الكتلة (من تكاثر وانقسام الخلايا)R0
انماط اغلاق الجرح
النمط الاولي
- عندما يتم تقريب حواف الجرح لبعضها البعض (مخيطة\ ملصقة).
- تقلل التندب
- معظم الجروح الجراحية تلتئم عن طريق النوع الأول
- اغلاق الجرح يتم عن طريق الخيوط أو الكبسات أو اللاصق السائل أو الشريط اللاصق.
- امثلة على هذا النوع : التقرحات المعالجة بعناية، كسور العظام المجبسة لتخفيفها ، الشفاء الناتج عن زراعه الانسجة مع اوعيتها الدموية بحيث تكون متكاملة النضح الدموي (FLAP SURGERY).
النمط الثاني
- الجرح هنا يتم به التحبحب
- هنا الجراح قد يغلق الجرح أو يغطيه عن طريق الشاش أو نظام صرف السوائل والقيح الناتج عن الجرح.
التحبحب قد يؤدي إلى ندبة بنطاق اوسع .
- الشفاء هنا قد يكون بطيئا نظراً لوجود سوائل تصرف بسبب الالتهاب.-
- العناية بالجرح يجب أن تكون يومية حتى يتم تحفيز عملية ازالة الحطام فبذلك يتم السماح لعملية التحبحب بالحدوث.
- أمثلة على هذا النوع : استئصال اللثة، رأب اللثة، قلع الاسنان، حروقا ، التقرحات الشديدة ، التقرحات الناتجة عن الضغط.
النمط الثالث "الاغلاق الاولي المتأخر أو الخياطة الثانوية
- يتم تنظيف الجرح بالبداية، ثم تتم ملاحظته عادة من 4-5 أيام قبل الإلاق.
- يتم الإبقاء على الجرح مفتوحا لاهداف معينه .
- امثلة على هذا النمط : الشفاء الناتج عن ترميم الانسجة .
إذا لم يتم تقريب حواف الجرح مباشرة فان النمط الثالث هو الذي يسود وهذا النمط من الالتئام الانسب للجروح الملوثة، في اليوم الرابع بلعمه الخلايا الملوثة تتم بشكل جيد وعملية تكوين الطبقة الظاهرية وتراكم الكولاجين والنضوج للنسيج كلها تحدث، ويتم ازلة الاجسام الغريبة عن طريق الخلايا البلعمية التي قد تتحول إلى خلايا شبه ظاهرية محاطة بخلايا بيض احادية النواة لتكون الجرانيولوما أي الكتلة الحُبيبية.عادة في هذه الحالة يتم اغلاق الجرح عن طريق الجراحة وإذا لم يتم تنضيف الجرح بشكل كامل فسوف يحدث الالتهاب المزمن وبالتالي ينتهي بحدوث ندبة .
ملخص عوامل النمو المشاركة في الالتئام
| عوامل النمو | الاختصار | العضو الرئيسي | التأثير |
|---|---|---|---|
| عامل نمو البشرة | EGF |
|
|
| عامل تحويل النموα | TGF-α |
|
|
| عامل نمو الخلايا الكبدي | HGF |
|
|
| عامل نمو البطانة الوعائي | VEGF |
|
|
| عامل نمو مشتق من الصفيحات | PDGF |
|
|
| نمو الليفية factor 1&2 | FGF-1, −2 |
|
|
| عوامل تحويل النمو-β | TGF-β |
|
|
| عامل نمو الخلايا الكيراتينية | KGF |
|
|
| [82] | |||
المضاعفات التي ممكن ان تحدث خلال التئام الجروح
- قلة في تكوين الندبات؛ تؤدي إلى تمزق الجرح بسبب قلة تكوين مادة النسيج التحببي
- زيادة في تكوين الندبات «الجدرية والرباطية والناتجه عن تضخم الندبة»
- زيادة في التحبب
- زيادة في التقلص (الجلد) أو نقصان في التقلص (حرق)
- أخرى: تكلس حثلي، تغير التصبغات الجلدية، ندبات مؤلمة، فتق جراحي.
البيولوجية وبدائل الجلد والأغشية الحيوية والسقالات
وقد ساهم التقدم في الفهم السريري الجروح والفيزيولوجيا المرضية من الابتكارات الطبية الحيوية الهامة في علاج الأمراض الحادة، والمزمنة، وأنواع أخرى من الجروح، وقد وضعت العديد من البيولوجية وبدائل الجلد والأغشية الحيوية والسقالات لتسهيل التئام الجروح من خلال آليات مختلفة. وهذا يشمل منتجات مثل monoterpenes، Epicel، Laserskin، Transcyte، Dermagraft، AlloDerm/Strattice، Biobrane، Integra، Apligraf، OrCel، GraftJacket and PermaDerm. تتلخص مراجعة منهجية لهذه المنتجات مع الآليات والنتائج السريرية من قبل فياس ، وآخرون[83]
طالع أيضاً
المراجع
- ^ Q98547939، ص. 88، QID:Q98547939
- ^ Oxford English Dictionary
- ^ أ ب ت ث ج "4 The Pathophysiologic Basis for Wound Healing and Cutaneous Regeneration". Biomaterials for Treating Skin Loss. Elsevier. 28 يناير 2009. ص. 25–. ISBN:978-1-84569-554-5.
{{استشهاد بكتاب}}: الوسيط|الأول1=يفتقد|الأخير1=(مساعدة) والوسيط|الأول2=يفتقد|الأخير2=(مساعدة)[وصلة مكسورة] - ^ أ ب Rieger، S.؛ Zhao، H.؛ Martin، P.؛ Abe، K.؛ Lisse، T.S. (2014). "The role of nuclear hormone receptors in cutaneous wound repair". Cell biochemistry and function. ج. 33 ع. 1: 1–13. DOI:10.1002/cbf.3086. PMID:25529612.
- ^ أ ب ت ث ج ح خ Stadelmann، WK؛ Digenis، AG؛ Tobin، GR (1998). "Physiology and healing dynamics of chronic cutaneous wounds". American journal of surgery. ج. 176 ع. 2A Suppl: 26S–38S. DOI:10.1016/S0002-9610(98)00183-4. PMID:9777970.
- ^ Rasche، H (2001). "Haemostasis and thrombosis: an overview". European Heart Journal Supplements. ج. 3 ع. Supplement Q: Q3–Q7. DOI:10.1016/S1520-765X(01)90034-3. مؤرشف من الأصل في 2016-07-09.
- ^ Versteeg، H. H.؛ Heemskerk، J. W. M.؛ Levi، M.؛ Reitsma، P. H. (9 يناير 2013). "New Fundamentals in Hemostasis". Physiological Reviews. ج. 93 ع. 1: 327–358. DOI:10.1152/physrev.00016.2011. مؤرشف من الأصل في 2017-07-02.
- ^ أ ب ت ث Midwood، K.S.؛ Williams، L.V.؛ Schwarzbauer، J.E. (2004). "Tissue repair and the dynamics of the extracellular matrix". The International Journal of Biochemistry & Cell Biology. ج. 36 ع. 6: 1031–1037. DOI:10.1016/j.biocel.2003.12.003. PMID:15094118.
- ^ Chang، HY؛ Sneddon، JB؛ Alizadeh، AA؛ Sood، R؛ West، RB؛ Montgomery، K؛ Chi، JT؛ Van De Rijn، M؛ وآخرون (2004). "Gene expression signature of fibroblast serum response predicts human cancer progression: similarities between tumors and wounds". PLoS Biology. ج. 2 ع. 2: E7. DOI:10.1371/journal.pbio.0020007. PMC:314300. PMID:14737219. مؤرشف من الأصل في 2008-02-28.
- ^ Enoch, S. Price, P. (2004). Cellular, molecular and biochemical differences in the pathophysiology of healing between acute wounds, chronic wounds and wounds in the elderly. نسخة محفوظة 06 يوليو 2017 على موقع واي باك مشين.
- ^ Reference list is found on image main page.
- ^ John Kraft and Charles Lynde, MD, FRCPC. "Giving Burns the First, Second and Third Degree - Classification of burns". skincareguide.ca. مؤرشف من الأصل في 2018-04-06. اطلع عليه بتاريخ 2012-01-31.
Formation of a thick eschar, slow healing (>1month), Obvious scarring,
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب "POST BURN SCAR RELATIVE TO RE-EPITHELIALIZATION". Burnsurgery.org. 2011. مؤرشف من الأصل في 2014-04-25. اطلع عليه بتاريخ 2011-03-16.
Healing in 2 weeks – minimal to no scar; Healing in 3 weeks – minimal to no scar except in high risk scar formers;Healing in 4 weeks or more – hypertrophic in more than 50% of patients
{{استشهاد ويب}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ أ ب ت ث ج Rosenberg L., de la Torre J. (2006). Wound Healing, Growth Factors. Emedicine.com. Accessed January 20, 2008. نسخة محفوظة 21 نوفمبر 2008 على موقع واي باك مشين.
- ^ Sandeman، S.R.؛ Allen، M.C.؛ Liu، C.؛ Faragher، R.G.A.؛ Lloyd، A.W. (2000). "Human keratocyte migration into collagen gels declines with in vitro ageing". Mechanisms of Ageing and Development. ج. 119 ع. 3: 149–157. DOI:10.1016/S0047-6374(00)00177-9. PMID:11080534.
- ^ أ ب ت ث Dealey C. (1999). The care of wounds: A guide for nurses. Oxford ; Malden, Mass. Blackwell Science. Electronic book.
- ^ Theoret، C.L. (2004). "Update on wound repair". Clinical Techniques in Equine Practice. ج. 3 ع. 2: 110–122. DOI:10.1053/j.ctep.2004.08.009.
- ^ أ ب ت ث ج de la Torre J., Sholar A. (2006). Wound healing: Chronic wounds. Emedicine.com. Accessed January 20, 2008. نسخة محفوظة 29 أكتوبر 2008 على موقع واي باك مشين.
- ^ أ ب ت ث ج ح Greenhalgh، D.G. (1998). "The role of apoptosis in wound healing". The International Journal of Biochemistry & Cell Biology. ج. 30 ع. 9: 1019–1030. DOI:10.1016/S1357-2725(98)00058-2. PMID:9785465.
- ^ Muller، M.J.؛ Hollyoak، M.A.؛ Moaveni، Z.؛ La، T.؛ Brown، H.؛ Herndon، D.N.؛ Heggers، J.P. (2003). "Retardation of wound healing by silver sulfadiazine is reversed by Aloe vera and nystatin". Burns. ج. 29 ع. 8: 834–836. DOI:10.1016/S0305-4179(03)00198-0. PMID:14636760.
- ^ Martin، P.؛ Leibovich، SJ (2005). "Inflammatory cells during wound repair: the good, the bad and the ugly". Trends in Cell Biology. ج. 15 ع. 11: 599–607. DOI:10.1016/j.tcb.2005.09.002. PMID:16202600.
- ^ أ ب ت ث ج ح خ Santoro، M.M.؛ Gaudino، G. (2005). "Cellular and molecular facets of keratinocyte reepithelization during wound healing". Experimental Cell Research. ج. 304 ع. 1: 274–286. DOI:10.1016/j.yexcr.2004.10.033. PMID:15707592.
- ^ Expert Reviews in Molecular Medicine. (2003). The phases of cutaneous wound healing. 5: 1. Cambridge University Press. Accessed January 20, 2008. نسخة محفوظة 17 ديسمبر 2008 على موقع واي باك مشين.
- ^ Ovchinnikov، Dmitry A. (2008). "Macrophages in the embryo and beyond: Much more than just giant phagocytes". Genesis. Institute for Molecular Bioscience and Cooperative Research Centre for Chronic Inflammatory Diseases (CRC-CID), University of Queensland, Brisbane, Queensland, Australia.: researchgate.net. ج. 46 ع. 9: 447–62. DOI:10.1002/dvg.20417. PMID:18781633. مؤرشف من الأصل في 2019-04-02. اطلع عليه بتاريخ 2013-06-28.
Macrophages are present essentially in all tissues, beginning with embryonic development and, in addition to their role in host defense and in the clearance of apoptotic cells, are being increasingly recognized for their trophic function and role in regeneration.
- ^ أ ب ت Newton، P. M.؛ Watson، J. A.؛ Wolowacz، R. G.؛ Wood، E. J. (2004). "Macrophages Restrain Contraction of an In Vitro Wound Healing Model". Inflammation. ج. 28 ع. 4: 207–14. DOI:10.1023/B:IFLA.0000049045.41784.59. PMID:15673162. مؤرشف من الأصل في 2020-03-31. اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Swirski، F. K.؛ Nahrendorf، M.؛ Etzrodt، M.؛ Wildgruber، M.؛ Cortez-Retamozo، V.؛ Panizzi، P.؛ Figueiredo، J.-L.؛ Kohler، R. H.؛ وآخرون (2009). "Identification of Splenic Reservoir Monocytes and Their Deployment to Inflammatory Sites". Science. ج. 325 ع. 5940: 612–616. Bibcode:2009Sci...325..612S. DOI:10.1126/science.1175202. PMC:2803111. PMID:19644120.
- ^ Jia، T.؛ Pamer، E. G. (2009). "Dispensable But Not Irrelevant". Science. ج. 325 ع. 5940: 549–550. Bibcode:2009Sci...325..549J. DOI:10.1126/science.1178329. PMC:2917045. PMID:19644100.
- ^ أ ب ت ث ج ح خ د Lorenz H.P. and Longaker M.T. (2003). Wounds: Biology, Pathology, and Management. Stanford University Medical Center. Accessed January 20, 2008. نسخة محفوظة 24 أغسطس 2014 على موقع واي باك مشين.
- ^ أ ب ت ث ج Hinz، B (2006). "Masters and servants of the force: the role of matrix adhesions in myofibroblast force perception and transmission". European Journal of Cell Biology. ج. 85 ع. 3–4: 175–81. DOI:10.1016/j.ejcb.2005.09.004. PMID:16546559.
- ^ Souppouris، Aaron (23 مايو 2013). "Scientists identify cell that could hold the secret to limb regeneration". the verge.com. مؤرشف من الأصل في 2018-11-25.
Researchers have identified a cell that aids limb regrowth in Salamanders. Macrophages are a type of repairing cell that devour dead cells and pathogens, and trigger other immune cells to respond to pathogens.
- ^ James W. Godwin, Alexander R. Pinto, and Nadia A. Rosenthal (24 أبريل 2013). "Macrophages are required for adult salamander limb regeneration". University of Texas. مؤرشف من الأصل في 2013-11-13.
{{استشهاد ويب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت ث Falanga V. (2005). Wound Healing. American Academy of Dermatology (AAD).
- ^ أ ب ت ث Kuwahara R.T. and Rasberry R. 2007. Chemical Peels. Emedicine.com. Accessed September 15, 2007. نسخة محفوظة 25 أكتوبر 2008 على موقع واي باك مشين.
- ^ أ ب ت ث ج ح خ د ذ Romo T. and Pearson J.M. 2005. Wound Healing, Skin. Emedicine.com. Accessed December 27, 2006. نسخة محفوظة 07 ديسمبر 2008 على موقع واي باك مشين.
- ^ أ ب Song، G؛ Nguyen، DT؛ Pietramaggiori، G؛ Scherer، S؛ Chen، B؛ Zhan، Q؛ Ogawa، R؛ Yannas، IV؛ وآخرون (2010). "Use of the parabiotic model in studies of cutaneous wound healing to define the participation of circulating cells". Wound Repair and Regeneration. ج. 18 ع. 4: 426–432. DOI:10.1111/j.1524-475X.2010.00595.x. PMC:2935287. PMID:20546556.
- ^ أ ب ت ث ج ح خ Mercandetti M., Cohen A.J. (2005). Wound Healing: Healing and Repair. Emedicine.com. Accessed January 20, 2008. نسخة محفوظة 21 نوفمبر 2008 على موقع واي باك مشين.
- ^ Ruszczak، Z. (2003). "Effect of collagen matrices on dermal wound healing". Advanced Drug Delivery Reviews. ج. 55 ع. 12: 1595–1611. DOI:10.1016/j.addr.2003.08.003. PMID:14623403.
- ^ أ ب Fig. 9-1. The cellular, biochemical, and mechanical phases of wound healing. Pollock, Raphael E.; F. Charles Brunicardi; Dana K. Andersen; Billiar, Timothy R.; Dunn, David; Hunter, John G.; Matthews, Jeffrey J. (2009). Schwartz's Principles of Surgery, Ninth Edition. McGraw-Hill Professional. ISBN:0-07-154769-X.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب ت ث ج ح خ DiPietro L.A. and Burns A.L., Eds. 2003. Wound Healing: Methods and Protocols. Methods in Molecular Medicine. Totowa, N.J. Humana Press. Electronic book.
- ^ Fu XB, Sun TZ, Li XK, Sheng ZY (فبراير 2005). "Morphological and distribution characteristics of sweat glands in hypertrophic scar and their possible effects on sweat gland regeneration". Chinese Medical Journal. ج. 118 ع. 3: 186–91. PMID:15740645. مؤرشف من الأصل في 2018-06-20.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب "BURN INJURIES". nationaltraumainstitute.org. مؤرشف من الأصل في 13 أبريل 2017. اطلع عليه بتاريخ 18-03-18.
When the dermis is destroyed, the scars do not regrow hair, nerves or sweat glands, providing additional challenges to body temperature control.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ أ ب ت ث Bartkova، Jirina؛ Grøn، Birgitte؛ Dabelsteen، Erik؛ Bartek، Jiri (2003). "Cell-cycle regulatory proteins in human wound healing". Archives of Oral Biology. ج. 48 ع. 2: 125–32. DOI:10.1016/S0003-9969(02)00202-9. PMID:12642231.
- ^ أ ب ت ث Mulvaney M. and Harrington A. 1994. "نسخة مؤرشفة" (PDF). مؤرشف من الأصل (PDF) في 2003-12-18. اطلع عليه بتاريخ 2016-01-25.. In, Textbook of Military Medicine: Military Dermatology. Office of the Surgeon General, Department of the Army. Virtual Naval Hospital Project. Accessed through web archive on September 15, 2007. "نسخة مؤرشفة" (PDF). مؤرشف من الأصل (PDF) في 2020-05-22. اطلع عليه بتاريخ 2016-01-25.
- ^ أ ب ت Larjava H., Koivisto L., and Hakkinen L. 2002. Chapter 3: Keratinocyte Interactions with Fibronectin During Wound Healing. In, Heino, J. and Kahari, V.M. Cell Invasion. Medical Intelligence Unit ; 33. Georgetown, Tex., Austin, Tex Landes Bioscience, Inc. Electronic book.
- ^ Witte، Maria B؛ Barbul، Adrian (2002). "Role of nitric oxide in wound repair". The American Journal of Surgery. ج. 183 ع. 4: 406–12. DOI:10.1016/S0002-9610(02)00815-2. PMID:11975928.
- ^ Son، Hyun Joo؛ Bae، Hyun Chul؛ Kim، Hyun Jeong؛ Lee، Dong Hee؛ Han، Dong-Wook؛ Park، Jong-Chul (2005). "Effects of β-glucan on proliferation and migration of fibroblasts". Current Applied Physics. ج. 5 ع. 5: 468–71. Bibcode:2005CAP.....5..468S. DOI:10.1016/j.cap.2005.01.011.
- ^ أ ب ت ث ج Deodhar، AK؛ Rana، RE (4/1/1997). "Surgical physiology of wound healing: a review". Journal of Postgraduate Medicine. ج. 43 ع. 2: 52–6. PMID:10740722. مؤرشف من الأصل في 12 يناير 2019.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Falanga، Vincent (2004). "The chronic wound: Impaired healing and solutions in the context of wound bed preparation". Blood Cells, Molecules, and Diseases. ج. 32 ع. 1: 88–94. DOI:10.1016/j.bcmd.2003.09.020. PMID:14757419.
- ^ Etscheid، M.؛ Beer، N.؛ Dodt، J. (2005). "The hyaluronan-binding protease upregulates ERK1/2 and PI3K/Akt signalling pathways in fibroblasts and stimulates cell proliferation and migration". Cellular Signalling. ج. 17 ع. 12: 1486–94. DOI:10.1016/j.cellsig.2005.03.007. PMID:16153533.
- ^ Bayram، Yalcin؛ Deveci، Mustafa؛ Imirzalioglu، Nejat؛ Soysal، Yasemin؛ Sengezer، Mustafa (2005). "The cell based dressing with living allogenic keratinocytes in the treatment of foot ulcers: A case study". British Journal of Plastic Surgery. ج. 58 ع. 7: 988–96. DOI:10.1016/j.bjps.2005.04.031. PMID:16040019.
- ^ Grinnell، F. (1994). "Fibroblasts, myofibroblasts, and wound contraction". J. Cell Biol. ج. 124 ع. 4: 401–404. DOI:10.1083/jcb.124.4.401. PMC:2119916. PMID:8106541.
- ^ أ ب Eichler، MJ؛ Carlson، MA (2006). "Modeling dermal granulation tissue with the linear fibroblast-populated collagen matrix: a comparison with the round matrix model". Journal of dermatological science. ج. 41 ع. 2: 97–108. DOI:10.1016/j.jdermsci.2005.09.002. PMID:16226016.
- ^ أ ب ت ث ج ح Mirastschijski، U.؛ Haaksma، C.J.؛ Tomasek، J.J.؛ Ågren، M.S. (2004). "Matrix metalloproteinase inhibitor GM 6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds". Experimental Cell Research. ج. 299 ع. 2: 465–475. DOI:10.1016/j.yexcr.2004.06.007. PMID:15350544.
- ^ worldwidewounds.com> Figure 3 – The time relationship between the different processes of wound healing. by Gregory S Schultz, Glenn Ladwig and Annette Wysocki – in turn adapted from Asmussen PD, Sollner B. Mechanism of wound healing. In: Wound Care. Tutorial Medical Series. Stuttgart: Hippokrates Verlag, 1993. "نسخة مؤرشفة". مؤرشف من الأصل في 2017-07-31. اطلع عليه بتاريخ 2016-01-25.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Stashak، T.S.؛ Farstvedt، E.؛ Othic، A. (2004). "Update on wound dressings: Indications and best use". Clinical Techniques in Equine Practice. ج. 3 ع. 2: 148–163. DOI:10.1053/j.ctep.2004.08.006.
- ^ O'Leary، R؛ Wood، EJ؛ Guillou، PJ (2002). "Pathological scarring: Strategic interventions". The European journal of surgery. ج. 168 ع. 10: 523–34. PMID:12666691.
- ^ Desmoulière، Alexis؛ Chaponnier، Christine؛ Gabbiani، Giulio (2005). "Tissue repair, contraction, and the myofibroblast". Wound Repair and Regeneration. ج. 13 ع. 1: 7–12. DOI:10.1111/j.1067-1927.2005.130102.x. PMID:15659031.
- ^ أ ب ت ث Min، Su؛ Wang، Song W.؛ Orr، William (2006). "Graphic general pathology: 2.3 Incomplete regeneration:". Pathology. pathol.med.stu.edu.cn. مؤرشف من الأصل في 2016-03-03. اطلع عليه بتاريخ 2012-12-07.
The new tissue is not the same as the tissue that was lost. After the repair process has been completed, there is a loss in the structure or function of the injured tissue. In this type of repair, it is common that granulation tissue (stromal connective tissue) proliferates to fill the defect created by the necrotic cells. The necrotic cells are then replaced by scar tissue.
- ^ أ ب ت ث Min، Su؛ Wang، Song W.؛ Orr، William (2006). "Graphic general pathology: 2.2 complete regeneration:". Pathology. pathol.med.stu.edu.cn. مؤرشف من الأصل في 2016-03-03. اطلع عليه بتاريخ 2012-12-07.
(1) Complete regeneration: The new tissue is the same as the tissue that was lost. After the repair process has been completed, the structure and function of the injured tissue are completely normal
- ^ أ ب ت Min، Su؛ Wang، Song W.؛ Orr، William (2006). "Graphic general pathology: 2.2 complete regeneration:". Pathology. pathol.med.stu.edu.cn. مؤرشف من الأصل في 2016-03-03. اطلع عليه بتاريخ 2013-11-10.
After the repair process has been completed, the structure and function of the injured tissue are completely normal. This type of regeneration is common in physiological situations. Examples of physiological regeneration are the continual replacement of cells of the skin and repair of the endometrium after menstruation. Complete regeneration can occur in pathological situations in tissues that have good regenerative capacity.
- ^ Yannas، I. V.؛ Lee، E؛ Orgill، DP؛ Skrabut، EM؛ Murphy، GF (1989). "Synthesis and Characterization of a Model Extracellular Matrix that Induces Partial Regeneration of Adult Mammalian Skin". Proceedings of the National Academy of Sciences. ج. 86 ع. 3: 933–7. Bibcode:1989PNAS...86..933Y. DOI:10.1073/pnas.86.3.933. JSTOR:33315. PMC:286593. PMID:2915988.
- ^ O'Leary، R.؛ Ponnambalam، S.؛ Wood، E.J. (2003). "Pioglitazone-induced myofibroblast cell death: Implications for cutaneous scarring". British Journal of Dermatology. ج. 149 ع. 3: 665–7. DOI:10.1046/j.1365-2133.2003.05501.x. PMID:14511015.
- ^ Tong، Miao؛ Tuk، Bastiaan؛ Hekking، Ineke M.؛ Vermeij، Marcel؛ Barritault، Denis؛ Van Neck، Johan W. (2009). "Stimulated neovascularization, inflammation resolution and collagen maturation in healing rat cutaneous wounds by a heparan sulfate glycosaminoglycan mimetic, OTR4120". Wound Repair and Regeneration. ج. 17 ع. 6: 840–52. DOI:10.1111/j.1524-475X.2009.00548.x. PMID:19903305.
- ^ Barritault, D.; Caruelle, J.-P. (2006). "Les agents de régénération (ou RGTAs) : Une nouvelle approche thérapeutique" [Regenerating agents (RGTAs): a new therapeutic approach]. Annales Pharmaceutiques Françaises (بالفرنسية). 64 (2): 135–44. DOI:10.1016/S0003-4509(06)75306-8. PMID:16568015.
- ^ Van Neck et al, Heparan sulfate proteoglycan mimetics thrive tissue regeneration: an overview. In Intech book under the working title "Tissue Regeneration", ISBN 978-953-307-876-2 is scheduled for on line publication on Nov 26, 2011"[بحاجة لرقم الصفحة]
- ^ eurekalert.org staff (3 يونيو 2015). "Scientist at LIMR leads study demonstrating drug-induced tissue regeneration". eurekalert.org. Lankenau Institute for Medical Research (LIMR),. مؤرشف من الأصل في 2018-07-11. اطلع عليه بتاريخ 2015-07-03.
{{استشهاد ويب}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ Zhang Y, Strehin I, Bedelbaeva K, Gourevitch D, Clark L, Leferovich J, Messersmith PB, Heber-Katz E. Drug-induced regeneration in adult mice. Sci Transl Med. 2015;290.
- ^ Rush, J. (2005). Spiritual tattoo: a cultural history of tattooing, piercing, scarification, branding, and implants, Frog Ltd.
- ^ Brown BC, McKenna SP, Siddhi K, McGrouther DA, Bayat A؛ McKenna؛ Siddhi؛ McGrouther؛ Bayat (سبتمبر 2008). "The hidden cost of skin scars: quality of life after skin scarring". Journal of Plastic, Reconstructive & Aesthetic Surgery. ج. 61 ع. 9: 1049–58. DOI:10.1016/j.bjps.2008.03.020. PMID:18617450.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Bayat A, McGrouther DA, Ferguson MW؛ McGrouther؛ Ferguson (يناير 2003). "Skin scarring". BMJ. ج. 326 ع. 7380: 88–92. DOI:10.1136/bmj.326.7380.88. PMC:1125033. PMID:12521975. مؤرشف من الأصل في 2020-03-31.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Clark, R. (1996). The molecular and cellular biology of wound repair, Springer Us.
- ^ Tonnesen MG, Feng X, Clark RA؛ Feng؛ Clark (ديسمبر 2000). "Angiogenesis in wound healing". The Journal of Investigative Dermatology. ج. 5 ع. 1: 40–6. DOI:10.1046/j.1087-0024.2000.00014.x. PMID:11147674.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Ferguson MW, Whitby DJ, Shah M, Armstrong J, Siebert JW, Longaker MT؛ Whitby؛ Shah؛ Armstrong؛ Siebert؛ Longaker (أبريل 1996). "Scar formation: the spectral nature of fetal and adult wound repair". Plastic and Reconstructive Surgery. ج. 97 ع. 4: 854–60. DOI:10.1097/00006534-199604000-00029. PMID:8628785. مؤرشف من الأصل في 2020-05-22.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Brockes JP, Kumar A, Velloso CP؛ Kumar؛ Velloso (2001). "Regeneration as an evolutionary variable". Journal of Anatomy. ج. 199 ع. Pt 1–2: 3–11. DOI:10.1046/j.1469-7580.2001.19910003.x. PMC:1594962. PMID:11523827.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب "Scarless Healing". Star. Christchurch, New Zealand: Star. 7 يوليو 1906. ص. Page 4. مؤرشف من الأصل في 2016-03-05. اطلع عليه بتاريخ 2013-07-02.
- ^ أ ب "Scarless Healing". Marlborough Express, Volume XXXIX, Issue 160,. paperspast.natlib.govt.nz. 12 يوليو 1906. ص. Page 1. مؤرشف من الأصل في 2016-03-11. اطلع عليه بتاريخ 2013-07-02.
{{استشهاد بخبر}}: صيانة الاستشهاد: علامات ترقيم زائدة (link) - ^ أ ب "A Wonderful New Surgery". Reading Eagle. 6 يوليو 1906. ص. Page 6. مؤرشف من الأصل في 2016-03-12. اطلع عليه بتاريخ 2013-07-02.
- ^ Cumming، B. D.؛ McElwain، D. L. S.؛ Upton، Z. (2009). "A mathematical model of wound healing and subsequent scarring". Journal of the Royal Society Interface. ج. 7 ع. 42: 19–34. DOI:10.1098/rsif.2008.0536. PMC:2839370. PMID:19324672.
- ^ Gurtner، Geoffrey C.؛ Werner، Sabine؛ Barrandon، Yann؛ Longaker، Michael T. (2008). "Wound repair and regeneration". Nature. ج. 453 ع. 7193: 314–21. Bibcode:2008Natur.453..314G. DOI:10.1038/nature07039. PMID:18480812.
- ^ Gurtner، Geoffrey C.؛ Dauskardt، Reinhold H.؛ Wong، Victor W.؛ Bhatt، Kirit A.؛ Wu، Kenneth؛ Vial، Ivan N.؛ Padois، Karine؛ Korman، Joshua M.؛ Longaker، Michael T. (2011). "Improving Cutaneous Scar Formation by Controlling the Mechanical Environment". Annals of Surgery. ج. 254 ع. 2: 217–25. DOI:10.1097/SLA.0b013e318220b159. PMID:21606834.
- ^ Kuhl، E.؛ Steinmann، P. (2004). "Computational modeling of healing: An application of the material force method". Biomechanics and Modeling in Mechanobiology. ج. 2 ع. 4: 187–203. DOI:10.1007/s10237-003-0034-3. PMID:14872320.
- ^ Table 3-1 in: Mitchell, Richard Sheppard; Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson (2007). Robbins Basic Pathology. Philadelphia: Saunders. ISBN:1-4160-2973-7.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) 8th edition. - ^ Vyas KS, Vasconez HC. Wound Healing: Biologics, Skin Substitutes, Biomembranes and Scaffolds. Healthcare. 2014; 2(3):356-400. نسخة محفوظة 13 أبريل 2017 على موقع واي باك مشين.
وصلات خارجية
- How wounds heal and tumors form With this simple Flash demonstration, Harvard professor Donald Ingber explains how wounds heal, why scars form, and how tumors develop. Presented by Children's Hospital Boston.
- Wound Healing and Repair
- Lorenz H.P. and Longaker M.T. Wounds: Biology, Pathology, and Management. Stanford University Medical Center.
- Romo T. and McLaughlin L.A. 2003. Wound Healing, Skin. Emedicine.com.
- Rosenberg L. and de la Torre J. 2003. Wound Healing, Growth Factors. Emedicine.com.
- After the Injury- Children's Hospital Of Philadelphia
| التئام في المشاريع الشقيقة: | |