|
تضامنًا مع حق الشعب الفلسطيني |
احتشاء الدماغ
| احتشاء الدماغ | |
|---|---|
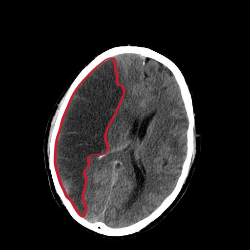 تصوير مقطعي يُظِهر احتشاء في نصف الكرة المخية الأيمن (الجهة اليسرى من الصورة).
| |
| تعديل مصدري - تعديل |
احْتِشاءُ الدِّمَاغ (بالإنجليزية: Cerebral infarction)، هي منطقة من الأنسجة الميتة في الدماغ ناتجة عن انسداد أو تضيق في الشرايين التي تغذي الدماغ بالدم والأكسجين. يؤدي نقص التروية الدموية والأكسجين المحدود إلى سكتة دماغية والتي قد تؤدي بدورها إلى احتشاء الدماغ ما لم يتم استعادة تدفق الدم خلال فترة قصيرة. يمكن أن يكون الانسداد ناتجًا عن خثرة أو صمة أو تضيق في إحدى من الشرايين المتصلبة أو في أكثر من شريان.[1] يعتمد احتشاء الدماغ على الشريان المصاب من الدماغ. وهذا يؤدي إلى اختلاف الأعراض ومآل الحالة من مصاب إلى آخر تِبعاً للشريان المصاب. يؤدي احتشاء الدماغ إلى وفاة ثلث الحالات المُصابة به.
التصنيف
هناك أنظمة تصنيف مختلفة للاحتشاء الدماغي:
- تصنيف أكسفورد للسكتات الدماغية (يعُرف باسم بامفورد أيضاً) يعتمد على الأعراض الأولية. استناداً إلى مدى الأعراض، يتم تصنيف السكتة الدماغية إلى احتشاء أمامي كامل، احتشاء أمامي جزئي، احتشاء دماغي جوبي، احتشاء خلفي. تتنبأ هذه التصنيفات الأربعة بمدى السكتة الدماغية، منطقة الدماغ المتأثرة، السبب الكامن، والتشخيص.[2][3]
- تصنيف تواست (TOAST؛ Trial of Org 10172 in Acute Stroke Treatment) يعتمد على الأعراض السريرية بالإضافة إلى نتائج الفحوصات الإضافية؛ على هذا الأساس، تصنف السكتة على أنها بسبب (1) التجلط أو الانسداد بسبب تصلب الشرايين الكبيرة، (2) سدادة قلبية المنشأ، (3) انسداد الأوعية الدموية الصغيرة، (4) سبب محدد آخر (5) سبب غير محدد (سببان محتملان أو سبب غير محدد أو فحوصات غير مكتملة).[4]
الأعراض
يتم تحديد أعراض الإحتشاء الدماغي على حسب أجزاء المخ المتضررة. إذا كان الاحتشاء موجودًا في القشرة الحركية الأولية، تظهر الأعراض في النصف المقابل. عندما يكون الضرر في جذع الدماغ، تظهر متلازمات جذع الدماغ بشكلٍ نموذجي منها؛ متلازمة ولينبرغ، متلازمة ويبر، متلازمة ميار-غوبلر، متلازمة بينديكت وأخرى. يؤدي الاحتشاء إلى ضعف وفقدان الإحساس في الجهة المقابلة من الجسم. الفحص الأولي للرأس يكشف عن أي تمدد غير طبيعي للحدقة، أو ضعف استجابة العين للضوء على الجانب المعاكس. إذا حدث الاحتشاء في الجانب الأيسر من الدماغ فسيحدث تداخل بالكلام. قد تتفاقم المنعكسات أيضاً.
عوامل الخطر
عادة ما تكون عوامل الخطر الرئيسية للاحتشاء الدماغي هي نفسها تلك المُسببة لتصلب الشرايين: ارتفاع ضغط الدم، السكري، التدخين، السمنة وارتفاع شحوم الدم.[5] توصي جمعية القلب الأمريكية بضبط هذه العوامل لتجنب خطر السكتة الدماغية وبالتالي الاحتشاء الدماغي.[6] جمعية القلب الأمريكية تقدم أيضاً معلومات حول كيفية الوقاية من السكتة الدماغية إذا كان لدى شخص ما مخاوف أكثر تحديدًا، مثل حالات فقر الدم المنجلي أو الحمل. من الممكن أيضًا حساب خطر الإصابة بالسكتة الدماغية في العقد القادم بناءً على المعلومات التي تم جمعها من خلال دراسة فرامنغهام للقلب.[7]
الفيسيولوجيا المرضية

في نقص التروية القائم على وجود خثرة، تتكون الخثرة وتمنع تدفق الدم في الشريان المُصاب.[8] تتشكل الجلطة عندما يتم تنشيط بطانة الشريان بواسطة مجموعة متنوعة من الإشارات التي تؤدي إلى تراكم الصفائح الدموية في الشريان. يتفاعل هذا التكتل من الصفائح مع الفيبرين لتشكيل انسداد صفيحي.[9] ينمو هذا الانسداد الصفيحي ليشكل خثرة، مما يؤدي إلى تضيق في الشريان. يمكن أن يحدث نقص التروية الدموية الناتجة عن الجلطات في الأوعية الدموية الكبيرة أو الصغيرة. في الأوعية الكبيرة، أكثر الأسباب شيوعًا للجلطات الدموية هي تصلب الشرايين وتضيق الأوعية. في الأوعية الصغيرة، السبب الأكثر شيوعا هو التنكس الشحمي الهياليني (Lipohyalinosis).[10] التنكس الشحمي الهياليني هو عندما يؤدي ارتفاع ضغط الدم والشيخوخة إلى تراكم المادة الدهنية الزجاجية في الأوعية الدموية.
تُشير السكتة الصمية إلى انسداد الشريان عن طريق سدادة وعائية، وهي جسيم أو حطام متحرك في مجرى الدم الشرياني ينشأ في مكان آخر. السدادة هي في الغالب خثرة، ولكن يمكن أيضًا أن تكون عددًا من المواد الأخرى بما في ذلك الدهون (على سبيل المثال من نخاع العظام في العظم المكسور) أو الهواء أو الخلايا السرطانية أو كتل من البكتيريا (عادةً من التهاب الشغاف). قد تكون السدادة ذات منشأ قلبي ناجم عن الرجفان الأذيني، أو الثقبة البيضوية الدائمة أو من لويحة تصلب الشرايين الأخرى (أو نفس الشريان) الكبير.
التشخيص
يُظِهر التصوير المقطعي والتصوير بالرنين المغناطيسي المنطقة المتضررة من الدماغ. وتُعطي تشخيصاً تفريقياً واضحاً يميز احتشاء الدماغ عن الحالات الأخرى التي قد تسبب أعراضاً مشابهة؛ كالأورام، نزف تحت الجافية. تصوير الأوعية أيضاً يُظِهر احتشاء الدماغ.
العلاج
على غرار علاج احتشاء عضلة القلب، أدرجت أدوية التخثر في علاج الاحتشاء الدماغي. يمكن اللجوء إلى استخدام منشط البلازمينوجين النسيجي عبر الوريد في المرضى الذين يصلون إلى وحدة السكتة الدماغية ويمكن تقييمهم بالكامل في غضون 3 ساعات من بداية الأعراض. إذا حدث الاحتشاء الدماغي بسبب خثرة؛ فإن العلاج النهائي يهدف إلى إزالة الانسداد عن طريق كسر الجلطة (انحلال الخثرة) أو إزالتها ميكانيكياً (استئصال الخثرة). يتم استعادة تدفق الدم بسرعة أكبر إلى الدماغ، ويموت عدد أقل من خلايا المخ.[11] مع تزايد أعداد مراكز السكتة الدماغية الأولية، يتم استخدام مذيبات الجلطات الدوائية مع منشط البلازمينوجين النسيجي الدوائي (tPA)، لإذابة الجلطة وفتح الشريان. تدخل آخر لنقص التروية الدماغية الحاد هو عن طريق إزالة الجلطة مباشرةً. يتم تحقيق ذلك عن طريق إدخال قسطرة في الشريان الفخذي، وتوجيهها إلى الدورة الدموية الدماغية، ونشر جهاز يشبه اللولب لفصل الجلطة، والتي يتم سحبها بعد ذلك من الجسم. وقد أثبتت أجهزة الاستئصال الميكانيكي فعاليتها في استعادة تدفق الدم في المرضى الذين لم يتمكنوا من تلقي أدوية التخثر أو الذين كانت الأدوية غير فعالة لديهم[12][13][14][15]، على الرغم من عدم وجود فروق بين الإصدارات الأحدث والأقدم من الأجهزة.[16] وقد تم اختبار هذه الأجهزة فقط على المرضى الذين عولجوا باستئصال الجلطة الميكانيكية في غضون ثماني ساعات من ظهور الأعراض.
بدأ النظر إلى رأب الأوعية والدعامات كحلول ممكنة لنقص التروية الحاد. تراوح معدل النجاح التقني (انخفض التضيق إلى أقل من 50 ٪) من 90-98 ٪، وتراوحت نسبة المضاعفات المحيطة بالعملية الرئيسية من 4-10 ٪. وكانت معدلات عودة التضيق أو السكتة الدماغية بعد العلاج مواتية أيضاً.[17]
إذا أظهرت الدراسات تضيق الشريان السباتي، والمريض لديه وظيفة متبقية في الجانب المصاب، فإن استئصال باطنة الشريان السباتي (الإزالة الجراحية للتضيق) قد يقلل من خطر التكرار إذا تم إجراؤه بسرعة بعد الاحتشاء الدماغي. يُجرى أيضاً استئصال بطانة الشريان السباتي لتقليل خطر احتشاء الدماغ الذي يحدث نتيجةً لتضيق الشريان السباتي العرضي (انخفاض أكثر من 70 إلى 80 ٪ في القطر).[18]
في حالة فقدان الأنسجة والتي ليست مميتة على الفور، فإن أفضل إجراء هو بذل كل جهد لاستعادة الضعف من خلال العلاج الطبيعي، والعلاج المعرفي، والعلاج المهني، والعلاج بالكلام وممارسة الرياضة.
المراجع
- ^ Ropper, Allan H.؛ Adams, Raymond Delacy؛ Brown, Robert F.؛ Victor, Maurice (2005). Adams and Victor's principles of neurology. New York: McGraw-Hill Medical Pub. Division. ص. 686–704. ISBN:0-07-141620-X.
{{استشهاد بكتاب}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ Bamford J، Sandercock P، Dennis M، Burn J، Warlow C (يونيو 1991). "Classification and natural history of clinically identifiable subtypes of cerebral infarction". Lancet. ج. 337 ع. 8756: 1521–6. DOI:10.1016/0140-6736(91)93206-O. PMID:1675378. مؤرشف من الأصل في 2018-05-22. Later publications distinguish between "syndrome" and "infarct", based on evidence from imaging. "Syndrome" may be replaced by "hemorrhage" if imaging demonstrates a bleed. See Internet Stroke Center. "Oxford Stroke Scale". مؤرشف من الأصل في 2011-09-28. اطلع عليه بتاريخ 2008-11-14.
- ^ Bamford JM (2000). "The role of the clinical examination in the subclassification of stroke". Cerebrovasc. Dis. 10 Suppl 4: 2–4. DOI:10.1159/000047582. PMID:11070389.
- ^ Adams HP، Bendixen BH، Kappelle LJ، وآخرون (يناير 1993). "Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment". Stroke. ج. 24 ع. 1: 35–41. DOI:10.1161/01.STR.24.1.35. PMID:7678184. مؤرشف من الأصل (PDF) في 2011-06-25.
- ^ Hankey GJ (أغسطس 2006). "Potential new risk factors for ischemic stroke: what is their potential?". Stroke. ج. 37 ع. 8: 2181–8. DOI:10.1161/01.STR.0000229883.72010.e4. PMID:16809576.
- ^ Furie KL، Kasner SE، Adams RJ، وآخرون (يناير 2011). "Guidelines for the Prevention of Stroke in Patients With Stroke or Transient Ischemic Attack: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association". Stroke. ج. 42 ع. 1: 227–76. DOI:10.1161/STR.0b013e3181f7d043. PMID:20966421.
- ^ D'Agostino RB، Wolf PA، Belanger AJ، Kannel WB (يناير 1994). "Stroke risk profile: adjustment for antihypertensive medication. The Framingham Study". Stroke. ج. 25 ع. 1: 40–3. DOI:10.1161/01.str.25.1.40. PMID:8266381.
- ^ Louis R. Caplan (2009). Caplan's Stroke: A Clinical Approach. Elsevier Health Sciences. ISBN:1-4160-4721-2. مؤرشف من الأصل في 2014-06-29.
- ^ Samad F، Ruf W (نوفمبر 2013). "Inflammation, obesity, and thrombosis". Blood. ج. 122 ع. 20: 3415–22. DOI:10.1182/blood-2013-05-427708. PMC:3829115. PMID:24092932.
- ^ Lastilla M (2006). "Lacunar infarct". Clin. Exp. Hypertens. ج. 28 ع. 3–4: 205–15. DOI:10.1080/10641960600549082. PMID:16833026.
- ^ Saver JL (2006). "Time is brain - quantified". Stroke. ج. 37 ع. 1: 263–6. DOI:10.1161/01.STR.0000196957.55928.ab. PMID:16339467. مؤرشف من الأصل في 2011-05-11. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Flint AC، Duckwiler GR، Budzik RF، Liebeskind DS، Smith WS (2007). "Mechanical thrombectomy of intracranial internal carotid occlusion: pooled results of the MERCI and Multi MERCI Part I trials". Stroke. ج. 38 ع. 4: 1274–80. DOI:10.1161/01.STR.0000260187.33864.a7. PMID:17332445. مؤرشف من الأصل في 2022-04-08.
- ^ Smith WS، Sung G، Starkman S، وآخرون (2005). "Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial". Stroke. ج. 36 ع. 7: 1432–8. DOI:10.1161/01.STR.0000171066.25248.1d. PMID:15961709. مؤرشف من الأصل في 2011-07-02.
- ^ Lutsep HL، Rymer MM، Nesbit GM (2008). "Vertebrobasilar revascularization rates and outcomes in the MERCI and multi-MERCI trials". J Stroke Cerebrovasc Dis. ج. 17 ع. 2: 55–7. DOI:10.1016/j.jstrokecerebrovasdis.2007.11.003. PMID:18346645.
- ^ Smith WS (1 يونيو 2006). "Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi Mechanical Embolus Removal in Cerebral Ischemia (MERCI) trial, part I". AJNR Am J Neuroradiol. ج. 27 ع. 6: 1177–82. PMID:16775259. مؤرشف من الأصل في 2011-08-26.
- ^ Smith WS، Sung G، Saver J، وآخرون (2008). "Mechanical thrombectomy for acute ischemic stroke: final results of the Multi MERCI trial". Stroke. ج. 39 ع. 4: 1205–12. DOI:10.1161/STROKEAHA.107.497115. PMID:18309168.
- ^ Derdeyn CP، Chimowitz MI (أغسطس 2007). "Angioplasty and Stenting for Atherosclerotic Intracranial Stenosis: Rationale for a Randomized Clinical Trial". Neuroimaging Clin. N. Am. ج. 17 ع. 3: 355–63, viii–ix. DOI:10.1016/j.nic.2007.05.001. PMC:2040119. PMID:17826637.
- ^ Ropper، A.H.؛ Brown، R.H. (2005). Adams and Victor's Principles of Neurology. ص. 698. ISBN:0-07-141620-X.
| في كومنز صور وملفات عن: احتشاء الدماغ |