|
تضامنًا مع حق الشعب الفلسطيني |
إيزوكينولين
| إيزوكينولين | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Isoquinoline |
|
| أسماء أخرى | |
benzo[c]pyridine, 2-benzanine |
|
| المعرفات | |
| رقم CAS | 119-65-3 |
| بوب كيم (PubChem) | 8405 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C9H7N |
| كتلة مولية | 129.16 غ.مول−1 |
| المظهر | yellowish oily liquid, hygroscopic platelets when solid |
| الكثافة | 1.099 g/cm3 |
| نقطة الانصهار | 26 - 28 °س، 271 °ك، 8 °ف |
| نقطة الغليان | 242 °س، 515 °ك، 468 °ف |
| حموضة (pKa) | pKBH+=5.14[1] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
إيزوكينولين[2] هو مركب عضوي حلقي غير متجانس عطري وهوايزومير بنيوي من الكينولين؛ تعتبر أشباه القلويات الطبيعية التي تحوى في بناءها نواة بنزيل ايزوكينولين من أكبر مجموعات اشباه القلويات لاستخدامها كعقارات طبية. بعض اشباه القلويات هذه بسيطة البناء مثل شبه القلوى بابافرين.[3][4][5][6][7][8]
الخواص
- سائل – له رائحه محببه لاذعه يغلي عند 243°م.
- لايذوب في الماء ولكنه يذوب في كثير من المذيبات العضوية كما يذوب في الحموض المخففة.
- يستخدم كمذيب عند الحاجة إلى مذيب ذى درجة حرارة عالية.
الإنتاج
تم عزل الايزوكينولين أول من قطران الفحم في عام 1885 من قبل هوجويرف وفان دورب.[9]
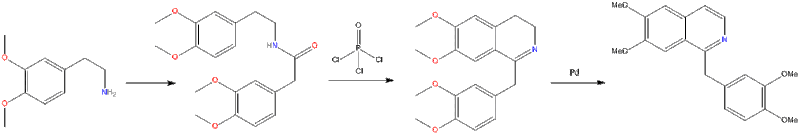
تحضير الايزوكينولين طريقة بشلر- نبير السكى
ترتكز هذه الطريقة على معاملة 2- فينيل اثيل امين بحمض كربوكسيلى أو كلوريده، فيتكون اولاً الاميد المطابق الذي يتحلق عند فقده جزيئاً من الماء إلى مركب وسطى في وجود حمض لويس أو حمض الكبريتيك ثم يتكون في النهاية الايزوكينولين بنزع الهيدروجين من المركب الناتج بواسطة الكربون والبلاديوم كعامل مساعد.
 عدة طرق أخرى مفيدة لتحضير مختلف مشتقات الايزوكينولين.
عدة طرق أخرى مفيدة لتحضير مختلف مشتقات الايزوكينولين.
التفاعلات
تكون تفاعلات الاستبدال النيوكلوفيليه على الحلقة غير المتجانسة بشكل مشابه لما يتم في حلقة البيريدين لكن اسرع نظراً للزيادة المتوقعه في ثباتية المركبات الوسطية والنهائية بسبب التعاقب الناتج من وجود حلقة البنزين. •يكون الاستبدال النيوكلوفيلى على حلقة الكينولين في الموضع 2 أو 4 بينما يتم في الايزوكينولين على الموضع 1 . •مثال – ادخال مجموعة امين على الكينولين في الموضع 2 أو 4.
المراجع
- ^ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ^ Q113378673، ص. 285، QID:Q113378673
- ^ Gilchrist, T.L. (1997). Heterocyclic Chemistry (3rd ed.). Essex, UK: Addison Wesley Longman.
- ^ Harris, J.; Pope, W.J. "isoQuinoline and the isoQuinoline-Reds" Journal of the Chemical Society (1922) volume 121, pp. 1029–1033.
- ^ Katritsky, A.R.; Pozharskii, A.F. (2000). Handbook of Heterocyclic Chemistry (2nd ed.). Oxford, UK: Elsevier.
- ^ Katritsky, A.R.; Rees, C.W.; Scriven, E.F. (Eds.). (1996). Comprehensive Heterocyclic Chemistry II: A Review of the Literature 1982–1995 (Vol. 5). Tarrytown, NY: Elsevier.
- ^ Nagatsu, T. "Isoquinoline neurotoxins in the brain and Parkinson's disease" Neuroscience Research (1997) volume 29, pp. 99–111.
- ^ O'Neil, Maryadele J. (Ed.). (2001). The Merck Index (13th ed.). Whitehouse Station, NJ: Merck.
- ^ S. Hoogewerf and W.A. van Dorp (1885) "Sur un isomére de la quinoléine" (On an isomer of quinoline), Recueil des Travaux Chemiques des Pays-Bas (Collection of Work in Chemistry in the Netherlands), vol.4, no. 4, pages 125–129. See also: S. Hoogewerf and W.A. van Dorp (1886) "Sur quelques dérivés de l'isoquinoléine" (On some derivatives of isoquinoline), Recueil des Travaux Chemiques des Pays-Bas, vol.5, no. 9, pages 305–312.
| في كومنز صور وملفات عن: إيزوكينولين |