|
تضامنًا مع حق الشعب الفلسطيني |
فلوريد النحاس الثنائي
| فلوريد النحاس الثنائي | |
|---|---|
| الاسم النظامي (IUPAC) | |
فلوريد النحاس الثنائي |
|
| المعرفات | |
| رقم CAS | 7789-19-7 |
| الخواص | |
| الصيغة الجزيئية | CuF2 |
| الكتلة المولية | 101.543 غ/مول |
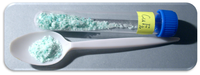
| المظهر | بلورات بيضاء (خالي من الماء) مسوق أزرق باهت (ثنائي هيدرات) |
| الكثافة | 2.93 غ/سم3 (ثنائي هيدرات) |
| نقطة الانصهار | 836 °س |
| نقطة الغليان | 1676 °س |
| الذوبانية في الماء | ضعيف الانحلال في الماء |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
فلوريد النحاس الثنائي مركب كيميائي له الصيغة CuF2 ، ويكون على شكل بلورات بيضاء شغوفة للرطوبة في الشكل الخالي من الماء، في حال دخول جزيئتي ماء في تركيب البنية البلورية (ثنائي هيدرات) يكون على شكل مسحوق أزرق باهت.
الخواص
- عدد أكسدة النحاس في هذا المركب +2.
- لمركب فلوريد النحاس اثنائي انحلالية ضعيفة في الماء، لكنه ينحل في الأحماض.
التحضير
يحضر مركب فلوريد النحاس الثنائي من تفاعل حمض هيدروفلوريك مع كربونات النحاس
- 2HF + CuCO3 → CuF2 + H2O + CO2
أو من التفاعل المباشر لعنصري النحاس والفلور عند الدرجة 400°س
- Cu + F2 → CuF2
يفقد المركب لذرة فلور في الحالة المصهورة عند درجات حرارة تفوق 950°س.
- 2CuF2 → 2CuF + F2
- 2CuF → CuF2 + Cu
يمكن للمعقدات التالية CuF3− و CuF42− و CuF64− أن تتشكل في حال وجود زيادة من أنيونات الفلور في المزيج.
الاستخدامات
- يستخدم فلوريد النحاس الثنائي في تفاعلات فلورة الهيدروكربونات العطرية في جو غني بالأكسجين عند درجات حرارة تفوق 450°س.
تفاعل الفلورة هذا أبسط من تفاعل ساندماير، لكنه يطبق فقط على المركبات التي لها ثباتية تجاه درجات الحرارة المرتفعة.[2]
المراجع
- ^ Copper(II) fluoride 98% | Sigma-Aldrich نسخة محفوظة 9 نوفمبر 2020 على موقع واي باك مشين.
- ^ M. A. Subramanian, L. E. Manzer (2002). "A "Greener" Synthetic Route for Fluoroaromatics via Copper (II) Fluoride". ساينس. ج. 297: 1665. DOI:10.1126/science.1076397. PMID:12215637.
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
| في كومنز صور وملفات عن: فلوريد النحاس الثنائي |