|
تضامنًا مع حق الشعب الفلسطيني |
ميالين
| Myelin | |
|---|---|
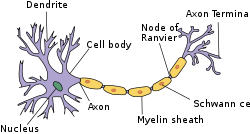
Structure of simplified neuron in the PNS
| |
 Neuron with oligodendrocyte and myelin sheath in the CNS
| |
| تفاصيل | |
| نظام أحيائي | Nervous system |
| تعديل مصدري - تعديل | |
المَيَالين (بالإنجليزية: Myelin) أو النخاعين[1] مادة دهنية تحيط بالمحور العصبي لبعض الخلايا العصبية (العصبونات)، مكونة طبقة عازلة كهربائيا هي «غمد المايلين»، عادة حول محور عصبي واحد فقط من الخلايا العصبية. ويعتبر ضروري جداً لحسن سير السيالة في الجهاز العصبي.
الميالين هو نوع من الخلايا الدبقية. يسمى إنتاج غمد النخاعين تكون الميالين. في البشر، يبدأ إنتاج النخاعين في الأسبوع الرابع عشر من مراحل تطور الجنين، على الرغم من وجود القليل من النخاعين في الدماغ في وقت الولادة. خلال مرحلة الطفولة يتكون الميالين بسرعة ويستمر إنتاجه من خلال مراحل الحياة للمراهقين.
التكوين
يتم تكوين الميالين من قبل أنواع مختلفة من الخلايا، وتختلف في التركيب الكيميائي والتكوين، ولكن تؤدي الوظيفة العازلة نفسها. المحاور العصبية المغلفة بالميالين بيضاء في المظهر، تشبه «المادة البيضاء» في الدماغ. الميالين يساعد على عزل المحاور من الذرات المشحونة كهربائيا والجزيئات. تم العثور على هذه الجسيمات المشحونة (أيونات) في السائل المحيط بالجهاز العصبي بأكمله. تحت المجهر، المايلين يشبه سلاسل من «النقانق».الكولسترول هو المكون الأساسي للميالين. الميالين يتكون من حوالي 40 ٪ مياه؛ الكتلة الجافة حوالي 70 - 85 ٪ دهون وحوالى 15- 30 ٪ بروتينات. بعض البروتينات هي البروتين أساسي الميالين، ميالين دبقي قليل التغصن (بروتين سكري)، والبروتين (شحم بروتيني). الدهن الأساسي للمايلين هو شحمي سكري يُسمى (galactocerebroside). السلاسل الهيدروكربونية متشابكة من (sphingomelin).
التطور
تسمى العملية التي تؤدي لإنتاج الميالين بعملية تكوّن الميالين أو تخليق الميالين. تتمايز الخلايا السلف للخلايا الدبقية قليلة التغصن، في الجهاز العصبي المركزي، إلى خلايا ناضجة مسؤولة عن تكوين الميالين. يبدأ تكوين الميالين لدى البشر باكرًا في الثلث الثالث من الحمل، ومع ذلك، لا يوجد سوى القليل من الميالين في الجهاز العصبي المركزي والجهاز العصبي المحيطي عند الولادة. خلال مرحلة الطفولة، تتطور عملية تكوّن الميالين بسرعة مع زيادة أعداد المحاور المغلفة بالميالين، وهذا يتوافق مع تطور المهارات المعرفية والحركية، كفهم اللغة واكتساب الكلام والزحف والمشي. يستمر تكوين الميالين خلال فترة المراهقة والبلوغ المبكر، وعلى الرغم من اكتماله إلى حد كبير في هذه المرحلة العمرية، يمكن إضافة أغلفة ميالين جديدة في مناطق المادة الرمادية، كالقشرة الدماغية، طوال الحياة.[2][3][4]
التوزع بين الأنواع
| العصبون |
|---|
يعتبر الميالين من الخصائص المميزة للفقاريات الفكية (الفكيات)، ومع ذلك، تكون المحاور لدى اللافقاريات مغلفة بنوع من الخلايا الدبقية. تختلف هذه اللفائف الدبقية تمامًا عن الميالين المتين الموجود لدى الفقاريات، والذي يتكون، كما هو موضح أعلاه، عن طريق التفاف متحد المركز لناميات الخلية المكونة للميالين حول المحور العصبي عدة مرات. وصف رودلف فيرخوف الميالين لأول مرة في عام 1854، ومع ذلك، لم يغدو أصل الخلية الدبقية والتركيب الدقيق لها واضحًا إلى أن اخترع المجهر الإلكتروني بعد مرور أكثر من قرن على وصف فيرخوف.[5]
لا يغلف الميالين جميع المحاور لدى الفقاريات. على سبيل المثال، تكون نسبة كبيرة من المحاور في الجهاز العصبي المحيطي غير مغلفة بالميالين. عوضًا عن ذلك، تغلف هذه المحاور بخلايا شوان غير المكونة للميالين المعروفة باسم خلايا شوان ريماك والمرصوفة ضمن حزم ريماك. في الجهاز العصبي المركزي، تتداخل المحاور غير المغلفة بالميالين (أو المحاور المغلفة جزئيًا بالميالين، أي تتألف من أجزاء طويلة غير مغلفة بالميالين ممتدة بين الأجزاء المغلفة به) مع تلك المغلفة به وتتشابك، جزئيًا على الأقل، بناميات تعود لنوع آخر من الخلايا الدبقية، وهي الخلايا النجمية.[6]
الأهمية السريرية
زوال الميالين
يعبر مصطلح زوال الميالين عن عملية فقدان غمد الميالين المغلف للأعصاب، وهي سمة المميزة لبعض أمراض المناعة الذاتية العصبية التنكسية، كالتصلب المتعدد والتهاب الدماغ والنخاع الحاد المنتشر والتهاب النخاع والعصب البصري والتهاب النخاع المستعرض واعتلال الأعصاب المتعدد الالتهابي المزمن المزيل للميالين ومتلازمة غيلان باريه وتحلل الميالين الجسري المركزي، وللأمراض الموروثة المزيلة للميالين، كحثل المادة البيضاء و مرض شاركو ماري توث مثلًا. يمكن للأشخاص الذين يعانون من فقر الدم الخبيث أيضا أن يصابوا بتلف الأعصاب إذا لم يتم تشخيص الحالة بسرعة. يمكن أن يؤدي التنكس المشترك تحت الحاد للحبل الشوكي الثانوي لفقر الدم الخبيث إلى تلف طفيف في الأعصاب الطرفية إلى تلف شديد في الجهاز العصبي المركزي، مما يؤثر على الكلام، التوازن، والوعي المعرفي. يؤدي تحلل الميالين إلى إضعاف القدرة على نقل الإشارات على مسار العصب أو فقدانها، ما يقود في النهاية لضمور العصب. تسمى الحالات الشديدة لتحلل الميالين بداء كانافان.[7]
قد يلعب الجهاز المناعي دورًا في زوال الميالين المرتبط بمثل هذه الأمراض، وهذا يتضمن العملية الالتهابية التي تؤدي إلى زوال الميالين نتيجة الإنتاج المفرط للسيتوكينات بزيادة التعبير عن عامل النخر الورمي أو الإنترفيرونات. أثبت التصوير بالرنين المغناطيسي أن إستر إيثيل حمض الدوكوساهكساينويك يدعم عملية تكوين الميالين في الاضطرابات البيروكسية المعممة.
المراجع
- ^ قاموس المورد، البعلبكي، بيروت، لبنان.
- ^ Hughes EG، Orthmann-Murphy JL، Langseth AJ، Bergles DE (مايو 2018). "Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex". Nature Neuroscience. ج. 21 ع. 5: 696–706. DOI:10.1038/s41593-018-0121-5. PMC:5920726. PMID:29556025.
- ^ Hill RA، Li AM، Grutzendler J (مايو 2018). "Lifelong cortical myelin plasticity and age-related degeneration in the live mammalian brain". Nature Neuroscience. ج. 21 ع. 5: 683–695. DOI:10.1038/s41593-018-0120-6. PMC:5920745. PMID:29556031.
- ^ Swire M، Ffrench-Constant C (مايو 2018). "Seeing Is Believing: Myelin Dynamics in the Adult CNS". Neuron. ج. 98 ع. 4: 684–686. DOI:10.1016/j.neuron.2018.05.005. PMID:29772200.
- ^ Boullerne AI (سبتمبر 2016). "The history of myelin". Experimental Neurology. ج. 283 ع. Pt B: 431–445. DOI:10.1016/j.expneurol.2016.06.005. PMC:5010938. PMID:27288241.
- ^ Wang، Doris D.؛ Bordey، Angélique (11 ديسمبر 2008). "The astrocyte odyssey". Progress in Neurobiology. ج. 86 ع. 4: 342–367. DOI:10.1016/j.pneurobio.2008.09.015. PMC:2613184. PMID:18948166.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|بواسطة=تم تجاهله يقترح استخدام|via=(مساعدة) - ^ Hartline DK (مايو 2008). "What is myelin?". Neuron Glia Biology. ج. 4 ع. 2: 153–63. DOI:10.1017/S1740925X09990263. PMID:19737435. S2CID:33164806.